39315 skanowanie0045

Na podstawie odczytanej z biurety objętości zużytego roztworu KMn04 obliczyć jgfli stężenie z dokładnością do 0,0001 mol/dm'.
Środki ostrożności
Roztwór manganianu(VII) potasu pozostawia trwałe ciemne plamy na odzieży. Roztwór kwasu siarkowego(VI) jest żrący.
Postępowanie z odpadami
Roztwór kwasu szczawiowego w zlewu* można zostawić dla innych osób wyko* nujących to samo ćwiczenie lub wylać ] do zlewu. Zawartość kolby po miarccH kowaniu wylać do pojemnika na zlewa soli metali ciężkich.
Przykładowe obliczenia.
Zadanie: Obliczyć dokładne stężenie roztworu manganianu(VII) potasu, jeśli na mlinffl kowanie 20,00 cm3 roztworu kwasu szczawiowego o stężeniu 0,0300 mol/dm1 /iifyłe 19,50 cm3 roztworu manganianu(VII).
1. W 1000 cm3 roztworu H2C204 o stężeniu 0,0300 mol/dm3 znajduje się 0,0300 czystego chemicznie kwasu, zatem w 20,00 cm3 powinno się go znaleźć
1000 cm3. 0,0300 mola jgjMg 20^0300 =(,,000600 = 6,0,).
20,00 cm3 -— 11 1000
cm3 • mol ,
2. Zgodnie z równaniem reakcji: 2 Mn04 + 5 C204" + 16 H+ -> 2 Mn2+ + 10 CO. + H 5 mol jonów C2041 odpowiada 2 molom KMn04, zatem 6,00 • 10-4 mola kwasu (j wiowego odpowiada:
.Els
2 mole Mn04' — 5moliC2Of 6,00 10"4-2 W „„ Ul
ly X>2 * J.U
x, — 6,00 • 10‘4 mola b «
mol
3. 2,40 • 10-4 mola KMn04 znajduje się w 19,50 cm3 roztworu, zatem w 1 dm3 znajduj* I
2,40 • 10"4 mola KMn04 — 19,50 cm3 roztworu 2,40 • 10'4 • 1000
, =>x,=--=
. x3 — 1000 cm roztworu 19,50
[mol - cm3
= 0,0123 I——= mol
KMnO,
Zatem stężenie mianowanego roztworu KMn04 wynosi 0,0123 mol/dm3.
Pytania dodatkowe
1. Wytłumacz, dlaczego podwyższona temperatura wymagana jest tylko w począł Iw iwtf} fazie miareczkowania.
2. Czy w tym ćwiczeniu zamiast kwasu siarkowego!VI) może zostać użyty kwas wiliiyf Odpowiedź uzasadnij.
1,1.2. Oznaczenia manganomctryczne
Uili/ynnjki
|(l% roztwór kwasu siarkowego(VI), mianowany roztwór KMn04.
Ifodkl ostrożności
M< isfilwór manganianu(VII) potasu pozo-Dlawla trwałe ciemne plamy na odzieży. Hu/, twór kwasu siarkowego(YI) jest żrący.
Szkło
Kolba stożkowa (200-300 cm1 2), biureta z mianowanym roztworem KMn04, cylinder miarowy (50 cm2).
Postępowanie z odpadami
Zawartość kolby wylać do pojemnika na zlewki soli metali ciężkich.
Przykładowe obliczenia.
Zadanie: obliczyć ilość gramów jonów szczawianowych zawartych w otrzymanej próbce, Jeśli na jej zmiareczkowanie zużyto 12,5 cm2 roztworu manganianu(VII) potasu o stężeniu
0. 0123 mol/dm2.
1. W 1000 cm2 roztworu KMn04 o stężeniu 0,0123 mol/dm2 znajduje się 0,0123 mola czystej chemicznie soli, zatem w 12,5 cm2 powinno się go znaleźć:
1000 cm2 m 0,0123 mola | * 12^0123 = ^ m ^. 10-1BfcfflJ§J
12,5cm2 — *i 1000 L Cm
2 mole MnO* -—£5 moli Cj Oj" i, 54 ■ 10'3 mola MnOI '$L§ x2 ,
>Xi =
_ Ł54 • 5 _
= 3,85 -10"
mol ■ mol mol
= mol
Odpowiedź: W próbce znajdowało się 0,0339 g jonów szczawianowych.
mol-g
mol
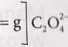
lmolC2Of —88,02 3,85 •10’4 molaC-Oj- — x3
’ 2 4 9
335 10_!-88,02 =0i0339
Zgodnie z równaniem reakcji: 2 MnO" + 5 C204" + 16 H*-> 2 Mn2+ + 10 C02 + 8 H20 5 moli jonów CjO," odpowiada 2 molom KMn04, zatem 1,54 • 10-4 mola mangania-nu(VII) odpowiada:
1 mol jonów szczawianowych ma masę 88,02 g, a zatem 3,85 • 10"4 mola będzie mleć
masę:
Wyszukiwarka
Podobne podstrony:
img175 175 Celujemy do wybranago punktu w dwóch położeniach kręgu oraz obliczany na podstawi© odczyt
img175 (6) 175 Celu jemy do wybranego punktu w dwóch położeniach kręgu ora7. cbliezaHy na podstawie
img175 175 Celujemy do wybranago punktu w dwóch położeniach kręgu oraz obliczany na podstawi© odczyt
img175 175 Celujemy do wybranago punktu w dwóch położeniach kręgu oraz obliczany na podstawi© odczyt
skanowanie0055 2 na podstawie do ty eliczasowy cli wyników badań można formułować co najmniej cztery
18737 skanowanie0069 (6) s Na podstawie analizy schematu określ kierunek zmian ewolucyjnych u prze&l
10745096x1117098611256?1018701 n mm *. ii Na podstawie odczytu wykonanego dla przesączu glebowego ok
wyznaczonym na podstawie odczytu zanurzenia na śródokręciu. Dokładnie opisano to zagadnienie w rozdz
img175 (6) 175 Celu jemy do wybranego punktu w dwóch położeniach kręgu ora7. cbliezaHy na podstawie
BiSS003b KLOPI Strona 7. Kopia wypełnionego formularza obliczania masy ładunku na
img175 (6) 175 Celu jemy do wybranego punktu w dwóch położeniach kręgu ora7. cbliezaHy na podstawie
egzanmin 1) Na podstawie definicji pokazać, że2> 2w + 2 2/i = +00 . f e* dz 2)
1. Na podstawie danych z bilansu spółki „Alfa" z dwóch kolejnych obliczyć i zinterpretować
1. Na podstawie danych z bilansu spółki „Alfa" z dwóch kolejnych obliczyć i
więcej podobnych podstron