40331 skan0024 (2)

48 L. SKULSKI i p-hydroksyazobenzenu w części widzialnej przesuwa się również w kierunku fal krótkich, w tym przypadku jednak obserwujemy wzrost absorpcji (rys. 10).
b. Przejścia 7r-+7t*, przejścia typu intramolecular charge transfer (wpływ rozpuszczalnika protonodonorowego). Gdy protonoakceptorowe własności cząsteczki rozpuszczonej w aktywnym rozpuszczalniku protonodonoro-wym wzrastają w wyniku przejścia elektronowego, wtedy międzyczą-steczkowe wiązanie wodorowe z rozpuszczalnikiem ulega wzmoniec-niu we wzbudzonym stanie elektronowym. Obniża to energię stanu wzbudzonego w większym stopniu niż energię stanu podstawowego, a więc energia takiego przejścia elektronowego w rozpuszczalniku aktywnym jest mniejsza od energii przejścia w rozpuszczalniku nieaktywnym: obserwujemy wtedy efekt batochromowy (red shift) spowodowany zmianą rozpuszczalnika nieaktywnego na protonodonorowy.
Porównanie widm absorpcji (mierzonych w cykloheksanie, etanolu i wodzie) acetofenonu, nitrobenzenu i m-nitrostyrenu (tab. 1) wskazuje,
Tabela 1
Batochromowe przesunięcie pierwszego pasma głównego (pasma K) w widmach związków C6HS—X w zależności od użytego rozpuszczalnika (odniesione do położenia maksimum pasma K w widmie benzenu w tym samym rozpuszczalniku)
Przesunięcie pasma X( + zU, nm)
|
X |
w cykloheksanie |
w eterze dwuetylowym |
w etanolu |
J w wodzie |
|
OH |
8 |
16 |
16 |
7 |
|
nh2 |
32,5 |
36 |
32,5 |
27,5 |
|
Cl |
13 |
10 |
6 | |
|
och3 |
18 |
17 |
16,5 |
14 |
|
N(CH3)2 |
49 |
49,5 |
48 |
40,5 |
|
coch3 |
36 |
37 |
39 |
42 |
|
no2 |
50 |
50 |
57 |
63 |
|
ch=chno2 |
97 |
108 |
116,5 | |
|
Benzen W |
202 |
202 |
203 |
203,5 |
|
log £max |
3,90 |
3,78 |
3,87 |
/e przy przejściu z rozpuszczalnika nieaktywnego do rozpuszczalników prolonodonorowych obserwuje się dla tych związków wyraźnie zaznaczony efekt batochromowy. Energia przejścia elektronowego w rozpuszczalniku aktywnym jest tu mniejsza niż w rozpuszczalniku nieaktywnym (cykloheksanie), np.
©
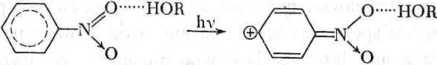
(międzycząsteczkowe wiązanie wodorowe ulega wzmocnieniu we wzbudzonym stanie elektronowym).
Gdy gęstość elektronowa na protonoakceptorowej grupie funkcyjnej /mniejsza się po przejściu do stanu wzbudzonego, obserwuje się przesunię-• ic hypsochromowe pasm K przy przejściu z nieaktywnego do aktywnego i ozpuszczalnika protonodonorowego. Przykładem tego są widma chlo-robenzenu, anizolu i dwumetyloaniliny mierzone w cykloheksanie, etanolu i wodzie (tab. 1). Energia przejścia elektronowego w rozpuszczalnikach aktywnych jest w tym przypadku większa niż w cykloheksanie, np.
I-IOR . HOR
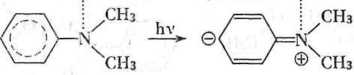
(międzycząsteczkowe wiązanie wodorowe ulega osłabieniu we wzbudzonym .lanie elektronowym).
W przypadku nitrobenzenu międzycząsteczkowe wiązanie wodorowe powiększa elektronoakceptorowe własności grupy nitrowej i stabilizuje polarny stan cząsteczki w stanie wzbudzonym. W przypadku dwumetyloaniliny wiązanie to osłabia sprzężenie wolnej pary z pierścieniem aromatycznym, zmniejsza więc własności auksochromow'e tej grupy i utrudnia stabilizację struktury polarnej w stanie wzbudzonym. W kwasie siarkow'ym pasmo K w widmie nitrobenzenu przesuwa się batochromowo (ź,maN = 287,5 nm), natomiast widmo dwumetyloaniliny przypomina widmo nie-podstawionego benzenu. Przyłączenie protonu zwiększa bowńem jeszcze bardziej antyauksochromowe własności grupy NOa, natomiast całkowicie ■I Wiązanie wodorowe
Wyszukiwarka
Podobne podstrony:
24 (2) 48 • Kurs Dwudniowy 48 • Kurs Dwudniowy UMIEJĘTNOŚĆ Palce < Przesuwają się aż ku
30683 skan0078 150 R. MIERZECKI puszczalnikach — donorach protonu przesuwa się ono o ok. 45 cm-1 ku
24(1) 48 • Kurs Dwudniowy 48 • Kurs Dwudniowy UMIEJĘTNOŚĆ I*AI <1 • Przesuwają się aż ku
I (13) Część 52b. Odginam i przyklejamy z. boku do części 48 i z góry do części 52a. Część 52c, 52d
CJRANJA 9 Wahania te są dosyć znaczne. Widzialny środek tarczy Księżyca przesuwa się względem swego
czesci1 * Zestawienie przesuwki odboctki ł-01-01rys 27 V i
łamanej (rys. 4.12b), a następnie zestawiając rozcięte części z wzajemnym przesunięciem i spawając j
CCF20080702�016 (2) 48 Biona pokrywająca (membrana tectoria) - rozpoczyna się na wewnętrznej powierz
więcej podobnych podstron