58870 str061 (4)

120 Ćwiczenie nr 14
SEM = Ek - Ea, gdzie Ek - potencja) katody E, - potencjał anody
120 Ćwiczenie nr 14
Fc2-»20H'— FelOHlj
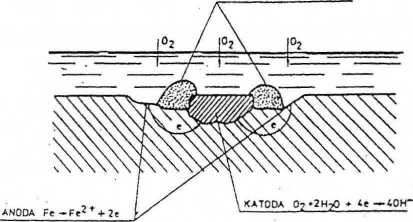
Rys. 1. Utworzenie się ogniwa korozyjnego na skutek niejednorodności metalu.
4. KOROZJA ATMOSFERYCZNA METALI
Korozja metali w atmosferze ma charakter elektrochemiczny. Większość konstrukcji stalowych jest eksploatowana w warunkach atmosferycznych. O agresywności atmosfery decydują następujące czynniki: obecność pary wodnej, możliwość jej skraplania na powierzchni metalu, częstotliwość opadów, stężenie dwutlenku węgla, dwutlenku siarki, związków azotu, obecność cząstek stałych. Za najgroźniejszy spośród tych zanieczyszczeń uważa się dwutlenek siarki. Mechanizm korozji stali w wilgotnej atmosferze polega na redukcji tlenu rozpuszczonego w wodzie (reakcja katodowa) i anodowym rozpuszczaniu się żelaza, które przechodzi w wodorotlenki i tlenki żelaza (rdza) - rys. 2.
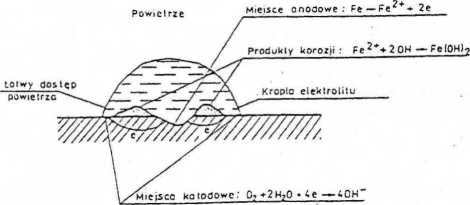
Rys. 2. Korozja atmosferyczna.
5. KOROZJA W GLEBIE
Korozja konstrukcji metalowych w glebie ma charakter elektrochemiczny. Szybkość korozji zależy od: struktury gleby, zawartej w niej wody lub wilgoci, od napowietrzania oraz odczynu gleby (pH). Korozję w glebie przyspieszają niektóre bakterie i mikroorganizmy oraz prądy błądzące. Prądy błądzące pochodzą najczęściej z sieci elektrycznych kolei i tramwajów, a także z uziemień różnych urządzeń elektrycznych.
6. ZAPOBIEGANIE KOROZJI
Zapobiec korozji lub zmniejszyć jej działanie można przez:
a) Dobór odpowiedniego metalu lub stopu w zależności od środowiska, na działanie którego metal będzie narażony;
b) Dobór odpowiedniego kształtu konstrukcji:
- jeżeli to możliwe, stosowanie elementów o profilach i narożnikach zaokrąglonych,
- kątowniki, ceowniki, belki dwuteowe powinny być tak ustawione, aby w zagłębieniach nie gromadziły się ciecze,
- pojemniki i zbiorniki powinny być tak ustawione, aby byt swobodny obieg powietrza oraz, aby nie następowała kondensacja pary wodnej,
- połączenia elementów powinny być tak wykonane, aby zapobiec dostępowi i gromadzeniu się cieczy w zagłębieniach i szczelinach.
c) Stosowanie powłok ochronnych:
- pokrycie metalu innym metalem lub stopem,
- pokrycie warstwą farby lub lakieru,
- pokrycie warstwą smaru lub oleju,
- pokrycie warstwa gumy lub tworzywa sztucznego,
- zmiana warstw powierzchniowych metalu drogą chemiczna, np. utleniania, fosforowa
nia, chromianowania.
d) Stosowanie ochrony elektrochemicznej.
Ochronę elektrochemiczna można stosować, jeżeli chroniona konstrukcja znajduje się w środowisku przewodzącym prąd elektryczny i ma ciągłość przewodzenia prądu.
Ochrona elektrochemiczna katodowa polega na utworzeniu makroogniwa korozyjnego, w którym chroniona przed korozja konstrukcja, aparatura, zbiornik, rurociąg itd. stanowią nierozpuszczalną katodę. Anody ulegające korozji w takim makroogniwie sporządzane są ze specjalnie przygotowanych stopów.
Ochrona elektrochemiczna anodowa polega na podwyższeniu potencjału metalu w danym środowisku (czyli polaryzacji anodowej) aż do zakresu potencjałów, w którym rozpuszczanie metalu jest znikome (pasywacja anodowa).
e) Stosowanie inhibitorów korozji.
Inhibitory korozji są to substancje, które wprowadzone w niewielkich ilościach do środowiska lub na powierzchnię metalu hamują korozję.
Pytania kontrolne
fp. Jaka jest różnica między korozją chemiczną a elektrochemiczna?
2. Schemat reakcji anodowej i reakcje katodowe w ogniwie korozyjnym.
3. Sposoby zapobiegania korozji.
7. CZĘŚĆ DOŚWIADCZALNA
Zadanie 1.
Wpływ utworzonego ogniwa korozyjnego na szybkość elektrochemicznej korozji stali.
Celem ćwiczenia jest określenie wpływu bezpośredniego kontaktu stali z innymi metalami (ogniwa korozyjne) na szybkość korozji stali w 3-procentowym roztworze chlorku sodu. Aby
Wyszukiwarka
Podobne podstrony:
str061 (4) 120 Ćwiczenie nr 14 SEM = Ek - Ea, gdzie Ek - potencja) katody E, - potencjał anody
11263147?8343551199613D41555047340674171 n Ćwiczenia 12-14- Sem. 2 2015 > Kol. 3 SZEREGI (8.06.20
65103 P29 (14) r ZAUMI3 • A.E EK/AKUA-C.3A A JA SPKOftU-1Z OPZYAKAĆ CS^-iZ TAL Aa ARA. P-O-AONR
P29 (14) r ZAUMI3 • A.E EK/AKUA-C.3A A JA SPKOftU-1Z OPZYAKAĆ CS^-iZ TAL Aa ARA. P-O-AONR5 spt
65103 P29 (14) r ZAUMI3 • A.E EK/AKUA-C.3A A JA SPKOftU-1Z OPZYAKAĆ CS^-iZ TAL Aa ARA. P-O-AONR
IMG?14 POSTAWY I ICN ZMIANA 8 1 gdzie P oznacza postawę wobec obiektu x; p. oznacza i-te przekonanie
Jeśli w ciągu ostatnich 14 dni byłeś w miejscu gdzie występujeKORONAWIRUS lub miałeś kontakt z osoba
Jeśli w ciągu ostatnich 14 dni byłeś w miejscu gdzie występujeKORONAWIRUS i zaobserwowałeś u siebie
Jeśli w ciągu ostatnich 14 dni byłeś w miejscu gdzie występujeKORONAWIRUS i zaobserwowałeś u siebie
Jeśli w ciągu ostatnich 14 dni byłeś w miejscu gdzie występujeKORONAWIRUS i zaobserwowałeś u siebie
Jeśli w ciągu ostatnich 14 dni byieś w miejscu gdzie występujeKORONAWIRUS i zaobserwowałeś u siebie
Jeśli w ciągu ostatnich 14 dni byłeś w miejscu gdzie występujeKORONAWIRUS i zaobserwowałeś u siebie
72523 Pick 20of 20The 20Litter 2027 Row 12: decfirst$t.scinnext4stsdeciastst.(6 sc
Jeśli w ciągu ostatnich 14 dni byłeś w miejscu gdzie występujeKORONAWIRUS i zaobserwowałeś u siebie
klszesz068 807 ROZDZIAŁ 14. PLASTYKA dolnego Sanu, gdzie ten ścieg stosuje się do niezmiernie charak
14. Skómicka, D. „Badania nad enzymatyczną aktywacją potencjalnych środków
182. METODA SYMPLEKSOWA Twierdzenie 2.14. Niech X = {x G Rn; Ar — b,x > 0}, gdzie A G Mmxn(R), b
182. METODA SYMPLEKSOWA Twierdzenie 2.14. Niech X = {x G Rn; Ar — b,x > 0}, gdzie A G Mmxn(R), b
więcej podobnych podstron