72933 Litowce (4)
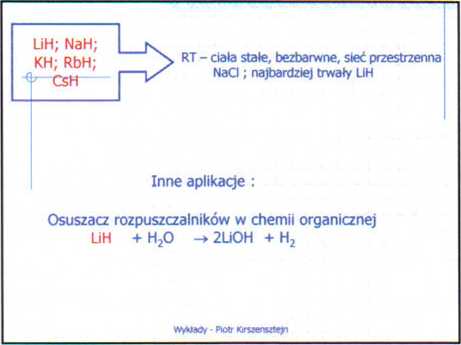
Halogenki - LiX
• bezbarwne krystaliczne - struktura NaCI
.a*koordynacja 6,6 ale dla CsCI; CsBr i Csl 8,8
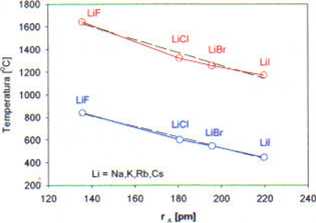
• temperatura topnienia i wrzenia zmieniają Sie systematycznie ze wzrostem promienia anionu
• w fazie gazowej pojedyncze cząstki ale i agregaty (MX)n n= 2,3 i 4
Standardowe entalpie tworzenia halogenków litowców w 298 K

Wszystkie halogenki są rozpuszczalne w HjO za wyjątkiem LIF, który Jest słabo rozpuszczalny.
Entalpia hydratacji < od E
E ueooMi (Kapustinskii)
-89110 moł-‘ - NaF -767 kJ md*1 - NaCI
(reguła przekątnej -„nie periodyczność"
MgF2 też trudno rozpuszczalny)
Zależność temperatury topnienia i wrzenia od promienia anionu
Wykłady - Piotr lOrsenKtejn
LiF (c.d.)
• rozpuszcza sią w nadmiarze HF
U + HF -*UHF2 (wodorofluorek litu)
• stosowany Jako topnik w procesie spawania i lutowania metali lekkich
•If^___
LiCI
• bezwodny > 98°C > 1,2 i 3 hydrat
• silna sołwatacja Jonów U* dobrze rozpuszczalny w rozpuszczalnikach organicznych zawierających tlen np. etanol
• środek suszący w klimatyzatorach
• w pirotechnice
LiBr i Lii
• środki suszące,
• adsorbenty amoniaku, lub zawierających chlor związków organicznych
• Jako lek w niektórych chorobach nerwowych
• scyntylator do wykrywania neutronów
• silnie higroskopijne -- środki suszące np. klimatyzacja
Wykłady - Piotr ttrszensztejn
Tlenki i związki pokrewne_
Punctum quaestioms
Jedynie Li tworzy prosty tlenek w bezpośredniej reakcji z tlenem; Na -tworzy nadtlenek a cięższe pierwiastki tworzą ponadtlenki
2U 4 Vi 02 -► LJ20 • kryształy w sieci antyfluorytu
• reakcja z wodą - powolna - UOH
• zastosowanie w przemyśle krzemianowym Jako topnik
LiOH UA r UjCOjL LiNO,
ciepło LijO
Csn03
Wykłady - Pv» Kirsjensztejn
2 U + 02 ""'t- • LijOj
PA
2 UOH + 3HjOj - Uj0j-Hj0j-3H,0-- UjOj
Li02 - ponadtlenek litu
Li;0, (suspensjs w Freonie-12)+ 03 » U02
• w temp. - 30°C ulega rozkładowi do U;02 i 02 Przewidywania stabilności tlenków i nadtlenków - Kapustinskii:
Na20 NajOj RbjO RbjOj 1978 1782 1680 1536 U moł1
WyWaa. • Pwo rraensaejn
Wykłady - Piotr Kirszensztejn
5
Wyszukiwarka
Podobne podstrony:
Litowce (6) Halogenki NaX -t >- Otrzymywanie :NaOH /(Na2C03) + HX wszystkie krystalizują w układz
Krystalizacja I struktura żeliwa. Krystalizacja żeliwa podlega ogólnym prawom krystalizacji metali,
W temperaturze pokojowej czysty fenol jest bezbarwnym krystalicznym ciałem stałym (pod wpływem powie
16835 Zdjęcie0873 Rozpuszczanie ta jony Rozpad siatki krystalicznej■I I 1 Energia siatki krystaliczn
Czym zajmuje się krystalochemia oparta na krystalografii strukturalnej ?Zależnością między składem
Slajd41 (7) Nanocząsteczki lipidowe SLN - prawie idealna struktura krystaliczna, struktura muru z ce
CHEMIA POLIMERÓW I MATERIAŁÓW POLIMEROWYCH Procesy krystalizacji, struktura nadcząsteczkowa
64 2 3 STRUKTURA KRYSTALICZNA - KRYSTALOGRAFIA 3.8. Struktury krystaliczne materiałów ceramicznyc li
DSCF4040 Rozpuszczanie Rozpad siatki krystalicznej na cząsteczki Energia siatki krystalicznej (Struk
78800 Peroskwity02 agh Perowsklty: struktura krystaliczna Struktury krystoUczną związku ABO, można o
n f**81” ^ Czynny łUllttufyTEST WlFDZY 7. KRYSTALOGRAFII STRUKt — .
Układy CPLD na przykładzie rodziny 9500 (XILINX) Podobna struktura do SPLD, ale komórki logiczne dod
IMGE19 182 Jacek Szmatka Procesy i reguły działania struktur socjomeirycznych 183 charakterystyczne
Laboratoria Ekran ze strukturą rozpraszającą dźwięk pomiarowego dla automatyzacji pomiarów źródeł
więcej podobnych podstron