CCF20081011�018

tlen atmosferyczny. Opisane reakcje są przyczyną ciemnienia niektórych tkanek roślinnych pojawiającego się w odpowiedzi na kontakt z tlenem powietrza.
Wykonanie:
Umyty i obrany ziemniak utrzeć na tarce. Miazgę włożyć do woreczka płóciennego i zanurzyć w zlewce z około 200 cmJ wody. Zawartość zlewki łagodnie wymieszać. Uzyskuje się w ten sposób wodny ekstrakt zawierający enzymy i skrobię. Otrzymany roztwór zdekantować i przesączyć.
•>
Do 6 probówek wlać po 5 cm wyciągu ziemniaczanego. Do dwóch dodać 10 kropli 1% roztworu fenolu, do dalszych dwóch 10 kropli 1% roztworu pirokatechiny, a do pozostałych po 10 kropli 1% roztworu pirogallolu. Zawartość probówek wymieszać. Następnie do jednej probówki z każdej pary dodać 10 kropli 3% roztworu H2O2, wymieszać i obserwować zmianę zabarwienia. W probówkach zawierających obok związków fenolowych H2O2 zmiana zabarwienia następuje o wiele szybciej bowiem równocześnie działają oksydazy i peroksydazy.
Podobną reakcję obserwuje się nawet bez powyższych odczynników, np. na obranym ziemniaku, który po pewnym czasie sinieje, ponieważ zawarte w nim związki typu o-dwufenoli ulegają utlenieniu. Z tego samego powodu obrane ze skórki jabłko brązowieje.
2) Wrażliwość oksydaz i peroksydaz na temperaturą Wykonanie:
Do 3 probówek odmierzyć po 3 cnT wyciągu ziemniaczanego. Dwie probówki ogrzewać na łaźni wodnej w temperaturze 75°C przez 20 minut. Następnie ostudzić i dodać do pierwszej probówki 10 kropli pirokatechiny (powinny działać oksydazy), do drugiej 10 kropli 1% roztworu pirokatechiny i 3% roztworu H2O2 (powinny działać oksydazy i peroksydazy). Trzecia probówkę z zawartością zagotować i dodać 10 kropli 1% roztworu pirokatechiny i 10 kropli 3% roztworu H2O2.
Wynik doświadczenia wskaże, że peroksydazy nie zostały zniszczone przez ogrzewanie w temperaturze 75°C. Natomiast oksydazy utraciły aktywność. Peroksydazy inaktywują się dopiero po ogrzaniu we wrzącej łaźni wodnej.
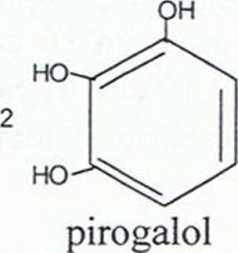
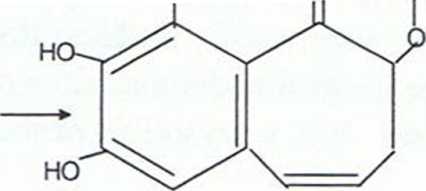
+ 5 Hp + 0O2
purpurogalina
(pomarańczowa)
oh o-----h
+ 3HP2 3) Wykrywanie katalazy
Katalaza (E.C. 1.11.1.6) jest powszechnie występującym w różnych tkankach enzymem hemoproteinowym o ciężarze cząsteczkowym 240 000 Da, optimum pH 6-7, temperatury ok. 50
°C. Inhibitory katalazy są charakterystyczne dla większości metaloenzymów. Są nimi cyjanki, fluorki, siarczki, azydki, kwasy i zasady, a także substrat czyli H2O2 (!).
Wykonanie:
Do dwóch probówek wlać po 2 cm" wyciągu ziemniaczanego, do dwóch następnych po 2 cnT świeżego mleka. Jedną probówkę z sokiem ziemniaczanym i jedną z mlekiem ogrzać do wrzenia i ostudzić. Do pozostałych probówek dodać po 2 cnT 3% H2O2. Zaobserwować zmiany w poszczególnych probówkach.
Wyszukiwarka
Podobne podstrony:
CCF20081011�018 (2) tlen atmosferyczny. Opisane reakcje są przyczyną ciemnienia niektórych tkanek ro
CCF20081215�020 376Józef Kozielecki Jakie są przyczyny powstawania pętli? Dość często ludzie powraca
Jakie są przyczyny niedostatecznej liczby wdrożeń procesów chemicznych w Polsce?• niedojrzałość
img006 (6) J .(25 .Podać nazwy łacińskie, polskie i symbole chmur dających opady atmosferyczne. J 33
IMG?42 Przebieg oględzin: I Warunki atmosferyczna I okoliczności w jakich są prowadzono oględziny, m
Wstyd i przemo0116 230 Wstyd i przcm>4Czy narkotyki i alkohol są przyczyną przemocy? Wciąż na now
DSC00069 (38) Przebieg oględzin: 1. Warunki atmosferyczne i okoliczności w jakich są prowadzone oglę
PIC050 1$ 1$ wykonanych z umacnianych laUie są przyczyny utraty wy trzy małości konslrukcji spawanyc
Elastyczność cenowa popytu ♦ Służy do opisania reakcji klientów na zmianę
s0075 Teoria Sygnałów - kolokwium nr 2 1. Obliczyć energię sygnału opisanego wzore
45201 P1050804 Samotna gra w kręg^ się podjąć studia prawnicze, są przyczyny, dla których w Stanach
DSCF4474 • Produkty, które najczęściej sa przyczyna zatruć pokarmowych: 1. Potrawy
więcej podobnych podstron