367

36
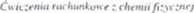
3.6. Korzystajsic z zasady ckwipartycji energii oszacować wartości Cp wszystkich substancji biorących udział w reakcji:
CMI*,* H;0,r, s CHĄ, (tlenek etylenu)
Rozwiązanie
Korzystam) z zależności: Cp= R + C.\ i uwzględniamy, że ciepło molowe Cv gazu. którego cząsteczki są n-atomowe składa się z następujących udziałów:
— irunslacyjncgo: - R
2
— rotacyjnego: ■- R (cząsteczki liniowe)
^ R (cząsteczki nieliniowe)
— oscylacyjnego: (3n - 5) R (cząsteczki liniowe)
(3n - 6) R (cząsteczki nieliniowe).
W przybliżeniu można pr/.yjąć, że w temp. 25° |C|:
^ lltunylmp) + v hji) + ^ (fu
C2H2(linioxva):
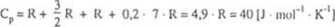
H20 (nieliniowa):
Cp = R + |r + |r + 0,2-3R = 4,6R = 38 [J • mol'1 • K''l
C2H40 (nieliniowa)
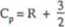
R + | R + 0.2 • 15 • R = 7 R = 58 [J • mol'1 • KT1].
3.7. Oszacować wartości Cpdla każdej z substancji biorących udział w następującej reakcji.
cw + 2II.O,t, = CO;(1)ł2H„|
Obliczyć ACp tej reakcji.
R = 8,314 [J • mol ' K '|
Rozwiązanie
Zgodnie z regułą Dulonga i Petila i zasadą ckwipartycji energii Chciała stałego równe jest24,9 |J • mol1 K *| czyli:
-dlaC(5>:
C, « 25 |J muf1 K"'|
— dla pary wodnej H20(r):
Cf = R + | R,„, + ~ + 02 3 R(„., = 4.6 R = 38.2 |J • mol"' ■ K"'|
dla Cl),,,,:
CP = R + \ + 0.2 R(wc )1= 3.7 R = 30,7 [J • mor' • K"1).
Zatem dla powyższej reakcji ACp = - 4,3 [J/K]. /
3.8. Standardowe ciepła tworzenia toluenu, dwutlenku węgla i wody w temperaturze 298 [K) wynoszą odpowiednio: +48,0; -393,5; -286,0 IkJ/moll. Obliczyć ciepło wydzielone w wyniku całkowitego spalenia 10 g ciekłego toluenu w temperaturze 298 [K] pod stałym ciśnieniem 1 [atm].
Wyszukiwarka
Podobne podstrony:
Mechanika ogolna0064 128 Wszelkie opory ruchu pomijamy. Korzystamy z zasady zachowania energii mecha
Mechanika ogólna0064 128 Wszelkie opory ruchu pomijamy. Korzystamy z zasady zachowania energii mecha
Mechanika ogólna0064 128 Wszelkie opory ruchu pomijamy. Korzystamy z zasady zachowania energii mecha
mech2 145 288 JRoz wiązanie Korzystamy z zasady zachowania energii E + U = const. W położeniu począt
mech2 145 288 JRoz wiązanie Korzystamy z zasady zachowania energii E + U = const. W położeniu począt
str 63 (2) Energia, jej przemiany i transport e) (0-2). Nie dokonując obliczeń ustal, korzystając z
skrypt wzory i prawa z objasnieniami58 114 Zasady zachowania energii i pędu ■ Musimy pamiętać, że w
teoria2 2 i S -w 5) Korzystając z zasady superpozycji wyznaczyć moc źródła napięcia Ejmając dane Ej
OMiUP t2 Gorski!3 ■p max(6.22) s max i przyjmuje wartości -1 ^ Cp (cs) < + 1. W układzie o regula
Indukcja zupełna Korzystając z zasady indukcji matematycznej, wykazać, ze dla każdego n^N : 1) 1+3+5
Slajd65 Z zasady równoważności energii kinetycznej i
egzam3 / - STATYSTYKA - 22. W celu oszacowania wartości oczekiwanej dla szeregu ro
III.Kryteria i zasady oceny działalności organizacyjnejTabela wartościowania osiągnięć,
12 Krystyna Joanna Świdzińska na rynkach9. Niezwykle korzystne dla produkcji energii z odnawialnych
więcej podobnych podstron