50 (168)


oznacza tzw. stałą Rydberga obliczoną przy założeniu, że masa jądra jest nieskończenie wielka, czyli że jądro atomowe jest nieruchome.
Uwzględniając skończoną masę M jądra atomowego można wyprowadzić następujący wzór na stałą Rydberga, której wartość powinna wchodzić do równania (22.4)
R
1
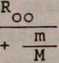
Z równania (22.4) wynika, że wszystkie linie widmowe (częstotliwości) promieniowania emitowanego lub absorbowanego przez dany atom można połączyć w tzw. serie widmowe. Serią widmową nazywamy zbiór linii widmowych opisanych wzorem (22.4) przy ustalonej wartości n^, tj. powstałych podczas przejścia elektronu z wyżej położonych orbit opisanych liczbą kwantową n^= (n^+1), (n^+2), ... na orbitę n ^. Widmo emisyjne
atomu wodoru składa się z serii widmowych obdarzonych tradycyjnymi nazwami:
|
- serii |
Lymana |
( |
ni=ł - |
n =2. |
3 / |
4 / . • . |
), |
|
- serii |
Balmera |
( |
ni=2 . |
V3' V4' v5' nr6' |
4, |
5____ |
), |
|
- serii |
Paschena |
( |
5, |
6____ |
), | ||
|
- serii |
Bracketta |
( |
V - |
6, |
7---- |
), | |
|
- serii |
Pfunda |
( |
7, |
8____ |
) • |
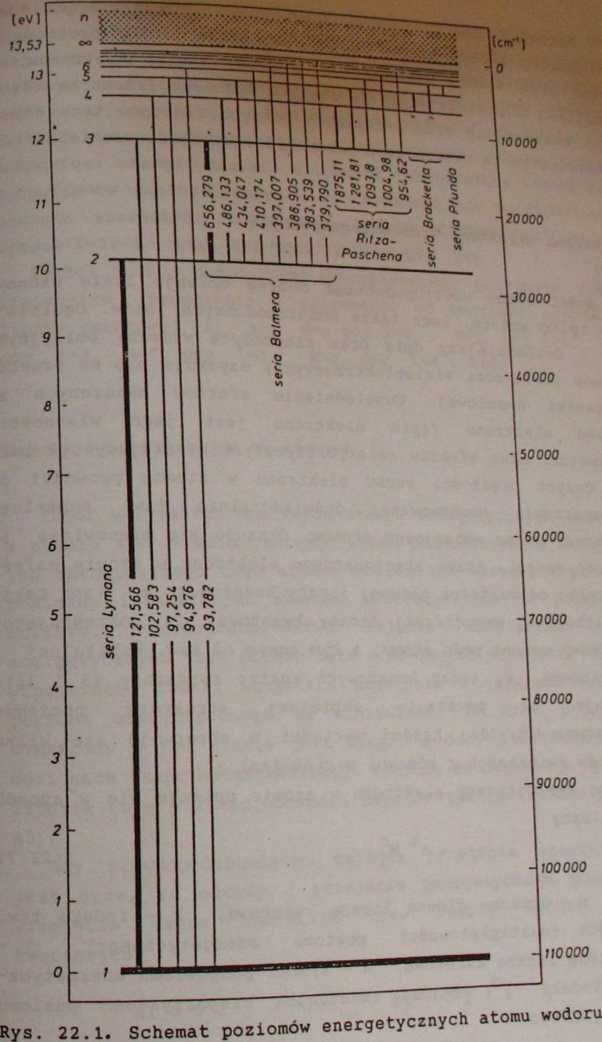
Rysunek 22.1 przedstawia schemat poziomów energetycznych oraz możliwych przejść elektronowych dla atomu wodoru. Szczególnie dogodna do badań jest seria Balmera (n.=2) dla atomu wodoru, ponieważ jej trzy najbardziej intensywne linie: Ha (1^=3), Hg (n.=4) oraz Hy (n^S) leżą w obszarze
widzialnym widma fal elektromagnetycznych.

Wyszukiwarka
Podobne podstrony:
skanowanie0002 R oo 4 e m(22.!.) oznacza tzw. stałą Rydberga obliczoną przy założeniu, że ma#g jądra
ABSTRAKT NORMY Podano uproszczoną metodą obliczań przy założeniach, że wiat/ wieje poziomo z dowolna
P1000023 Belki oblicza się przy założeniu, że ścianka z sklejki z uwagi na swój kształt nie przejmuj
instalacje132 5. UWAGI O OBLICZANIU SILNIKÓW SKOKOWYCH 146 Niektóre obliczenia przeprowadzono przy z
4. Oblicz koszt kapitału własnego metodą wzrostu dywidendy przy założeniu, ze cena rynkowa akcj
76238 skanuj0001 (112) 7. OBLICZANIE OSIADAŃ FUNDAMENTÓW Osiadania fundamentów oblicza się przy zało
DSC00307 2 Stała Michaelisa - Km Przy stężeniu substratu w którym osiągana jest potowa maksymalnej s
średniego. Najczęściej używane wielkości Pr, obliczone przy założeniu rozkładu normalnego błędów,
jpg 1 OBLICZENIA WYBRANYCH PARAMETRÓW PROCESU TŁOCZENIA 1. Obliczenia geometrii wsadu. Przy założeni
DSC01856 (2) przy założeniu, że oś biegunowa pokrywa się z nieujemną półosią Ox (rys. 2.2) ZADANIA 1
Image318 Funkcje arytmetyczne i logiczne realizowane przez układ 181 przy założeniu, ie sygnałem akt
img0602sm 25 Zagadnienie rozruchu silnika można również rozwiązać przy założeniu, że charakterystyka
więcej podobnych podstron