Berylowce (4)
MtfCWOfófWfeff
• petrywa się warstwą tlenkowa w wilgotnym powietrzu
• sproszkowany przy podgrzewaniu zapala się
• pomimo st. poten. = -1,7 V nie reaguje z H20
• łatwo reaguje z kwasami H, - (pasywacja w przypadku HN03)
HF > H2SO, ~ HO > HNOj
szybko roztwarza się w 3M H2S04 i 5 M NH4F
• z alkaliami tworzy się amfbteryczny wodorotlenek rozpuszczalny w nadmiarze
ługu (analogia do glinu)
Be(OH); + 2NaOH -* Na2[Be(OH)4] - (hydroksoberylany)
Wykłady • Piotr Kirtzensztejn
Mg bardziej reaktywny niż Be
• szybko pokrywa się warstwą tlenkową lub wodorotlenkową
• *ł*wyjcrwletrzirzapala się w temp. 1030 K - reakcja bardzo egzotermiczna
(AH = -1220 kj/mol) obok tlenku tworzy się azotek Mg3N2 , zapaloną wstążka - w atm. pary wodnej rozkłada wodę 4 H,
• ; z wodą reaguje powoli w temp. powyżej 340 K 4 Mg(OH)2 + H2
• bardzo łatwi reaguje z kwasami (poza HF 4 trudno rozpuszczalny MgF2)
• | odporny na działanie roztworów zasadowych
• i z alkoholami tworzy alkoholany Mg + 2CH3OH -> Mg(OCH3)3 + H2
• silny reduktor Si02 + 2Mg -»2MgO + SI
Ca, Ba Sr
wszystkie mają barwę srebrzystobialą, reagują z tlenem już w temp. pokojowej (przechowywanie pod naftą); na powietrzu :
• Ca-pokrywa się warstwą tlenku, matowieje
• Ba - pokrywa się warstwą tlenku który z czasem czernieje
• Sr - pokrywa się nalotem o barwie żóttobrunatnej
Wykłady - Piotr Kirszensrtejn
T

typ MH2
• twardość maleje ze wzrostem l.at. Ca -1,5
struktura krystalograficzna
• Ca - 3 odmiany alotropowe
> do 300°C - o Ca - regularna płasko centrowana ^powyżej fi Ca o niższej symetrii
^powyżej 450°C y-Ca - heksagonalny •j zHjO
> Ca rozkłada wodę niezbyt szybko
^Ba i Sr reagują z wodą prawie tak gwałtownie jak sód
• z kwasami bardzo łałwo
• bardzo odporne na działanie zasad
Wykłady - Piotr Kretensztejn
' BeH2 (typ kowalencyjny)
BeCI; + 2UH ., BeHj + 2lid w eter2e 2Be(CH3)2 + LiAIH, > 2BeH2 + UAI(CH3)4
• substancja bezbarwna, trudno lotna, dekompozycja na pierwiastki w 570 K reaguje z wodą
• w sieci przestrzennej - polimeryczne łańcuchy - wiązanie trójc en trowe Be-H-Be - analogia do wiązania w borowodorach
^BeVB*'H'e'vBcO &
MgH, (typ kowalencyjny)
• bezpośrednia synteza z pierwiastków pod zwiększonym ciśnieniem H2
• ulega dekompozycji w podwyższonej temp. zast. w silnikach napędzanych
wodorem WyWadY- Piotr nrswroaejn
CaH„BaH bezpośredni
BaH2 i SrHj (typ Jonowy)
1 *iia synteza z pierwiastków
Ca + H2 > CaH2
(670 K)
. reagują gwałtownie z wodą
CaH2 4 2H20 -»Ca(OH)2 4 2H,
Wykłady - Piotr łGruensztejn
Wykłady - Piotr Kirszensztejn
Halogenki
typ yx2
r Be- mały atom •♦wysoka energia jonizacji •¥ energia sieciowa lub energia hydratacji nie są wystarczające do pełnego oderwania elektronów -4 nie mogą więc powstać proste jony Be*2
2s2 -4 2s‘2p'-4 2 orbitale atomowe sp X - Be - X np. 8eCI2 Mc. = 2 dąży do osiągnięcia maksymalnej l.k. = 4
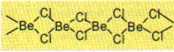
Fluorki Mg(II), Ca(II), Sr(II) i Ba(II) są jonowe charakteryzują się wysoką temperaturą tofmłenia, i są słabo rozpuszczalne w H20 a ich rozpuszczalność nieznacznie rośnie ze wzrostem wielkości kationu (Iloczyn rozpuszczalności dla MgF2, CaF2, SrF2 i BaF2 wynosi odpowiednio: 7,42 V 10 u, 1,46 • 10 J0, 4,33 % 104, ir84 * ia7 )
Wykłady - Piotr Kłrezensztejn
5
Wyszukiwarka
Podobne podstrony:
Żelazo nie reaguje z powietrzem w temperaturze pokojowej, natomiast po ogrzaniu pokrywa się warstwą
Żelazo nie reaguje z powietrzem w temperaturze pokojowej, natomiast po ogrzaniu pokrywa się warstwą
Żelazo nie reaguje z powietrzem w temperaturze pokojowej, natomiast po ogrzaniu pokrywa się warstwą
Żelazo nie reaguje z powietrzem w temperaturze pokojowej, natomiast po ogrzaniu pokrywa się warstwą
Żelazo nie reaguje z powietrzem w temperaturze pokojowej, natomiast po ogrzaniu pokrywa się warstwą
Żelazo nie reaguje z powietrzem w temperaturze pokojowej, natomiast po ogrzaniu pokrywa się warstwą
Wilgotność powietrza, para wodna • Para wodna najobficiej skupia się w dolnej wars
skanuj0003 Surowice - zadania Oblicz wymiary drzwi gdy wilgotność powietrza (względna) będzie utrzym
Mgły napływowe tworzą się gdy ciepłe i wilgotne masy powietrza napływają nad chłodniejsze podłoże. M
CCF20081202�047 się w czasie fermentacji dwutlenek węgla tworzy nad moszc/oiii warstwę izolującą dos
280 1 Dla ilustracji przestrzennego zróżnicowania niedosytu wilgotności powietrza posłużono się dany
7 ze powietrze znajdujące się w warstwach ziemi, pozostaje pod większem ciśnieniem, przeto para wodn
Img00132 136 Materiały nadprzewodzące wykonuje się z nich przez naniesienie cienkich warstw tlenków
Powstawanie fatamorgany ■ Miraż powstaje wtedy, gdy promienie świetlne załamują się w warstwie powie
więcej podobnych podstron