Borowce (7)
[ Na[BH„]
• jest białym nielotnym ciałem krystalicznym z typową dla soli jonowych strukturą NaCI;
• stabilny w suchym powietrzu ale i rozpuszczalny w H20 -stabilność raczej kinetyczna niż termodynamiczna
• chociaż nie rozpuszczalny w Et20 to rozpuszczalny w THF i polieterach
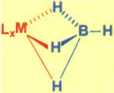
• pomimo tego że ma właściwości typowo jonowe to niektóre jego pochodne z innymi metalami są kowalencyjne -obecność oddziaływań 3c-2e w M-H-B
> [Al (BH4)3] w którym jon [BH4] zachowuje się jak ligand dwu-kłeszczowy
^ trans [V(BH4)2(Me2PCH2CH2PMe2)2] każdy ligand [BH4] jest jedno-kleszczowy tworząc wiązanie B-H-V
^■[Zr(BH4)4] centrum 12 -koordynowanego Zr(IV) jest otoczone trój-kleszczowymi ligandami
Wykłady - Ptotr KirHensżteyi
L,M-
I SH
(V(BH4)2(Me2PCH2CH2PMe)2]
I
w szeregu NaBH.,->Be(BH4)2 4 AI(BH4)3 wzrasta lotność (ten ostatni jest cieczą o temp. wrzenia 317,7K - kowalencyjny charakter wiązań pomiędzy metalem a grupą BH4)
WyWady - Piotr Kirsrensaejn
-Qr
w przypadku I grupy układu okresowego np. dla NaB2H7 czy NaB3H8 mamy do czynienia z jonami hydrodi czy hydrotriboranowymi :

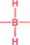
H
H
Karbaborany można formalnie wyprowadzić z wzorów hydroboranowych przez wymianę:
(B-H)-na izoelektronową z nią obojętną grupę C-H otrzymywanie:
- działając na boran sulfidem dialkilowym
B10H14 + 2(C2H5)2S -» B10H12 X 2S(C2Hs)2 + H2 B10Hi2 x 2S(C2H5)2 + C2H2 ■* B10C2H12 + S(C2H5)2 + H2
Wykłady • Piotr Klrwensztejn
• mieszanina HF i 8F3 Jest bardzo silnym donorem protonu, chociaż rlie tak silnym jak układ HF i SbFs.
• sole zawierające Jon [BF4]- są często spotykane w syntezie chemicznej
• Jon [BF4]- (podobnie jak [PFJ- ) o ile koordynuje to bardzo słabo <lo ćfentrum metalicznego i jest często używany jako „nieszkodliwy" anion dla wytrącenia kationu.
BFj tworzy szerokie spektrum kompleksów z eterami, nitrylami I aminami. Jest komercyjnie dostępny jako Et20 • BF3. Będąc cieczą w temperaturze 298K jest wygodny w stosowaniu co ma wiele zastosowań jako katalizator w chemii organicznej, np. w reakcjach alkilacji i acylowania Friedel-Crafts'a.
Reakcje pomiędzy B a Cl2 czy Br2 prowadzą do uzyskania BCI3 czy BBr3 otrzymywanie zaś analogicznego jodku wymaga reakcji:
BC13 + 2HI -A— BI, + 3HCI
3Na[BHJ + 81; -► 3NaI +3BI3 + 4H2 + 4HI
WyWMy ■ Piotr Koianutejn
|
BF3; BC13 |
gazy |
|
BBr, |
ciecz |
|
BI3 |
ciało stałe |
Otrzymywanie:
B2Oj + 6HF -P 2BF3 + 3H;0 BjOj + 3C + 3CI2 -» 2BCI3 + 3CO
B203 + 3CaF2 + 3H2S04 "t 2 BF3 + 3CaS04 + 3H20 (nadmiar kwasu wiąże wodę)
BF3 - mocno dymi w wilgotnym powietrzu i jest częściowo zhydrolizowany przy nadmiarze H20 :
4BF3+6H20 ■* 3[H30]* + 3[BF4]-+ B(OH)3
Czysty kwas tetrafluoroborowy HBF4 w formie wyizolowanej nie istnieje, Jest dostępny w roztworze Et20 lub jako roztwór [H30][BF4]. 4H20
p HBF4 (silny kwas - analogia do HCIO.)
Wykłady ■ Piotr Kasrenawyi
Wszystkie trójhalogenki rozkładają się w H20
BX3 + 3H20 -- B(OH)3 + 3HX
Ofózreagują z nieorganicznymi i organicznymi związkami zawierającymi labilny proton mogący ulegać eliminacji HX (X=CI, Br, I)
• Pódczas gdy BF3 tworzy addukt z NH3 to
• BCI3 reaguje z ciekłym NH3 tworząc B(NH2)3. Addukt Ba3 z amoniakiem H3N • BCI3 można otrzymać z niewielką wydajnością w reakcji BCI3 z NH„CI (głównym produktem jest (CIBNH)3
<«*..IVI
BCI3 + 3NH4CI -- (CIBNHjj -- (HBNH)3
Termodynamika tworzenia adduktów z BF3, BCI3 i BBr3 szeroko badana, a reakcja z NMe3 (zasadą Lewisa L) w fazie gazowej pokazała, że trwałość adduktów zmienia się w następującym szeregu:
L • BF3 < L • BCI3 < L • BBr3
WyWatły - Piotr łOmertsztejn
8
Wyszukiwarka
Podobne podstrony:
3. Właściwości fizykochemiczne Kopolimer diwinylobenzenu i styrenu jest białym lub bezbarwnym ciałem
FizykaII095�01 90 mośrodkowem utwierdzeniu tafelki, na którćj miejsce przytrzymania kleszczami, ozna
fotografowanie architektury5 poU istnieje tendencja do umieszczania elementów obrazu na ncj. Jest to
groszek1 Groszek pachnący Lathyrus odoratus L.Opis rośliny Dziko rośnie w południowych Włoszech i na
Image087 tpHL — czas propagacji do stanu 0 na wyjściu; jest to czas mierzony od chwili osiągnięcia p
Image132 Zmiana stanu przerzutników następuje przy zmianie sygnału taktującego z 0 na 1. Rejestr jes
5) gdy aktywność studenta na zajęciach jest warunkiem koniecznym weryfikacji zdoby
5) gdy aktywność studenta na zajęciach jest warunkiem koniecznym weryfikacji zdoby
więcej podobnych podstron