CCF20110129�009

|
Chromo tor |
/wiązek |
Przejście elektronowe |
km,,, |nm] |
r* mii ii |tlm' mol 1 - cm 11 |
|
X |
etylen |
n -> n* |
ISO |
15000 |
|
>=C |
aceton |
TT —► TT* |
185 |
950 |
|
n —>■ n* |
277 |
20 | ||
|
-o |
benzen |
Jl -*■ n* |
200 |
8000 |
|
255 |
220 | |||
|
—N=N— |
azometan |
n —y ji* |
347 |
1 |
m.in. różnorodność barw jonów kompleksowych metali przejściowych, tłumaczy teoria pola ligandów.
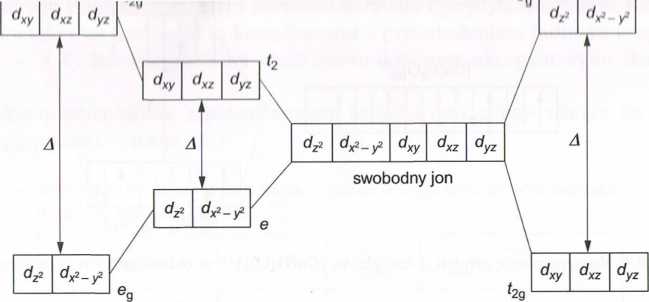
Podpowłoka d w atomie lub w jonie (w fazie gazowej) jest pięciokrotnie zdegene rowana, tzn. istnieje 5 orbitali d o jednakowej energii. Elektron może przejść z jednego z tych orbitali na drugi bez absorpcji lub emisji promieniowania. Orbitale te w układzie współrzędnych oznacza się jako d7i, dx2_yi, dxy, dxz, dyz. Gdy w wyniku oddziaływania kationu metalu ('/-elektronowego z ligandem (cząsteczka H20 lub inny ligand) powstanie związek kompleksowy, wówczas zdegenerowane orbitale d rozszczepiają się na grupy o różnych wartościach energii, a przejścia elektronowe pomiędzy poszczególnymi gru parni orbitali odbywają się w wyniku absorpcji lub emisji promieniowania. Rozszczc pienie orbitali jest uzależnione od typu symetrii powstającego kompleksu.
W przypadku kompleksów o symetrii oktaedrycznej 5 orbitali d ulega rozszczepieniu na dwie grupy oznaczone symbolami e„ i t2g. Orbitale dzi i dxi_yi są zorientowane w kierunku ligandów i tworzą poziom e„ o wyższej energii. Natomiast orbitale dxy, dxz i dyz są skierowane między ligandami i tworzą poziom t2« o energii niższej. W kompleksach o geometrii tetraedrycznej także następuje rozszczepienie orbitali na dwie grupy, z tym, że poziom oznaczony jako t2 (orbitale dxy, dxz i dyz) ma energię wyższą od poziomu e (orbitale dz2,dx2_y2). Różnica energii między poziomami t2 i e jest mniejsza niż w przypadku kompleksów o symetrii oktaedrycznej (stanowi 4/9 różnicy energii między poziomami e„ i t2g). Rozszczepienie analogiczne do przypadku kompleksów te-traedrycznych występuje w kompleksach o symetrii regularnej. Różnica energii między poziomami t2g i eg jest w tym przypadku dwukrotnie większa.
Rozszczepienie pięciu orbitali d na grupy o różnej energii dla kompleksów o symetrii oktaedrycznej, tetraedrycznej i regularnej przedstawiono na rys. 6.3.
Różnicę energii między rozszczepionymi poziomami oznacza się symbolem A i jest ona miarą siły pola ligandów. Można ją wyznaczyć z energii pierwszego pasma absorpcyjnego w widmie kompleksów metali przejściowych. Dla danego ligandu wartość A wzrasta ze wzrostem ładunku kationu. Dla różnych ligandów wartość A jest tym większa, im lepszym donorem elektronów jest ligand. Wartość A dla różnych kationów metali wzrasta w szeregu:
Mn2+ < Ni2+ < Co2+, Fe2+ < V2+ < Fe3+ < Cr3+
< V3+ < Co3+ < Mn'" - Pd4+ < Pt4+
c b a
Nys. 6.3. Rozszczepienie orbitali d kompleksów w polu o symetrii oktaedrycznej (a), tetraedrycznej (b)
I regularnej (c)
Dla typowych ligandów charakterystyczny jest tzw. szereg spektrochemiczny. Dla danego kationu wartość A wzrasta w następującym szeregu:
I < Br' < SCN~ < F“ < OH" < CH3COCT < C202-
< h2o < C5H5N < NH3 <c etylenodiamina <c o-fenantrolina < CN~
W związkach kompleksowych kationów metali przejściowych w wyniku rozszczepienia orbitali d istnieje możliwość przejścia elektronu z poziomu o energii niższej na poziom o energii wyższej podczas pochłaniania fotonu o częstości v = A. Tego lypn przejścia nazywane są przejściami d d. Na przykład w jonie kompleksowym |< 'u(H20)6]2+ o symetrii oktaedrycznej znajduje się 9 elektronów d. Orbitale są rozszczepione na orbitale t2s całkowicie obsadzone i orbitale e„ o wyższej energii, w których brak jednego elektronu (jest dziura). Pod wpływem promieniowania elektron z poziomu
przechodzi na poziom eg, a dziura pojawia się na poziomie t2g- Przejście to odpowiada pasmu absorpcyjnemu przy długości fali k = 800 nm (v = 12500 cm-1). Przykład ten pokazuje schemat na rys. 6.4.
Konfiguracje elektronów w oktaedrycznym polu ligandów w stanie podstawowym 1 wzbudzonym, dla kationów o liczbie elektronów od 1 do 9, oraz wartości ż\ dla wybranych kompleksów kationów metali, o danej konfiguracji, z H20 przedstawiono w tabl. 6.2.
Pasma przejść d -> d leżą w zakresie widzialnym lub bliskim nadfiolecie i są odpowiedzialne za różne zabarwienie soli metali przejściowych (np. Cu2+, Co2+, Ni2+,
(lr3+)-
Omówione wyżej przejścia są możliwe w związkach kompleksowych zawierających Iz w. chromofory d-d. Ponadto w związkach kompleksowych mogą występować chro-mofory d-n. Obecność chromoforów d-n powoduje występowanie wzajemnego oddziaływania elektronów d metalu z elektronami n ligandów. Wobec takich chromoforów pojawiają się silne pasma absorpcyjne, które są przypisywane przejściom elektronów od
Wyszukiwarka
Podobne podstrony:
CCF20100217�002 FKalendarium 1898 uruchomienie trakcji elektrycznej na lokalnej linii Wąbrzeźno --Wą
CCF20110129�047 Absorpcja promieniowania elektromagnetycznego przez ulom powoduje przejśiji elektron
Przejścia elektronowe n —><j*X = 150 - 250 nm słabe pasma absorbcyjne; niewiele związków absor
Przejścia elektronowe n -> n* oraz 71 —> 71* większość widm UV/Vis: 200 - 600 nm tc —> 7t *
CCF20121020�024 W każdym przypadku, energia uzyskana przez przejście elektronu na orbilal wiążący je
spektroskopia055 11. PRZEJŚCIA PROMIENISTE - LUMINESCENCJA Luminescencja, to przejścia elektronowe p
Strona 189 Schematy instalacji elektrycznej Rys. 7.33. Schemat rozmieszczenia złączy wiązek przewodó
Zadanie 19. (0-1) Jacek wic, ze na przejście w genach 1 km szlaku potrzeba około 15 minut i dodatkow
CCF20110325�007 S - powierzchnia okładki, 8r - przenikalność elektryczna substancji zawartej między
CCF20121205�004 BI-1 sem V Opis techniczny 3 PŁK = AW-T = 386,6 -106,49 = 280,1 Im = 0,2 + 80,1
Zjawisko fluorescencji i fosforescencji można zobrazować za pomocą diagramu przejść elektronowych
Ad. 2. Przejścia elektronów w cząsteczce z niższych poziomo’,v na wyższe zachodzi dzięki absorpcji
CCF20110129�018 ~x) imiirin ouczynmk kompleksujjjcy, w przypadku gdy o/nm .nmy kationy meiu w posta
CCF20110310�002 PODRĘCZNIK INPE DLA ELEKTRYKÓW praca zbiorowa pod redakcją Jana Strojnego Zeszyt 11
więcej podobnych podstron