DSCF6625

206

Po zastosowaniu skali funkcyjnej (T1, ln J?r) i (T~l, ln/0) można związać współczynniki nachylenia bt i b2, odnoszące się odpowiednio do tennistora i diody, z szerokością przerwy energetycznej AE i energią Fermiego Ef.
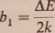

Obliczmy teraz temperaturowy współczynnik zmiany oporu tennistora:
[
-1^-1 °T~RdT~ R
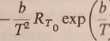
1
b
Zwykle interesuje nas wartość tego współczynnika w temperaturze pokojowej, np. fl30o-
6. Pomiary i opracowanie
Kąpiel olejową, w której umieszczone są badane opory, termistor i dioda, należy podgrzać do ok. 350 K, a następnie wyłączyć grzejnik i utrzymując za pomocą mieszadełka stałą temperaturę w całej objętości oleju, mierzyć opory elementów w odstępach ok. 5K. Prąd wsteczny diody mierzymy przy ustalonej różnicy potencjałów pomiędzy anodą i katodą.
Pomiary należy przedstawić w formie wykresów (dla termistora i diody po zastosowaniu skali funkcyjnej), a następnie metodą najmniejszych kwadratów znaleźć współczynniki termicznej zmiany oporu próbki metalowej i stopu oraz 0300, AE i EF dla elementów półprzewodnikowych (por. wzory 11 f 13).
Pytania
1. Jak zmienia się przewodność półprzewodnika przy temperaturze T dążącej do zera?
2. Współczynnik aT we wzorze 13 zależy jawnie od temperatury. Czy zależy od temperatury współczynnik /?„ we wzorze 5?
1-9. Badanie zależności oporności elektrolitu od temperatury. Oszacowanie średniego promienia jonów 1. Wstęp
Większość soli, zasad i kwasów nieorganicznych ulega w wodzie (i w niektórych innych rozpuszczalnikach) dysocjacji, tzn. rozpadowi na jony. Stwierdzono, że powodujące dysocjację osłabienie wiązań elektrostatycznych jest szczególnie duże w rozpuszczalnikach o wysokiej wartości przenikalności dielektrycznej.
W roztworach soli, kwasów i zasad (ogólnie elektrolitów) zwykle nie wszystkie cząsteczki są zdysocjowane. W przypadku elektrolitów silnych, do których zaliczamy prawie wszystkie sole, kwasy: HBr, HC1, HJ, HN03, zasady: NaOH, KOH i in., stosunek liczby jonów w roztworze do liczby jonów, która istniałaby w wypadku całkowitej dysocjacji (współczynnik dysocjacji), jest bliski jedności. Współczynnik dysocjacji zależy m. in. od stężenia roztworu i od temperatury. Jeśli stężenie roztworu jest bardzo małe, można przyjąć, szczególnie w przypadku elektrolitów silnych, że dysocjacji uległy wszystkie molekuły.
2. Przewodność elektrolitów
Nośnikami prądu w elektrolitach nie są elektrony, jak w przypadku metali, lecz jony, naładowane cząstki o wymiarach atomów lub molekuł. Ponadto, inaczej niż w metalach, przewodzenie prądu przez elektrolit związane jest z przenoszeniem masy.
Rozpatrzmy elektrolit umieszczony pomiędzy dwiema równoległymi elektrodami. Jeśli różnica potencjałów elektrod wynosi U, a odległość między nimi d, wówczas jony poruszają się w polu elektrycznym o natężeniu E — U/d, czyli na jon o ładunku Ze, gdzie e oznacza ładunek elementarny, działa siła:
F = ZeE = —t~ O)
d
Ponadto na jony działa siła tarcia F,. Zakładając, że jony mają kształt kuli o promieniu r, możemy znaleźć opór ośrodka w oparciu o prawo Stokesa (por. ćw. C-3):
Wyszukiwarka
Podobne podstrony:
36102 SNB13959 206 W kontakcie z nadzorem pedagogicznym, ośrodkiem metodycznym ko^T~l z ewentualnych
skanowanie0019 (21) Prąd w transformatorze KOZ-T1 po stronie napięcia 400 kV (po zastosowaniu twierd
51345 skanowanie0019 (20) Prąd w transformatorze KOZ-T1 po stronie napięcia 400 kV (po zastosowaniu
image 063 Twierdzenie o dualności 63 Rys. 3.3. Antena szczelinowa: a) struktura anteny, b) struktura
img206 206 Po odwzorowaniu róvmokątnym takiego p3sa południkowego kuli (lub elipsoidy) na waico, a n
str272 1 f 272 5. ZARYS RACHUNKU TENSOROWEGO Po zastosowaniu umowy sumacyjnej powyższy wzór przybier
skanuj0005(1) 3 Interakcje Cefamandol, Cefoperazon, ceftriakson, po zastosowaniu z etanolem może doc
18231 IMAG1831 Fosfor z nawozów mineralnych w pierwszym roku po zastosowaniu jest pobierany prz
D.U60. przygotowuje pacjentkę do znieczulenia oraz monitoruje jej stan po zastosowaniu znieczulenia
(4.4.3) Dla gazu wilgotnego nienasyconegomS P8 a po zastosowaniu równania stanu ga
więcej podobnych podstron