DSCF6716

40
A
0
2 3
N ml Me
N
3 2
0 ml L
7. Porównać uzyskane dla każdego kompleksu wykresy i wyciągnąć wnioski dotyczące trwałości obu kompleksów.
8. Wyznaczyć składy badanych kompleksów.
10. SPEKTROFOTOMETRYCZNE WYZNACZANIE STAŁEJ DYSOCJACJI
Związek o charakterze słabego kwasu (HA) ulega w rozpuszczalnikach typu wody (SH) dysocjacji
HA + SH SH2* + A‘
której równowagę charakteryzuje stała dysocjacji kwasowej
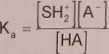
(D
Podobnie moc zasady (B) reagującej z rozpuszczalnikiem wg równania B + SH *===i S' + BHł
k
określa stała dysocjacji zasadowej
(2)
K _M£1
U i
Poza stałymi stężeniowymi opisanymi równaniami (1) i (2), używa się stałych aktywnościowych, mających znaczenie termodynamiczne. Stała aktywnościowa zapisana dla roztworu słabego kwasu ma postać

(3)
gdzie:
a - aktywność odpowiedniej formy.
W roztworach rozcieńczonych dla scharakteryzowania mocy słabych kwasów lub zasad używa się często tzw. „mieszanych stałych dysocjacji" zdefiniowanych jako
k: =
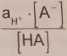
(4)
zlogarytmowanie obu stron równania (4) daje wyrażenie (5)
pK; = pH + igra (5)
M
Równanie powyższe pozwala znaleźć stałą dysocjacji na podstawie pomiaru stosunku stężeń sprzężonej pary kwas-zasada w roztworze o znanym pH.
Wygodnym (z metodycznego punktu widzenia) obiektem, pozwalającym na wyznaczenie stałej dysocjacji metodą fotometryczną w widzialnej części widma, jest dwubarwny wskaźnik stężenia jonów wodorowych, wykazujący charakter słabego kwasu. Jeżeli stan równowagi w roztworze wskaźnika opisać równaniem
Wyszukiwarka
Podobne podstrony:
Odpowiedź detektora 40 1 mL 1 10 nfl/mL// i 1 i , U 02468
1. Wzrost przepływu krwi przez mięśnie podczas ciężkiego wysiłku z 30 - 40 ml/min/
31 (40) y***** Ml m&śam& ■ 9&
Szaszłyk z kiwi SZASZŁYKI Z KIWI4 dojrzale kiwi 15 dag zielonych winogron mata cytryna 40 ml rumu 4
100?n na gwiazdke i karnawal040 Wszystkie receptury na jeden kieliszek. Kostki lodu zalać po 40 ml w
100?n na gwiazdke i karnawal041 Napoje - HIT SEZONU Po 60 ml soku pomarańczowego i ananasowego, 40 m
zad 7 39 B i 7 40 ml + r^j - (£jii L z= (f[1 -f � j -fj7li^r/IZO -f~kO i t VA Ae©v =
9 Przygotować trzy zakodowane pojemniczki jednorazowe poj. 40 mL i wlać do nich po około 20 mL odpow
IMG 69 270 7. Analiza miareczkowa. RedoksometriaSposób wykonania Roztwór badany (20-40 mL) (środowis
3 (65) n B Do roztworu zawierającego siarczany dodano 40 ml 0,02 M roztworu BaCl2, a następnie wytrą
23 (40) (§ ML k ,
skanowanie0029 Tablica IX-14. Tablica do ćwiczenia 8f-45 Przykład 9 9i di D 9= i 1 40 Ml
4. Sposób wykonania ćwiczenia Do kolby w zestawie destylacyjnym wlewamy ok. 40 ml roztworu i przy po
500 m 400 m 300 m 200 m 100 m 0 km 20 km 40 km M©e km 47 El Papiol 60 km Velódrom d Horta km
DSCF6791 40 Przygotowany w ten sposób lejek z sączkiem umieszcza się w pierścieniu statywu do sączen
więcej podobnych podstron