DSCN4177 (2)
Prawa Faradaya
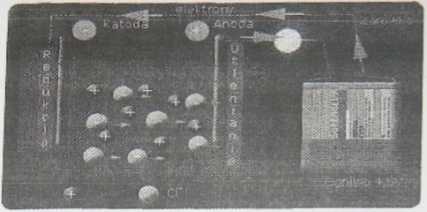
Prawa Faradaya pozwalają obliczyć masę substancji wydzielonej na elektrodzie (katodzie lub anodzie) w wyniku elektrolizy.
I prawo określa wpływ czasu elektrolizy t w sekundach [s] I natężenia prądu I w amperach [A] na wydzieloną masę m w gramach [g] m — k ■ X ■ t
gdzie k jest współczynnikiem proporcjonalności (równoważnik elektrochemiczny) zależnym od rodzaju substancji.
Wyszukiwarka
Podobne podstrony:
DSCN4170 (4) Ogniwo elektrochemiczneOgniwo elektrochemiczne Różnicę potencjałów nie pracującego ogni
DSCN4172 (4) Ogniwo galwaniczne - ogniwo Daniella Zn2+(aq, + 2e Zn(s)
skanuj0057 7 2C !Ł »c 2e»*«Zr«* ■» jmi łKMM *CP-*aia 31 teaa
58295 Skandowce (1) Sc Otrzymywanie elektroliza stopionego ScCI3 na katodach cynkowych Właściwości c
NaCl Elektroda Reakcje Potencjał <P°(V) Katoda Na+ + e —>Na -2,714 H20 + e-
Źródła jonów Źródło z jonizacją elektronami - np. układ żarzona katoda + anoda -
Ogniwa korozyjne- ogniwo elektrochemiczne składa się z elektrolitu oraz dwóch elektrod, pomiędzy któ
3 Do utworzenia wiązki elektronów potrzebne jest źródło (katoda - włókno wolframowe), gdzie wytwarza
KIERUNEK LICENCJACKI - NAUKI ŚCISŁE wolframianokrzemowego Hx[Si(W207)r,] x H2O. Ogniwo elektrochemic
P1050662 1 ELEKTROGRAW1METR1A, ELEKTROGRAFIA I KULOMETRIA 260 zanurzona katoda. Po skończonej elektr
353 [1024x768] 342 ELEKTROCHEMIA Napisanie reakcji w postaci: 1/2 Zn + 1/2 Cu2* = l/2Zn2* + l/2Cu im
25702 str059 (4) 116 Ćwiczenie nr 132. PRAKTYCZNY SZEREG NAPIĘCIOWY Rys. 1. Ogniwo elektrochemiczne.
23 luty 07 (43) Przyspieszenie kątowe: (2.2c) (2.2d) (2.2e) (2-2f) e(t) = (0,0,e(t)), e(t) = ^ = ^-
DSCN4167 (4) Reakcja elektrochemiczna - jeżeli elektrony nie są przenoszone bezpośrednio między jona
DSCN4169 (4) Ogniwa elektrochemiczne Układ dwóch elektrod spiętych przewodnikiem metalicznym i zanur
więcej podobnych podstron