3582308714
|
Laboratorium chemii fizycznej | ||
|
Sprawozdanie z ćwiczenia: „Kalorymetryczne wyznaczanie efektów cieplnych rozpuszczania soli w wodzie" | ||
|
Ćwiczenie przeprowadzili: |
Ocena z przygotowania: |
Ocena ze sprawozdania: |
|
- | ||
|
- Pietruszko Adam | ||
|
- SyzdekJarosław | ||
1. Cel ćwiczenia
Celem ćwiczenia było wyznaczenie całkowitego molowego ciepła rozpuszczania soli w wodzie.
2a. Wprowadzenie teoretyczne
Efekty cieplne procesów wyznacza sią mierząc ich entalpią - H. Jak każda ekstensywna funkcja stanu jest ona funkcją dwóch spośród trzech parametrów: p,V,T oraz ilości składników: H{p, T, th, n2t ..., n*), a jej różniczka zupełna ma postać:
dH =
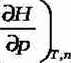
dp+f^O dT+yi
lar l„e u
dH
dn„
dnr_
W warunkach izobaryczno - izotermicznych wyrażenie to przyjmuje postać:
■] (i), gdzie
)p,T.nArB L**1® Jp
jest to entalpia molowa cząstkowa, czyli udział składnika B w entalpii roztworu. Wyrażenie (1) przyjmie więc postać:
dli =yjTHBdnB (2)
Ponieważ ekstensywne funkcje stanu są funkcjami jednorodnymi stopnia pierwszego wzglądem ilości składników, zatem można skorzystać z twierdzenia Eulera:
^ , (3)
a
Różniczkując wyrażenie (3) otrzymujemy:
dH =]T/i8dnB +J^nBdHs (4)
B B
Wyrażenia (2) i (4) są tożsamościowe równe, skąd wynika, że Z^a^a =0,
0
Wniosek z tego że przyrosty entalpii molowych cząstkowych nie są niezależne od siebie.
Wyszukiwarka
Podobne podstrony:
Laboratorium chemii fizycznej Sprawozdanie z ćwiczenia: „Adsorpcja oranżu metylowego na
Laboratorium chemii fizycznej Sprawozdanie z ćwiczenia: „Badanie kinetyki reakcji inwersji
Laboratorium chemii fizycznej Sprawozdanie z ćwiczenia: „Termodynamika ogniw
_Laboratorium chemii fizycznej_ Sprawozdanie: „Fizykochemiczna charakterystyka substancji czystych;
Laboratorium chemii fizycznej Sprawozdanie: „Zastosowanie chromatografii gazowej do badań adsorpcji
Laboratorium chemii fizycznej Warszawa, 13.05.2003 Sprawozdanie z ćwiczenia: ..Badanie kompleksowyc
Laboratorium chemii fizycznej Warszawa, 29.04.2003 Sprawozdanie z ćwiczenia: „Fizykochemiczna
Laboratorium chemii fizycznej Warszawa, 01.04.2003 Sprawozdanie z ćwiczenia: „Wyznaczanie
Laboratorium chemii fizycznej Protokół pomiarów do ćwiczenia: „Spektrofotometryczne wyznaczanie
img233 Ćwiczenia laboratoryjne z chemii fizycznej II CH, sem. 1 Tematy ćwiczeń i zakres wiadomości.
LABORATORIUM FIZYKI OGÓLNEJ SPRAWOZDANIE Z ĆWICZENIA NR 84TEMAT : WYZNACZANIE DŁUGOŚCI FALI ŚWIETLNE
więcej podobnych podstron