3236692155
Założenia Michaelisa-Menten
Szybkść reakcji
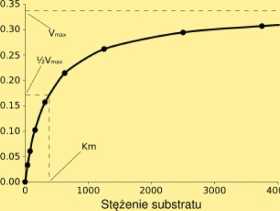
Krzywa wysycenia dla reakcji enzymatycznej ukazująca zależność szybkości reakcji V od stężenia substratu [S]
Wyszukiwarka
Podobne podstrony:
LastScan3 (5) WŁAŚCIWOŚCI KINETYCZNE ENZYMÓW MODEL MICHAELISA - MENTEN ..... • E + S ES E + P *
B. Model kinetyczny nieodwracalnej reakcji enzymatycznej wg Michaelisa-Menten Założenia
skanowanie0011 Kinetyka reakcji enzymatycznych Wyprowadzenie równania Michaelisa-Menten. Stała Micha
SkanT 16. kinetyka rakcji enzymatycznej- toria Michaelisa- Menten. I>jjJniczym
17410 WYKŁAD 2 enzymy cz 1 (38) RÓWNANIE MICHAELISA-MENTEN Analiza równania Michaelisa-Menten dla
szybkosc stezenie RYS. 20. Wykres Michaelisa-Menten zależności szybkości reakcji enzymatycznej (v) o
Zdjęcie0160 Reakcje większości enzymów opisuje równanie Michaellsa-Menten: szybkość maksymalna szybk
WYKŁAD 2 enzymy cz 1 (37) RÓWNANIE MICHAELISA-MENTEN Analiza równania Michaelisa-Menten dla trzec
WYKŁAD 2 enzymy cz 1 (39) RÓWNANIE MICHAELISA-MENTEN Analiza równania Michaelisa-Menten dla trzec
skanowanie0009 mulłienzymKinetyka reakcji enzymatycznej Stała MichaeMsa-Menten E + S^ ES ► E + P Gdz
Image0094 32 Założenia teoretyczne i metodologiczne wistości, jaką stało się dla mnie zjawisko krzyw
więcej podobnych podstron