105805

Jeżeli w rozpuszczalnikach rozpuszczamy równocześnie kilka różnych substancji, wówczas prawo podziału Nersta stosuje się do każdej z nich. niezależnie od obecności innych.
2. CEL ĆWICZENIA.
Celem ćwiczenia jest wyznaczenie współczynnika podziału kwasu benzoesowego między warstwy wodną, a ksylenową .
3. METODA POMIARU.
Dokonujemy odważenia trzech naważek kwasu benzoesowego. Wsypujemy je do kolbek Erlenmayera i do każdej wlewamy 25 cm3 ksylenu. Po rozpuszczeniu do każdej kolbki wlewamy 35 cm wody. Wytrząsamy około 20 minut. Z każdej fazy ksylenowej pobieramy 2 cm3 roztworu, dodajemy 25 cm3 wędy, odparowujemy ksylen w czaszy i miareczkujemy na gorąco NaOH wobec fenoloftaleiny. Identycznie postępujemy z fazą wodną z tą różnicą, że pobieramy 5 cm3 roztworu wodnego i miareczkujemy na gorąco.
4.STOSOWANE WZORY.
Jeżeli układ izotermiczno-izobaryczny złożony jest z dwóch nie mieszających się cieczy 1 i 2 to jest on układem dwufazowym, w którym fazę pierwszą stanowi roztwór składnika 2 w 1, a faza druga jest nasyconym roztworem składnika 1 w 2. Jeżeli do jednej z faz wprowadzimy składnik trzeci, to rozpocznie się proces przenoszenia tego składnika przez granicę faz, aż do ustalenia się równowagi termodynamicznej. Stan równowagi zostanie osiągnięty, gdy potencjały chemiczne składnika trzeciego w obu fazach będą jednakowe:
m] = m3„ n) + RT\naJ = //„ + Klina,\
a} ,aj - aktywności składnika trzeciego w fazach l i II.
RT
£m4limap£MZ£lmKm
Dla realnych stężeń określa się tzw. współczynnik podziału Nersta wyrażony za pomocą stężeń:
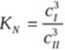
5. WYNIKI POMIARÓW .
|
LP- |
c, |
c2 |
C2/C! |
Ci(l-a) |
CJ Ci(l-a) |
|
1 |
0.005 |
0.0275 |
5.5 |
0.00446 |
6.1583 |
|
2 |
0.008 |
0.055 |
6.875 |
0.00714 |
7.6979 |
|
3 |
0.013 |
0.115 |
8.849 |
0.01161 |
9.9049 |
Wyszukiwarka
Podobne podstrony:
Podczas utrwalania mamy często do czynienia z procesem rozpuszczania i przemieszczania różnych subst
Podczas utrwalania mamy często do czynienia z procesem rozpuszczania i przemieszczania różnych subst
25406 Obraz#6 (5) Spoiwa bezwodne składają się z olejów albo różnych substancji chemicznych, jaJc np
IMG)08 (2) Rozpuszczalność w wodzie - to ilość substancji w miligramach , którą można rozpuścić w 1
r gdzie: nl — liczba moli rozpuszczalnika, «2 — liczba moli substancji rozpuszczonej. Ponieważ p,
Rozpuszczalność jest to ilość substancji tworzącej roztwór nasycony w określonej ilości (najczęściej
32327 Zdjęcie0868 - pojemność rozpuszczania (zdolność przyjmowania danej substancj
[.1.1. Stężenia roztworów Roztwór składa się z rozpuszczalnika i co najmniej jednej substancji
DSCF5537 Zależność pomięozy sirua aktywnością rozpuszczalność w wodzie - niższa dla substancji
TABELA ROZPUSZCZALNOŚCI WODOROTLENKÓW I SOLI □ Substancja rozpuszczalna w roztworz
więcej podobnych podstron