122526

^ 0
Wracając do warunku równowagi fazowej mam: Pi = p, + RTInS
_ —i2l- = -R ln(S * y) T
Q roztwór
Dzieląc obie strony przez T otrzymuję: —--— = R ln(S * y) czyli ——-
Uwzględniam, że dla każdego G = ——
oT T*
Równanie równowagi fazowej różniczkuję względem temperatury przy stałym ciśnieniu:
|
p roztwór G ml |
GSm. _ |
-R ln(S* y) |
(a i - hst* |
_ Hllll Rł |
|
T |
T |
UJp T2 |
T2 | |
|
a ponieważ |
I X 3* II > X |
rozpl I®’ | ||
dlnS , dT ’
d In S _ nupi
dT ~ RT2 R T
AHm/p, może mieć różny znak. W skład procesu rozpuszczania wchodzą dwa: zburzenie wiązań w sieci krystalicznej (zawsze dodatnia zmiana entalpii) i solwatacja (zawsze ujemna zmiana entalpii). W zależności od tego. który efekt przeważa taki znak ma AH^, .Dla kwasu benzoesowego rozpuszczającego się w wodzie jest to liczba dodatnia.
i całkując to równanie względem temperatury otrzymuję In S = —
AH
rozpl . 1
* —+ const
Obraz graficzny tej funkcji, czyli jak rozpuszczalność substancji (1) zależy od temperatury.
InS
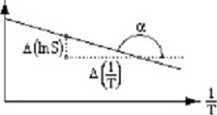
Przykład
W temperaturze 60°C rozpuszczalność kwasu benzoesowego w wodzie wynosi 11.6g/kgH;0. a w temperaturze 50°C rozpuszczalność wynosi 7.8g/kgH;0. Obliczyć ciepło rozpuszczania tej substancji. M(C6H5COOH )= 122g/mol
* AHnu,p| — R
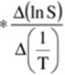
-8.314*0.3969 J -9,2887 *I0'5 mol
= +35.5U / mol
|
pomiar nr |
S |
T |
InS |
1/T |
A(lnS) |
A(l/T) |
|
1 |
0.09508 |
333.15K |
-2.3530 |
3,00165*10 'K1 |
40.3969 |
-9.2887* 105K‘ |
|
2 |
0.0639 |
323.15K |
-2.7499 |
3.0945*10 'K 1 |
A(lnS),
Rozpuszczanie kwasu benzoesowego jest endotermiczne. Przeważa ciepło potrzebne do rozrywania wiązali sieci krystalicznej nad ciepłem solwatacji.
3. Kutek!) k to układ dwuskładnikowy dw ufazowy ciecz - ciało stałe , w którym:
roztwór ciekły jest doskonały ( Pj = p* + RT In) a w stanie stałym składniki tworzą odrębne fazy.
Ogólnie mówiąc, faza gazowa zawsze jedna bez względu na to. czy składnik jeden czy składniki dwa w układzie, fazy ciekłe mogą być dwie - gdy duże odchylenia dodatnie. W fazie stałej jeszcze trudniej składnikom się dopasować. Aby tworzyć stałe roztwory, czyli kryształy mieszane, to oba składniki muszą krystalizować w tej samej sieci, muszą być zastępowalne, albo pasować do luk.
Benzen i naftalen tak dobrze nie pasują do siebie - tworzą zupełnie odrębne kryształy, czyli dwie fazy stałe.
2
Opracowanie: dr in2. B. Andruszkiewicz
Wyszukiwarka
Podobne podstrony:
179 2 Ostatecznie, po wykorzystaniu warunku równowagi fazowej, otrzymuje się, że 2886 - 1,991 ■ 10&q
174 5 1 W> KRESY FAZOWE Wykresy fazowe dotyczy warunków równowagi fazowej. Tworzenie mC mikrostru
179 2 Ostatecznie, po wykorzystaniu warunku równowagi fazowej, otrzymuje się, że 2886 - 1,991 ■ 10&q
73195 skan0148 Roztwory i równowagi fazowe 151 Roztwory i równowagi fazowe 151 f Pi <Pi P° Dla ga
300 [1024x768] 308 ROZTWORY I RÓWNOWAGI FAZOWE podwójnych. Obszar H20aeb obejmuje nienasycone roztwo
34759 skan0145 (2) 148 Roztwory i równowagi fazowe Rys. 4.9. Zależność objętości pozornej NaCl w roz
skan0135 138 Roztwory i równowagi fazowe Rozwiązanie. Do obliczeń y2 wykorzystamy wzór (4.20) 0- 1 m
44570 skrypt074 (4 76 Po ich podstawieniu do (4.17) otrzymuje się dwa warunki równowagi R, Cx = R4 C
więcej podobnych podstron