122530

2. Skala potencjałów położni w.
"G25J
Pt
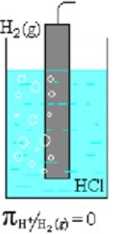
Za zero przyjęto potencjał półogniwa (elektroda z jej roztworem ) wodorowego:
1. elektroda platynowa pokryta czernią platynową (rozwinięta powierzchnia).
2. roztwór jonów Hł (kwas solny) o aktywności (stężeniu) I mol/dm lub I mol/kgHjO
3. gazowy H2 o aktywności (ciśnieniu) latm w każdej temperaturze.
Budując ogniwo z elektrody wodorowej (standardowej) i badanej elektrody i mierząc różnicę potencjałów (przy otwartym ogniwie czyli metodą kompensacyjną) otrzymuje się potencjał elektrody (Jt). Jest to równocześnie SEM wzorcowego ogniwa.
Przykład 2.1
Napisać reakcje zachodzące w ogniwie złożonym z wzorcowej elektrody wodorowej i elektrody miedziowej. W jakim kierunku płyną elektrody w zewnętrznym przewodniku ogniwa?
Elektroda wodorowa jest umieszczona na schemacie w pozycji lewej (anodowej) ze schodzeniem do roztworu jonów H2 -e —> Hł
Zgodnie z przyjętym ustalenie o schodzeniu jonów H\ na tej drugiej elektrodzie umowa wymaga napisania reakcji: Cu2+ +2e -> Cu0
Sumaryczna reakcja ogniwa ( z równą ilością elektronów w reakcjach połówkowych):
H2 +Cu2* 2H+ +Cu° reakcja formalna, umowna
Z punktu widzenia tych reakcji elektrony powinny płynąć od elektrody, która je pobiera od wodoru (platyna) do elektrody, która je przekazuje w reakcji jonom miedzi.
A jaki wyniknie kierunek elektronów w zewnętrznym przewodniku, gdy rozważyć potencjały elektrod?
Elektroda badana(np. Cu | Cu2ł) ma (wzięty z tablic) potencjał 7^-u|c/* = 0,345V Elektroda wodorowa standardowa ma z definicji potencjał zero.
Elektrony w zewnętrznym przewodniku płyną od platyny (potencjał 0) do miedzi (potencjał +0.345V). Elektrony płyną od elektrody bardziej ujemnej (bogatszej w elektrony) do elektrody mniej ujemnej, uboższej w elektrony. Wniosek o kierunku przepływu elektronów w zewnętrznym przewodniku ogniwa wynikający z potencjałów pokrywa się z umowną, formalną reakcją.
Reakcja formalna jest tutaj jednocześnie reakcją realną.
Standardowa siła elektromotoryczna ogniwa E® = ic® -Jl®
Wzór ten zastosuję do przykładu 2.1 E® = n® -n,® = nc 2+^0 wł *-K)J45V-o = *0.345V
Gdy SEM wychodzi dodatnie, to reakcja formalna jest równocześnie reakcją biegnącą w ogniwie.
Blaszka platynowa omywana wodorem zanurzona w roztworze kwasu jest tutaj anodą, blaszka miedziana zanurzona w roztworze soli miedzi jest tutaj katodą.
Przykład 2.2 Narysować zgodnie z konwencją schemat ogniwa wzorcowego dla elektrody cynkowej o potencjale standardow-ym ^2n2*tZn° = -0,762V
Podać reakcję sumaryczną faktycznie zachodzącą w' ogniwie po połączeniu elektrody wodorowej i cynkowej. W którą stronę płyną elektrony w zewnętrznym przewodniku ogniwa?
Opracowanie: dr in2. B. Andruszkiewicz
Wyszukiwarka
Podobne podstrony:
Językiem programowania nazywamy zestaw zasad tekstowego lub graficznego opisu algorytmu za pomocą pr
PB081391 PIENIĄDZ to cokolwiek co służy za powszechnie przyjęty środek przenoszenia wartości w
Obrazuje to schemat (rys. 2) związku przyczynowo-skutkowego dla którego za przykład przyjęto
Potencjał standardowy - (dawniej potencjał normalny) skala potencjałów względem
SR = 1.8 [%] Za AR przyjęło największy błąd wyznaczenia wartości R - soczewka nr 4
Stosujący tę grę stale przerzuca odpowiedzialność za nie przyjęcie propozycji na „okrutne”
4 6 2 W ślad za klasyfikacją przyjętą w Uns Europejskiej polską pszenicę podzielono na 5 grup
DSC?61 goś, co wcale nim nie jest, gdyż za monoteizm przyjęto pojawiające się u ludów pierwotnych po
SAMOTNA PAŁACOWA SKAŁA Cesarz zaczął rozglądać się za jakimś zastępcą. Oczywiście, ucieszyło to
TRZY DWIEŚCIE. KASA JEST ZA FILAREM. PRZYJEMNEGO POBYTU I POLECAMY SIĘ NA PRZYSZŁOŚĆ”. Przy takim
Klasa III a przedstawia sztukę w 3 aktach pt: „A to było tak...”
więcej podobnych podstron