POMIARY pH
Sposób wyznaczania stężenia jonów wodorowych zaproponował Sörensen. Wprowadził on wielkość pH, zidentyfikowaną zależnością:
pH = - log[H+]
Przy pomocy tego równania stężenie jonów wodorowych w rozcieńczonych roztworach kwasów i zasad można wyznaczać drogą pomiarów przewodnictwa.
Często chodzi o określanie pH w roztworach bardziej stężonych i zawierających różne inne jony. Konieczne jest tu wykorzystanie odpowiedniego ogniwa, którego siła elektromotoryczna byłaby bezpośrednio związana ze stężeniem jonów wodorowych.
Np. ogniwo:
Pt│H2(1 atm)│roztw.║Hg2Cl2(nas.)│Hg2Cl2(s)│Hg
złożone z elektrody wodorowej działającej w badanym roztworze i elektrody kalomelowej połączonej z elektrodą wodorową kluczem elektrolitycznym. Na elektrodach zachodzą reakcje:
prawa elektroda ½ Hg2Cl2(s) + ē → Hg + Cl-(nas.)
lewa elektroda ½ H2 → H+ + ē
reakcja sumaryczna ½ H2 + ½ Hg2Cl2 → H+ +Cl-(nas.) +Hg
Zakładając, że stężenie i aktywność jonów chlorkowych są niezmienne i uwzględnione w wartości wyrazu stałego, można napisać:
![]()
gdzie: E - siła elektromotoryczna,
![]()
- aktywność jonów wodorowych w roztworze.
Wartość wyrazu stałego można wyznaczyć wykonując pomiary na roztworze o znanym stężeniu jonów wodorowych.
Pomiar pH obecnie dokonuje się przy pomocy elektrody szklanej z uwagi na łatwość w jej użyciu.
WYKONANE ĆWICZENIA
Pomiary rozpoczynamy po nagrzaniu się pehameru, po upływie ok. 30 min. Przed przystąpieniem do pomiarów należy wykalibrować elektrodę dla różnych pH roztworów buforowych (dla środowiska kwaśnego i zasadowego); elektrodę po każdym użyciu należy dokładnie opłukać wodą destylowaną.
Pomiar pH został przeprowadzony następująco: do zlewki wlewamy
20 cm3 roztworu badanego kwasu solnego o stężeniu 0,1 mol/dm3, dodajemy
2 - 5 kropel fenoloftaleiny, zanurzamy elektrodę i uruchamiamy mieszadło magnetyczne. Następnie dodajemy z biurety wodorotlenek sodu o stężeniu
0,1 mol/dm3 w następujących ilościach: po 1 cm3 na początku miareczkowania zmniejszając ilość zasady w miarę zbliżania się do punktu końcowego po
0,1 mol/dm3. Po dodaniu każdej porcji zasady odczytujemy wartości pH oraz obserwujemy zmianę barwy roztworu i notujemy w tablicy wyników pomiaru.
ZESTAWIENIE WYNIKÓW POMIARU
Tabela wyników pomiarów.
Nr pomiaru |
Objętość kwasu [cm3] |
Objętość zasady [cm3] |
Wartość pH [mV] |
Barwa roztworu |
1 |
2 |
3 |
4 |
5 |
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 1 |
20
2 |
0,00 2,00 4,00 6,00 8,00 9,00 10,00 11,00 12,00 13,00 14,00 15,00 15,50 16,00 16,50 17,00 17,20 17,40 17,60 17,80 18,00 18,20 18,40 18,60 18,80 3 |
2,03 2,06 2,10 2,15 2,20 2,24 2,27 2,31 2,36 2,41 2,47 2,54 2,59 2,63 2,69 2,75 2,79 2,83 2,86 2,91 2,96 3,00 3,05 3,12 3,20 4 |
Bezbarwny
5 |
26 27 28 29 30 31 32 33 34 35
36
37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 |
|
19,00 19,10 19,20 19,30 19,40 19,50 19,60 19,70 19,80 19,90
20,00
20,10 20,20 20,30 20,40 20,50 20,60 20,70 20,80 21,00 21,20 21,40 21,60 22,00 22,50 23,00 23,50 24,00 25,00 26,00 27,00 28,00 29,00 30,00 |
3,30 3,39 3,46 3,50 3,65 3,78 4,00 4,87 6,07 7,46
9,08
9,46 9,75 9,91 10,03 10,13 10,21 10,28 10,34 10,47 10,55 10,61 10,68 10,78 10,89 10,97 11,03 11,09 11,19 11,26 11,32 11,37 11,40 11,45 |
Bezbarwny Lekko różowy zanikający Intensywny różowy
Intensywny różowy |
WNIOSKI
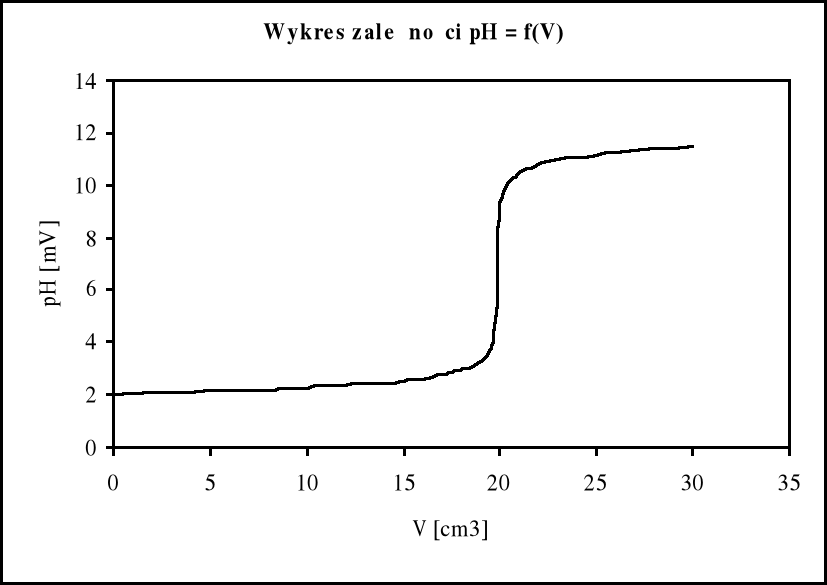
Celem ćwiczenia jest wyznaczenie punktu końcowego, podczas miareczkowania kwasu zasadą, na podstawie pomiarów pH oraz zmiany barwy wskaźnika. Bezpośrednie pomiary dają tablicę pH = f(V). Punkt końcowy wyznacza się z maksimum funkcji d(pH)/dV = f(V) oraz na podstawie punktu zmiany znaku funkcji d2(pH)/d2V = f(V).
W doświadczeniu otrzymaliśmy następujące wyniki: PK dla pierwszej pochodnej jest przy objętości dodanej zasady 19,90 cm3, co odpowiada stężeniu końcowemu kwasu 0,0995 mol/dm3 (stęż. r-ru kwasu 0,1M.), natomiast z drugiej pochodnej odpowiednio 19,74 cm3 obj. zasady oraz 0,0987 mol/dm3 stężenie kwasu. Ze zmiany barwy roztworu wynika iż punkt końcowy znajduje się, dla objętości dodanej zasady, między 19,90 - 20,00 cm3, gdyż tu pojawia się trwałe zabarwienie roztworu. Wynik ten jest zgodny z wynikami obliczeń, a niewielka różnica w stężeniu kwasu (miareczkowany był 0,1 M kwas otrzymaliśmy wynik 0,0995 i 0,0987 M) co było spowodowane błędami w odczytywaniu z biurety (maksymalny błąd biurety ±1 cm3).
Wyszukiwarka
Podobne podstrony:
10 Pomiary szczegolow sytuacyjnych
10 POMIAR JAKOŚCI DZIAŁALNOŚCI SZKÓŁ OGÓLNOKSZTAŁCĄCYCHid 10691 ppt
ĆW 10 Pomiary i rekonstrukcja obrazów
Procesy obliczenia do 10 pomiaru1, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu ch
10 Pomiar stratności aparatem Epsteina
Ek w 10, Pomiar dochodu narodowego, 15maj11 [tryb zgodności]
ta hydra(2), 10 pomiar strumienia objętości
~$ĆW 10 Pomiary i rekonstrukcja obrazów
10 pomiar cisnieniaid 11009 Nieznany (2)
10 Pomiary kątoweid 11011 ppt
ćw 10 Pomiary techniczne rezystancji
10 POMIAR JAKOŚCI DZIAŁALNOŚCI SZKÓŁ OGÓLNOKSZTAŁCĄCYCHid 10691 ppt
10 Pomiar mikrotwardosci azotowanej warstwy powierzchniowej
więcej podobnych podstron