12.2. Procesy elektrochemiczne na granicach faz
12.2.1. Elektryczna warstwa podwójna
Na granicy pomiędzy dwiema fazami powstaje różnica potencjałów elektrycznych, wynikająca z nierównomiernego rozkładu ładunków elektrycznych, tworzących jakby okładki naładowanego kondenstora. Takie rozmieszczenie ładunków nosi nazwę elektrycznej warstwy podwójnej. Występowanie różnic potencjałów na granicach faz jest w przyrodzie zjawiskiem powszechnym, a ich wielkość odgrywa istotną rolę w tak różnorodnych procesach jak np. tarcie, przenikanie substancji przez błony komórkowe w żywych organizmach, powstawanie napięcia w ogniwach galwanicznych.
Elektryczna warstwa podwójna utworzona jest z elektronów (od strony metalu) i równoważących ich ładunek jonów (od strony elektrolitu) oraz z obojętnych polarnych cząsteczek zaadsorbowanych na granicy faz. W procesach elektrochemicznych nośniki ładunków elektrycznych (elektrony lub jony) muszą przechodzić z jednej fazy do drugiej przez podwójną warstwę elektryczną co związane jest z wykonaniem określonej pracy. Szybkość tych procesów jest więc uzależniona od budowy warstwy podwójnej i występującej w niej różnicy potencjałów.
12.2.2. Pojęcie elektrody i jej potencjał
W elektrochemii rozpatruje się głównie wpływ różnorodnych czynników na napięcie na granicy faz układu przewodnik elektronowy - elektrolit. Układ taki nosi nazwę elektrody lub półogniwa, a wartość napięcia - potencjału elektrody. Określenie "elektroda" bywa również stosowane do samego przewodnika elektronowego, jednak dalej stosowane będzie jako synonim półogniwa. Ogniwo galwaniczne jest to zatem połączenie dwóch elektrod przez jonowy kontakt ich elektrolitów.
Wiele metali po zanurzeniu do elektrolitu wykazuje tendencję do przechodzenia do roztworu w postaci jonów dodatnich pozostawiając elektrony w metalu, co można zapisać:
![]()
natomiast jony tego metalu po zbliżeniu do granicy faz mają tendencję do redukcji przez pobranie elektronów z metalu:
![]()
Szybkości tych dwóch procesów są początkowo różne. Jeśli przeważa wysyłanie jonów z metalu, to metal ładuje się ujemnie względem elektrolitu. Nadmiar ładunków ujemnych powoduje przyciąganie jonów dodatnich co spowalnia ich wysyłanie przez metal, a przyspiesza przechodzenie z roztworu do sieci krystalicznej metalu. W przeciwnym wypadku, gdy jony szybciej przechodzą z elektrolitu do metalu - metal ładuje się dodatnio względem elektrolitu odpychając jony dodatnie i stopniowo zmniejszając szybkość tego procesu a przyspieszejąc proces przeciwny. Następuje zatem hamowanie szybszego procesu i przyspieszanie wolniejszego aż do wyrównania szybkości obydwu procesów czyli uzyskania stanu równowagowego, w którym występuje stała różnica potencjałów między metalem i elektrolitem zwana potencjałem równowagowym elektrody. Trzeba jednak podkreślić, że nie można zmierzyć bezwzględnej wartości potencjału elektrody, gdyż przy pomiarze trzeba by jeden przewód woltomierza połączyć z metalem elektrody, a drugi zanurzyć do elektrolitu. Stanowił by on łącznie z elektrolitem drugą elektrodę, a więc pomiar obejmował by napięcia metal-elektrolit na dwóch elektrodach, a nie na jednej. Z tego powodu wprowadzono elektrodę wzorcową, której potencjał w każdej temperaturze umownie przyjęto za równy zero. Jest to standardowa (inaczej - normalna) elektroda wodorowa.
Standardowa elektroda wodorowa zbudowana jest następująco: drut lub blacha platynowa, pokryta bardzo rozdrobnioną platyną (tak zwaną czernią platynową), zanurzona jest do roztworu kwasu siarkowego o stężeniu 1 mol.dm-3 (aH+ 1) i omywana strumieniem wodoru pod ciśnieniem jednej atmosfery (101325 Pa).
Potencjał elektrody (względny) definiuje się zatem jako napięcie równowagowe ogniwa zbudowanego z badanej elektrody i standardowej elektrody wodorowej. Wartość potencjału elektrody określa wzór Nernsta:
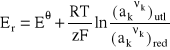
23
gdzie Er - równowagowy potencjał elektrody,
![]()
- standardowy potencjał elektrody mierzony w temperaturze 298 K,
gdy aktywności (patrz dalej) wszystkich reagujących substancji są
równe jedności,
R - stała gazowa,
T - temperatura,
z - liczba elektronów biorących udział w elementarnej reakcji elektro-
dowej (np. liczba elektronów pobieranych przez jeden jon metalu
przy jego redukcji do obojętnego atomu, równa ładunkowi jonu),
F - stała Faraday'a,
ak - aktywność składnika k, która dla czystych substancji stałych i ciek- łych jest równa jedności, w gazie - ciśnieniu parcjalnemu składnika k wyrażonemu w atmosferach, a w roztworze - w przybliżeniu rów- na molowemu stężeniu tego składnika. Dla rozcieńczonych roztwo-
rów wodnych aktywność wody przyjmuje się jako równą 1,
k - liczba stechiometryczna określająca liczbę jonów lub cząsteczek
k-tej substancji, biorących udział w elementarnej reakcji
elektrodowej;
indeksy "utl" i "red" oznaczają,że wyrażenie w nawiasie dotyczy wszystkich
składników biorących udział w reakcji elektrodowej po tej stronie, gdzie
występuje odpowiednio forma utleniona lub zredukowana składnika zmie-
niającego stopień utlenienia.
Wzór Nernsta przybiera znacznie prostszą postać, jeśli podstawić wartości liczbowe stałych oraz zależność między logarytmem naturalnym i dziesiętnym. Dla T = 298 K
![]()
Ponadto, w większości wypadków, zamiast iloczynów stężeń k składników występują stężenia pojedyńczych substancji. Dla elektrody, w której metal wymienia jony z roztworem zgodnie z reakcją:
![]()
wzór ten można zapisać:
![]()
24
Podany w nawiasie zapis ![]()
oznacza elektrodę zbudowaną z metalu Me i roztworu zawierającego jony ![]()
.
12.2.3. Podział elektrod
Elektrody można podzielić na:
- elektrody jonowymienne - gdy w procesie elektrodowym przez granicę faz przewodnik elektronowy-elektrolit przechodzą jony,
- elektrody redoks - gdy przez tę granicę faz przechodzą elektrony. Trzeba podkreślić, że elektrony po przejściu do elektrolitu natychmiast łączą się z substancjami ulegającymi redukcji.
Elektrody jonowymienne dzielą się na:
- elektrody pierwszego rodzaju, w których metal elektrody pozostaje w równowadze z jego jonami pochodzącymi ze zdysocjowanej soli tego metalu,
- elektrody drugiego rodzaju, w których metal jest pokryty trudno rozpuszczalną solą tego metalu w roztworze zawierającym dowolną sól o anionie wspólnym z solą trudno rozpuszczalną,
Wśród elektrod redoks szczególny rodzaj stanowią elektrody gazowe, w których przewodnik elektronowy zanurzony jest w nasyconym gazem roztworze zawierającym jony powstałe w wyniku redukcji lub utleniania tego gazu.
12.2.4. Ważniejsze rodzaje elektrod i ich zastosowanie
Z uwagi na szybkość ustalania się równowagi reakcji elektrodowej tylko nieliczne elektrody pierwszego rodzaju, takie jak np. srebrne, rtęciowe, miedziane, kadmowe czy cynkowe mogą służyć do pomiarów stężeń kationów pozostających w równowadze z metalem elektrody jako tzw. elektrody wskaźnikowe. Inne stosuje się jako roztwarzalne anody w procesach elektrolizy, a także jako katody w procesach oczyszczania metali. Potencjały standardowe niektórych elektrod jonowymiennych pierwszego rodzaju zestawiono poniżej:
Elektroda |
Li+/Li |
Ca2+/Ca |
Na+/Na |
Mg2+/Mg |
Al3+/Al |
Zn2+/Zn |
|
-3,00 |
-2,84 |
-2,71 |
-2,38 |
-1,66 |
-0,76 |
Elektroda |
Cr3+/Cr |
Fe2+/Fe |
Cd2+/Cd |
Ni2+/Ni |
Sn2+/Sn |
Pb2+/Pb |
|
-0,71 |
-0,44 |
-0,40 |
-0,24 |
-0,14 |
-0,13 |
Elektroda |
H+/H |
Cu2+/Cu |
Hg22+/Hg |
Ag+/Ag |
Pt2+/Pt |
Au3+/Au |
|
0,00 |
+0,34 |
+0,79 |
+0,80 |
+0,2 |
+1,42 |
Szereg metali ustawionych w kolejności wzrastających wartości potencjałów standardowych zbudowanych z nich elektrod tworzy szereg napięciowy metali. Każdy z metali, jak również umieszczony w tym szeregu wodór, może wypierać z roztworu metale, którym odpowiadają elektrody o bardziej dodatnich (mniej ujemnych) potencjałach standardowych.
Elektrody drugiego rodzaju mogą służyć do pomiaru stężeń różnych anionów, najczęściej jednak - przy odpowiedniej konstrukcji - stosowane są jako elektrody porównawcze o stałym potencjale. Najważniejsze z nich to elektroda chlorosrebrowa i elektroda kalomelowa.
Elektroda chlorosrebrowa składa się z drutu lub blaszki srebrnej pokrytej warstwą trudno rozpuszczalnego chlorku srebra i roztworu zawierającego jony chlorkowe. Jeżeli elektroda ta ma służyć jako elektroda porównawcza, wówczas konstrukcja elektrody musi zapewnić stałe stężenie jonów chlorkowych. Reakcje przebiegające w takiej elektrodzie przedstawiają się następująco:
AgCl(s) Ag+ + Cl-
Ag+ + e- Ag
AgCl(s) e- Ag + Cl-
Indeks "(s)" przy wzorze AgCl oznacza, że jest to substancja stała.
Potencjał elektrody chlorosrebrowej można obliczyć ze wzoru Nernsta:
![]()
25
w którym ![]()
.
Elektroda kalomelowa składa się z rtęci pokrytej trudno rozpuszczalnym kalomelem to jest chlorkiem dirtęci(II) (chlorkiem rtęciawym) oraz roztworu chlorku potasu. Reakcje w tej elektrodzie przebiegają podobnie jak w poprzedniej:
Hg2Cl2(s) Hg22+ + 2Cl-
_ Hg22+ + 2e- 2Hg
Hg2Cl2(s) + 2e- 2Hg + 2Cl-
Wzór na potencjał równowagowy tej elektrody jest następujący:
![]()
26
w którym ![]()
.
Elektrodę tę najczęściej stosuje się jeko elektrodę porównawczą, zawierającą nasycony roztwór KCl. Wówczas jej potencjał równowagowy w 298 K wynosi 0,2415V.
Elektrody redoks składają się zwykle z blaszki lub drutu platynowego i roztworu zawierającego jakiś pierwiastek na dwóch stopniach utlenienia, np. jony żelaza(II) i jony żelaza(III). Drut platynowy (lub z innego metalu szlachetnego) odgrywa rolę pojemnika, z którego mogą być pobierane elektrony (w podanym przykładzie przez jony Fe(III)) lub oddawane (przez jony Fe(II)). Potencjały takich elektrod, zwane potencjałami redoks (redukcyjno-utleniający) w stałej temperaturze zależą tylko od składu roztworu i służą do określenia zdolności redukcyjnych lub utleniających danego roztworu. Potencjał elektrody redoks dla przykładowo podanej elektrody wyrazi się wzorem:
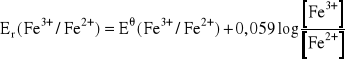
Wśród elektrod gazowych największe znaczenie ma elektroda wodorowa. Zbudowana jest z platyny omywanej strumieniem wodoru i roztworu wodnego, w którym zawsze znajdują się jony wodorowe. Na powierzchni platyny ustala się równowaga dla reakcji:
H+ + e- ![]()
H2(g)
Potencjał tej elektrody wyraża wzór:
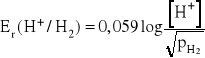
27
We wzorze na potencjał tej elektrody nie występuje potencjał standardowy, gdyż, jak podano uprzednio, jest on przyjęty za równy zeru. Jeśli wodór omywający platynę przepuszczany jest pod ciśnieniem atmosferycznym wówczas wzór przybiera jeszcze prostszą postać:
![]()
28
Wiele substancji uniemożliwia prawidłowe działanie elektrody wodorowej (np. silne utleniacze i reduktory, związki arsenu, ołowiu, kadmu). Ta przyczyna oraz trudności z otrzymaniem bardzo czystego wodoru powodują ograniczenie jej szerszego zastosowania. Używana bywa do badań naukowych w wypadku niektórych pomiarów pH, szczególnie w roztworach silnie zasadowych, oraz do dokładnego cechowania innych elektrod.
Potencjały wielu rodzajów elektrod również zależą od stężenia jonów wodorowych. Powszechne zastosowanie do pomiarów pH jako elektroda wskaźnikowa znalazła elektroda szklana. Najważniejszą częścią elektrody szklanej jest bardzo cienka membrana, najczęściej w kształcie bańki, wykonana ze specjalnego gatunku szkła, przytopiona do grubszej rurki. W bańce znajduje się roztwór o stałym składzie i elektroda porównawcza - zwykle chlorosrebrowa. Na każdej stronie membrany szklanej powstaje potencjał liniowo zależny od pH roztworu kontaktującego z jej powierzchnią. Wewnętrzna część membrany oraz elektroda porównawcza mają stałe potencjały, natomiast zewnętrzna powierzchnia membrany uzyskuje potencjał zależny od pH badanego roztworu. Potencjał elektrody szklanej rozpatrywany jako różnica potencjałów pomiędzy metalem wewnętrznej elektrody porównawczej i roztworem na zewnątrz bańki szklanej wyraża się wzorem:
![]()
29
![]()
oznacza tu potencjał elektrody szklanej w roztworze o pH = 0.
Zależność potencjałów różnych typów elektrod od stężeń składników roztworu znalazła szerokie zastosowanie w chemii analitycznej. Oznaczanie stężeń lub zawartości substancji w roztworze w oparciu o te zależności nosi nazwę analizy potencjometrycznej.
12.2.5. Pehametria
Pehametria jest to zespół metod pomiaru wartości pH. W praktyce pH oznacza się albo metodami kolorymetrycznymi, albo potencjometrycznymi.
W metodach kolorymetrycznych stosuje się wskaźniki, które zmieniają barwę ze zmianą pH w zakresie około dwóch jednostek pH. Są to słabe, organiczne kwasy lub zasady, w których forma zdysocjowana ma inne zabarwienie od niezdysocjowanej. Zależnie od rodzaju wskaźnika zakres zmian barwy leży w różnych miejscach skali pH. Wskaźniki używa się albo w formie roztworu albo papierków wskaźnikowych, to jest nasyconych wskaźnikiem pasków bibuły, które zwilża się badanym roztworem i porównuje ze skalą barwną dołączaną do opakowania papierków. Niekiedy stosuje się mieszaniny wskaźników dla rozszerzenia zakresu pomiarowego. Dokładność takich pomiarów jest rzędu 0,2 jednostki pH.
W metodach potencjometrycznych wartość pH określa się najczęściej przy użyciu ogniwa składającego się z elektrod szklanej (wskaźnikowej) i kalomelowej (porównawczej). Pomiaru dokonuje się przy użyciu czułych miliwoltomierzy ze skalą w jednostkach pH, zwanych pehametrami. Przed pomiarem pehametr należy wycechować przy użyciu roztworu buforowego o dokładnie znanej wartości pH. Dokładność uzyskanych wyników może sięgać nawet 0,01 jednostki pH .
Pomiary pH służą do określania odczynu roztworu, do oznaczeń zawartości (lub stężenia) kwasów, zasad i niektórych soli w procesie miareczkowania pehametrycznego oraz do wyznaczania stałych dysocjacji słabych kwasów i zasad.
12.2.6. Procesy elektrodowe
Wysyłanie jonów dodatnich przez metal elektrody do roztworu lub przyjmownie elektronów od jonów lub cząsteczek znajdujących się w roztworze jest procesem anodowym. Proces przeciwny - przyjmowanie jonów dodatnich przez metal elektrody lub przechodzenie elektronów z metalu elektrody do składników roztworu jest procesem katodowym. Zatem anoda jest to elektroda, na której zachodzi proces utleniania, a katoda to elektroda, na której zachodzi ten proces redukcji.
W stanie równowagi elektroda nie jest ani anodą ani katodą, obydwa wspomnianie procesy zachodzą z jednakowymi prędkościami, a bezwzględna wartość natężenia prądu katodowego jest równa wartości prądu anodowego. Wartość ta nosi nazwę prądu wymiany Io.
Io Ia,r -Ik,r 30
gdzie: Ia,r - prąd anodowy w stanie równowagowym,
Ik,r - prąd katodowy w stanie równowagowym.
Stosunek natężenia prądu wymiany do powierzchni elektrody - gęstość prądu wymiany jo - decyduje o szybkości ustalania się równowagi, której odpowiada równowagowy potencjał elektrody Er. Gęstości prądów wymiany dla różnych procesów elektrodowych mogą różnić się o wiele rzędów wielkości. Np. dla elektrody rtęciowej Hg22+/Hg jo = 1,5.104 A.m-2, a dla elektrody żelaznej Fe2+/Fe - jo < 10-4A.m-2. Elektrody, dla których prądy wymiany są bardzo małe, na ogół nie uzyskują stanu równowagowego, gdyż prądy wynikające z elektrochemicznych reakcji przypadkowych, śladowych zanieczyszczeń mogą być znacznie większe.
Prądu wymiany nie można bezpośrednio zmierzyć, gdyż w stanie równowagi nie zachodzi żaden proces wypadkowy (procesy anodowy i katodowy równoważą się), a natężenie prądu w obwodzie zewnętrznym jest równe zeru. Istnieją jednak metody pośredniego wyznaczania tej wielkości.
Jeśli potencjał elektrody jest różny od potencjału równowagowego, wówczas szybkości procesów anodowego i katodowego przestają być równe, na elektrodzie zachodzi wypadkowy proces utleniania lub redukcji, a przez elektrodę przepływa wypadkowy prąd o gęstości j.
Rys. 5. Zależność gęstości prądów anodowego j+ , katodowego j- i całkowitego j od nadpotencjału .
|
Różnica pomiędzy potencjałem elektrody (przy którym płynie prąd wypadkowy) a jej potencjałem równowagowym nazywa się nadpotencjałem (nadnapięciem) i oznacza literą . = Ej - Er 31 gdzie Ej - potencjał elektrody, gdy płynie przez nią prąd o gęstości j. Zależność pomiędzy gęstościami prądów składowych j+ i j- oraz prądem całkowitym j przedstawia rys.5. W wypadku niezbyt wielkich nadpotencjałów zależność od j umuje wzór Tafela:
We wzorze tym a = -b log jo, zaś
( jest to tak zwany współczynnik przejścia chrakterystyczny dla reakcji elektrodowej;
0 1, zwykle |
Na zakończenie tych rozważań trzeba zaznaczyć, że w wielu wypadkach na elektrodzie nie może dojść do stanu równowagi z tego powodu, że reakcje katodowa i anodowa nie tylko różnią się kierunkiem, lecz biorą w nich udział różne substancje.Na powierzchni elektrody powstają przestrzenie anodowa oraz katodowa i elektroda przekształca się w krótko zwarte ogniwo.
12.2.7. Ogniwa galwaniczne
Definicja ogniwa galwanicznego podana w rozdziale 3.2., jako układu składającego się z dwóch elektrod, których elektrolity mają elektryczny kontakt jonowy, oparta jest na konstrukcji ogniwa i nie zawiera ograniczeń dotyczących procesów w nim zachodzących.
Jeśli obydwie elektrody ogniwa są w stanie równowagi, wówczas napięcie ogniwa (napięcie pomiędzy metalicznymi wyprowadzeniami elektrod) nazywa się siłą elektromotoryczną ogniwa, w skrócie SEM. Pomiędzy elektrodami nie płynie prąd elektryczny. Obwód zewnętrzny jest otwarty. Naruszenie stanu równowagi może nastąpić przez zmianę napięcia ogniwa.
Zamknięcie obwodu zewnętrznego ogniwa przez dowolny opór elektryczny (równoznaczne z połączeniem przewodnikiem elektronowym metali elektrod) spowoduje przepływ elektronów w tym obwodzie od ujemnego bieguna ogniwa do dodatniego i częściowe wyrównanie potencjałów elektrod, a zatem obniżenie napięcia ogniwa. Nastąpi zatem naruszenie równowagi na obydwóch elektrodach i rozpoczęcie reakcji chemicznej biegnącej w kierunku odtworzenia stanu równowagowego. W procesie tym, zwanym pracą ogniwa galwanicznego, energia chemiczna substancji samorzutnie reagujących w ogniwie zamienia się w energię elektryczną oddawaną w obwodzie zewnętrznym (np. przez kolejną zamianę energii elektrycznej w mechaniczną lub cieplną).
Zwiększenie napięcia ogniwa powyżej jego SEM przez odpowiednie połączenie z zewnętrznym źródłem napięcia (np. baterią ogniw) również spowoduje naruszenie równowagi na elektrodach z tą różnicą, że proces chemiczny będzie wymuszony przyłożonym napięciem, reakcja chemiczna będzie przebiegać w ogniwie w przeciwnym niż poprzednio kierunku, a energia elektryczna dostarczana do ogniwa z zewnątrz będzie zamieniana na energię chemiczną produktów reakcji. Proces taki nosi nazwę elektrolizy.
Pojęcie ogniwa zwykle kojarzy się z urządzeniami, które mogą dostarczać energię elektryczną kosztem przemian chemicznych (lub różnicy stężeń), natomiast urządzenia służące do procesów elektrolizy noszą nazwę elektrolizerów. Należy jednak pamiętać, że np. akumulator czyli ogniwo odwracalne (w procesie elektrolizy przebiegają te same reakcje chemiczne co w czasie pracy ogniwa, lecz w przeciwnym kierunku) nie przestaje być ogniwem bez względu na to czy dostarcza energię elektryczną, czy stoi nieużywany, czy wreszcie jest ładowany w procesie elektrolizy.
Ogniwa galwaniczne przetwarzające energię chemiczną na elektryczną można podzielić na:
- ogniwa wzorcowe, których SEM służy jako wzorzec napięcia,
- ogniwa pomiarowe, służące do pomiaru stężeń składników roztworu,
- ogniwa służące do produkcji energii elektrycznej.
Z uwagi na rodzaj stosowanych elektrod i rodzaj reakcji chemicznych, które na nich zachodzą można ogniwa podzielić na ogniwa stężeniowe i ogniwa chemiczne. W ogniwie stężeniowym obydwie elektrody mają ten sam skład jakościowy, lecz różnią się np. stężeniem elektrolitu. W czasie pracy ogniwa na obydwu elektrodach zachodzą te same reakcje chemiczne, lecz w przeciwnych kierunkach. Praca elektryczna powstaje wówczas w wyniku wyrównywania się stężeń elektrolitu, a nie energii chemicznej substratów. W ogniwie chemicznym na elektrodach zachodzą różne reakcje chemiczne, a praca elektryczna powstaje w wyniku reakcji chemicznej.
W dalszym ciągu zostaną omówione jedynie chemiczne ogniwa pomiarowe.
Ogniwa pomiarowe składają się na ogół z elektrody wskaźnikowej o potencjale zależnym od stężenia określonego składnika roztworu i elektrody porównawczej o stałym potencjale. Dla zachowania stałości potencjału elektrody porównawczej łączy się ją z roztworem elektrody wskaźnikowej (badanym) w sposób uniemożliwiający swobodne mieszanie się elektrolitów. Stosuje się w tym celu albo włos azbestowy, składający się z mikroskopijnych rurek, wtopiony w rurkę szklaną (w większości elektrod kalomelowych), albo membranę z porowatego szkła, albo też klucz elektrolityczny. Ten ostatni wykonany jest zwykle z rurki szklanej w kształcie litery U wypełnionej stężonym roztworem soli o bardzo zbliżonych ruchliwościach kationów i anionów (na ogół KCl) z dodatkiem agar-agaru - obojętnego koloidalnego żelu uniemożliwiającego wypływanie elektrolitu.
Pomiary napięcia ogniw pomiarowych przeprowadza się w warunkach niewiele odbiegających od stanu równowagi, stąd konieczność stosowania czułych, wysokooporowych miliwoltomierzy.
Ogniwa pomiarowe znalazły szerokie zastosowanie nie tylko w laboratoriach analitycznych lecz także w innych dziedzinach, np. do oznaczania pH w przemyśle lub do sygnalizacji zmniejszonej zawartości tlenu w kopalniach.
Wyszukiwarka
Podobne podstrony:
elektrochemia-skrypt, 1907KOND
elektrochemia-skrypt, 1905PH
drążenie elektroerozyjne skrypt 2008
elektrochemia-skrypt, 02BHP
Maszyny Elektryczne Skrypt Polit Krakowska
Maszyny elektryczne skrypt
elektrochemia-skrypt, Tabelki- Laboratorium Elektrochemii, LABORATORIUM ELEKTROCHEMII
elektryczna, Skrypty, UR - materiały ze studiów, IV semestr, inżynieria
elektrochemia-skrypt, cw-KOROZJA, KOROZJA
elektrochemia-skrypt, 1918CYNK
ELEKTROFOREZA skrypt id 158052 Nieznany
elektrochemia-skrypt, 12CYNK33
Labolatorium aparatów elektrycznych skrypt
więcej podobnych podstron