56822

Reakcje drugiego rzędu:
Ola takich reakcji wzór na ich szybkość może mieć różne postać matematyczne, w zaieznośo od typu reakcji. Ody w reakcji występuję tylko jeden substrat A. to szybkość jest proporcjonalna do kwadratu jego stezema:
U - kj C»'
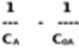
oraz: 1
k, m —
t
a także:
1
kr C*.
Przykładom takie) reakc)l może być rozkład jodomodoru.
Ody w reakcji btore idzial dwa substraty A ♦ 8. ta
v - ki e* - c.
i w tym przypadku:
2,303 C«.(C..-y)
» (C« - C„ (C« - y)
gdzie y. ubytek stężenia substratu A równy ubytkowi stężenia substratu B.
Przykładem takich reakcji se np. termiczny rozkład NO„ reakcje di mery zac ji, hydroliza estrów w środowisku zasadowym.
Reakcję trzeciego rzędu
na przykład:
A ♦ B *C -ś prodikty
t> • k, • «»• Ca - Cc
k, ma prostę postać w przypadku A ■ B ■ C
1 (C.*- C»)
t 2 • C.* • C*
C« - stężenie poczętkowe każdego z trzech substratów C - stężenie po czasie t.
3
2 -k, - C.*
Przykładem jest: 2NO ♦ Cl, -» 2NOCI
2NO łH,4 NX> -ł- HA)
Dla reakcji: 2A ♦ B -» produkty
V ■ k, • Ca1- Ca
lub: 3A -» prodikty
t> - ki • c»*
We wszystkich dokładnych rozważaniach kinetycznych w miejsce stęzeó w powyższych równaniach należy wprowadzić aktywności. Reakcje zerowego rzędu
W takich reakcjach szybkość mę zalezy od stężenia substratu (substratów), lecz od innych czynnłów. jak np dyfuzii substratów i produktów w niektórych reakcjach katalitycznych czy od natężenia promieniowana w reakcjach fotochemicznych, oraz
t> - k. C. - C
t
a także
C.
tu ■ —-
Ik.
Przykładem sę tu reakcje enzymatyczne I katalityczne oraz fotochomkzne.
REAKCJE ZŁOŻONE:
Reakcje odwracalne:
Wyszukiwarka
Podobne podstrony:
Photo 0229 l<( ■, ik<)(•i nuta zystne są ze sobą sprzężone. Reakcja: A+B< *C+D Wzór na zmia
Schemat zastępczy przetwornika drugiego rzędu typu RC, RC podano na rysunku 6.19. R 2 c c2-r-
Lewar4 122 Zatem wzór na średnią prędkość przepływu w lewarze ma postać 122 a wydatek lewara może by
DSC00043 (30) 5 PAŃSTWO W GOSPODARCE RYNKOWE! 5. Wyjaśnij, jaki wptyw na usługi bu
Klasyfikacja znaków na opakowaniach Znak może być wyrażony w postaci: 1. napisu (wyrazy, skróty,
CCF20081206�037 głownie na to. czy dziecko jest sympatyczne w klasie oraz na to. jakie może mieć ewe
Zarz Ryz Finans R09(8 288 Zarządzanie ryzykiem finansowym ca zabezpieczenie oparte na kontraktach fu
strokeStyle = kolor - ustawia kolor odrysowania na zadany, kolor może być podany w postaci szesnastk
Brak obrazu badanego przebiegu lub plamki na ekranie oscyloskopu może mieć następujące przyczyny: a)
Brak obrazu badanego przebiegu lub plamki na ekranie oscyloskopu może mieć następujące przyczyny: a)
img198 (5) iywej kukiełki. Kot przedstawiony na rys. 129 może mieć łepek wytoczony z lekkiego drewna
Skutki narażenia na szkodliwe substancje chemiczne mogą być miejscowe i układowe, a ich nasilenie mo
Drzewo 5 (korona promienista, muszą być gałęzie, które rozchodzą się na zewnątrz, korona może mieć s
więcej podobnych podstron