87202

Wartość współczynnika podziału nie zależy od aktywności substancji rozpuszczonej, jest natomiast cechą charakterystyczną dla danego układu trójskładnikowego zależną od temperatury i ciśnienia. Ten ostatni parametr odgrywa dużą rolę jedynie w przypadku, gdy substancją rozpuszczoną jest gaz.
Substancja rozpuszczona, w zależności od swych właściwości, w obu fazach może ulegać przemianom np. dysocjacji elektrolitycznej w rozpuszczalnikach polarnych lub asocjacji w rozpuszczaliukach organicznych. W układzie woda - kwas benzoesowy - toluen CftHjCOOH ulega podziałowi między dwie fazy i dysocjuje i asocjuje zgodnie ze schematem przedstawionym na rys. 1.
|
C6H5COOH w H20 c |
* C6H$COOH w qh5ch3 |
|
H* + QHjCOO- |
(C6H5COOH)2 |
Rys. 1. Schemat równowag kwasu benzoesowego w dwóch nie rozpuszczających się w sobie rozpuszczalnikach
woda - toluen.
Zjawiska dysocjacji i asocjacji wpływają na wartość współczymiika podziału substancji rozpuszczonej i należy uwzględnić ich przebieg w układzie
Dysocjację elektrolityczną charakteryzuje stopień dysocjacji a i stała dysocjacji K*, które w przypadku słabych elektrolitówr związane są prawrem rozcieńczeń Oswralda. Prawo to brzmi:
W miarę rozcieńczania roztworu słabego elektrolitu jego stopień dysocjacji wzrasta odwrotnie proporcjonalnie do pierw iastka kwadratowego ze stężenia.
Treść prawa można wryprowradzić z zapisu na stalą dysocjacji: przyjmując, że w przypadku słabych elektrolitów mianownik ułamka zmierza do 1.
Asocjacja ma miejsce w mepolamych rozpuszczalnikach i określą ją stalą równowagi reakcji asocjacji zwana krótko stalą asocjacji. Asocjacja polega na tworzeniu cząstek zawierających dwie lub więcej cząsteczek związanych wiązaniami wodorowymi. Strukturę dimeru kwrasu benzoesowego podają poniższe wzory:
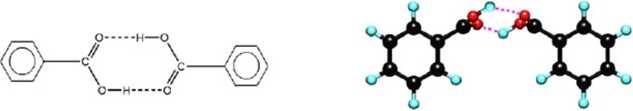
2
Wyszukiwarka
Podobne podstrony:
hpqscan0056 dy nie zależy od stężenia substancji barwnej; 374. Wartość absorbanc
Ciulem szarym jest ciało, którego zdolność absorpcyjna ma wartość stalą, tzn. nie zależy od długości
11407 skanuj0456 Dla kryształu złożonego z kilku rodzajów atomów liniowy współczynnik absorpcji nie
34 Wartość przedsiębiorstwa siębiorstwa i nie zależy od sposobu ich finansowania.51 Oczywiście wnios
12. Wartość współczynnika tarcia ślizgowego zależy od: 13. Na
Image225 (4) ■ Elektronika dla nieelektronik LED nie zależy od napięcia zasilania, co jest istotną z
Dysocjacja - znowu Poziom dysocjacji zależy od budowy substancji rozpuszczanej i rozpuszczalnika. Ca
Farm1935 ponieważ C= 1. Szybkość takiego procesu nie zależy od stężenia i jest wartością stałą, sam
hpqscan0045 295. Współczynnik załamania światła nie zależy od: a) &nbs
Wartość dwójlomności w krysztale dwójłomnym zależy od kierunku. Kierunek , dla którego zjawisko nie
Wartości współczynników aktywności substancji rozpuszczonej (kwasu stearynowego) w roztworach
Strona0092 92 Rys. 3.S Jak widać, kąt ę nie zależy od y ~ (ojcoQ, a jedynie przy a>-o)0 zmienia n
Paradoks hydrostatyczny STEVINA - parcie hydrostatyczne co do wartości nie zależy od naczynia ani od
więcej podobnych podstron