9402139837

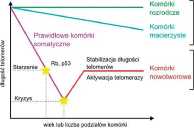
Rycina 3. Aktywność' telomerazy jest różna w różnych typach komórek. Przedstawiono zależność długości telomerów od liczby podziałów lub wieku komórek
~=—~=- « 3'
■m starter RNA 4h fragment Okazaki
i
=3 3'
pujo synteza brakującychlfragmentów DNA, jednak synteza na końcu 5' nie jest możliwa i dochodzi do skrócenia nici.
tury telomerów. Wykazano, że obniżenie poziomu TRF2, jak również rozproszenie białek telomerowych, do którego dochodzi np. na skutek przedłużonego zatrzymanie komórek w mitozie, powodują indukcję starzenia w komórce [9,10]. Za utrzymanie długich telomerów odpowiedzialny jest enzym telomeraza. Jest on odwrotną transkryptazą, czyli polimerazą DNA zależną od RNA. Składa się z pod-jednostki matrycowej RNA, zwanej TERC (ang. Telomerase RNA component), na podstawie której dochodzi do odbudowania sekwencji telomerowych, oraz podjednoslki białkowej o aktywności enzymatycznej, zwanej TERT (ang. Telomerase reoerse transcriptase). Jej aktywność w komórce powoduje wydłużanie skracających się z każdym podziałem telomerów, gdyż uzupełnia ubytki nici DNA powstające na skutek problemu końca replikacji. W komórkach somatycznych jej poziom sukcesywnie spada (Ryc. 3) [11]. Na stałym, wysokim poziomie aktywna telomeraza jest obecna w komórkach rozrodczych, a na wysokim o tendencji spadkowej w komórkach macierzystych. Jej podwyższony poziom wykrywany jest również w komórkach nowotworowych, ale nie koreluje to z długością telomerów, które w komórkach nowotworowych są krótkie z powodu ich intensywnej proliferacji. Uważa się, że podwyższenie poziomu telomerazy w komórkach nowotworowych stabilizuje chromosomy, co zapewnia dalsze podziały i unikanie wejścia na drogę starzenia w wyniku krytycznego skrócenia telomerów. Badania nad telomerami i telomerazą zostały docenione przez komitet noblowski i w 2009 roku trójka badaczy, Elizabeth H. Blackburn, Carol W. Greider oraz Jack W. Szostak, zostali uhonorowani nagrodą Nobla w dziedzinie fizjologii i medycyny.
Drugi rodzaj starzenia to starzenie przyspieszone, SIPS (ang. stress-induced premahire senescence) [12]. Jest ono niezależne od skracania telomerów. Może być indukowane stresem oksydacyjnym, onkogenami lub czynnikami uszkadzającymi DNA. Zachodzi ono w dużo krótszym czasie niż starzenie replikacyjne (w hodowli na ogół w ciągu kilku dni), zarówno in vitro jak i in vivo, i nie wynika z wyczerpania potenq'ału podziałowego, choć wykazano, że stres oksydacyjny może prowadzić do przyspieszonego skracania telomerów [13]. Ten rodzaj starzenia obserwowany jest zarówno w komórkach prawidłowych pod wpływem związków prowadzących do powstawania podwójnych pęknięć nid DNA [14], jak i w komórkach nowotworowych, jako efekt np. chemioterapii [15,16]. Starzenie przyspieszone jako efekt działania onkogenów, czyli OIS (ang. oncogene induced senescence), po raz pierwszy zostało opisane przez Manuela Serrano [17], który wykazał, że starzenie prawidłowych fibroblastów in vitro może być wynikiem ekspresji onkogenu Ras.
Mimo, że przyczyna obydwu typów starzenia jest inna, to tak naprawdę wiąże się z aktywacją tej samej ścieżki odpowiedzi na uszkodzenia DNA. W starzeniu replikacyjnym taki sygnał generują skrócone lub pozbawione szelteryn telomery, a w przyspieszonym pęknięcia podwójnej nici DNA. Do niedawna sądzono, że starzenie przyspieszone indukują silne uszkodzenia w DNA nie-telomerowym, ale w 2012 roku wykazano, że aby doszło do starzenia komórkowego uszkodzenia muszą być zlokalizowane w odcinkach telomerowych [18]. Pęknięcia nici DNA w odcinkach nietelomerowych są dość wydajnie naprawiane, a uszkodzenia nici tworzącej telomer, ze względu na specyficzną strukturę i białka chroniące, są niedostępne dla systemów naprawczych. Uszkodzenia nici DNA uruchamiają ścieżkę odpowiedzi na uszkodzenia, DDR (ang. DNA damagc response), której kluczowym białkiem jest p53, określane mianem strażnika genomu. Białko p53 indukuje p21WAFI /CIP1 (p21), które jest inhibitorem kinaz zależnych od cyklin i odpowiada za zatrzyma-
Aktywność
telomerazy
nia), macierzystych (niebieska lima) i nowotworowych (czerwona linia). Komórki nowotworowe pochodzące z prawidłowych komórek somatycznych przechodzą kryzys i stabilizują długość* swoich telomerów w wyniku aktywacji telomerazy. Na podstawie RU.
149
Postępy Biochemii 60 (2) 2014
Wyszukiwarka
Podobne podstrony:
Czy aktywność telomerazy jest obecna we wszystkich komórkach ssaków? NIE Dlatego nie, bo zmienia się
S6303325 W i oslinach typu C4 ol wiązania COz (C3 i C4) przebiegają w różnych typach komórek
Zdjęcie0617 Reakcja na hfpoksję jest różna w różnych narządach, przy czym najwrażliwsze na niedobór
DSCF4920 ZofnóTki* ctócd2*c*n* informację zawartość jest różna u różnych gat. i nie jest skorelowana
DSCN0450 (2) Sprawność rj wyraża się stosunkiem mocy użytecznej Nu do mocy całkowitej Nc i jest różn
gleby194 4.2.I.2. ZAWARTOŚĆ AZOTU W RÓŻNYCH TYPACH GLEB Zawartość azotu w poszczególnych typach gleb
Szereg tryboelektryczny Energia elektronów w różnych substancjach jest różna. Różnice te są
P2050811 3.2 Powierzchnia graniczna cząstek gruntowyc Intensywność zjawisk dla różnych gruntów jest
celowych. „Ja” jest różną strukturą różnych ról i tożsamości społecznych, przekonań na własny
0000023 (18) A B C E kvi. 13. Schemat zmian kostnych w zależności od lokalizacji w różnych typach dy
IMG013 Warunki efektywnego zarządzaniaPLANOWANIE PRZEDSIĘWZIĘCIA ♦ Jaki jest wpływ różnych scenarius
więcej podobnych podstron