6317101167
Zadanie 2
Zasada ekwipartycji energii głosi, że ciepło właściwe i molowe jest jednakowe na każdy stopień swobody. Ciepło molowe każdego gazu wynosi Cv = |r, jeśli nie wiesz, i, to liczba stopni swobody. Gaz jednoatomowy posiada trzy stopnie swobody, a dwuatomowy, pięć.
Hel jest gazem jednoatomowym o masie molowej pHe = 0,004 kg / mol. Argon jest gazem jednoatomowym, a jego masa molowa wynosi pAr = 0,040 kg / mol. Tlen jest gazem dwuatomowym, a jego masa molowa wynosi p02 = 0,032 kg / mol.
a. Udowodnij, że wartość stałej gazowej na podstawie danej z poniższej tabeli wynosi
b. Oblicz i uzupełnij do tabelę. Używaj wartości udowodnionej wcześniej.
|
ciepło właściwe cAWi] |
ciepło właściwe |
ciepło molowe |
ciepło molowe | |
|
hel |
3140 | |||
|
argon | ||||
|
tlen |
Zadanie 3
Gęstość wodoru w warunkach normalnych (przyjmij tG = 0°C, p0 = 105 Pa) wynosi p0 = 0,08987 kg/m3. Butlę o objętości V = 50 dm3 napełniono wodorem w temperaturze 20°C tak, że jego gęstość była 3 razy większa od p0.
a. Oblicz ile wynosiło ciśnienie w tej butli.
b. Ile moli wodoru znajdowało się w butli (masa molowa H2 wynosi 2 g/mol).
c. Do jakiej temperatury (w stopniach Celsjusza można ogrzać butlę, by nie było niebezpieczeństwa wybuchu, skoro ciśnienie maksymalne może w niej wynosić 5'105 Pa?
Zadanie 4
Wykres na następnej stronie przedstawia dwie przemiany w układzie p(V), zachodzące dla 64 moli tlenu 02 (masa molowa tlenu p = 32 g/mol). Ciepło molowe gazu dwuatomowego
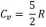
Gdzie R, to stała gazowa.
Włodzimierz Wolczyński -18-TERMODYNAMIKA. PODSUMOWANIE
Strona 2
Wyszukiwarka
Podobne podstrony:
Podstawowe zasady hydrodynamiki Zasada zachowania energii Zakładając, że przepływ cieczy
page0210 206 konali się oni, że ciepło właściwe pierwiastków stałych jest niemal odwrotnie proporcyo
Ek = mvl + mvl + mvl Zgodnie z zasadą ekwipartycji energii, średnia energia każdego z członów wynosi
I. 1. Kinetyczno-molekularna interpretacja temp. Zasada ekwipartycji energii. 2. Lepkość ujęcie makr
3 11 2012 PB (3) Zasada dowodu statecznego głosi, że to, wierzą Job jak zachowują się inni ludzie, c
4. Zasada Ekwipartycji Energii 3kT l średnia energia kinetyczna ruchu postępowego
4a, Zasada Ekwipartycji Energii, c.d« ■ może dochodzić energia ruchu drgającego ■
4b. Zasada Ekwipartycji Energii, c.d. adiabaty - € c = ■ różnica: C -Cr = R
23zasada ekwipartycji energii Zasada ekwipartycji energii Wynik(£
Zasada dowodu społecznego (Cialdinl) Zasada dowodu społecznego głosi, że to w co wierzą lub jak zach
P1070680 Przyjąć, że ciepło właściwe i ciepło parowania w danym przedziale temperatur jest stałe. Ro
5. Definicja pojemności cieplnych; zasada ekwipartycji energii; oszacować
P5101382 Zadanie 10 (2 punkty) yń
IMGd50 FIZY CZNE W SKAŹNIKI JAKOŚCI WODY Ciepło właściwe wody Ciepło właściwe wody jest to ilość cie
więcej podobnych podstron