4962383989
66 Wszechświat, t. 84, nr 3/1983
kapelusz kopytowaty, siedzący o wymiarach 4—11X 3—8X2—4,5 cm, jest więc znacznie mniejszy niż bardziej płaski kapelusz Inonotus dryadeus. Rośnie pojedynczo lub w dachówkowatych skupieniach. Wytwarza owocniki wysoko na pniach żywicielskich drzew, nie jest zatem według wszelkiego prawdopodobieństwa pasożytem korzeniowym. Powierzchnia kapelusza tego włóknouszka jest pokryta twardą, rdzawą, na koniec spękaną skórką, czym różni się zasadniczo od naszego włóknouszka płaczącego. Pory jego hymenoforu są nieregularne 2—4/mm. Niezwykle ważną cechą, która odróżnia oba te gatunki jest obecność u Inonotus chondromyelus ziarnistego rdzenia występującego u nasady wewnątrz miąższu owocni-ka. Podobny rdzeń — jak już było podkreślane — ma europejski włóknouszek dębowy. Są także różnice w wymiarach i kształcie zarodników i szczecinek hy-menialnych obu włóknouszków płaczących (ryc. 5). Właściwością wspólną dla obu grzybów jest oczywiście ich „płacz”, tzn. wydzielanie wodnistych kropelek na brzegu rosnącego kapelusza. Australijski włóknouszek płaczący nie był znajdywany oczywiście na dębach, które w Australii i na Nowej Zelandii nie rosną, tylko na pniach akacji Acacia aulacocarpa, A. dealbata, A. solidna var varians i eukaliptusów Eu-calyptus macrorrhyncha, E. obliąua, E. regnans, E. sa-ligna, E. viminalis.
GRZEGORZ BARTOSZ (Łódź)
„SŁODKIE” HEMOGLOBINY
Lektura podręcznika biochemii może sprawić wrażenie, że reakcje chemiczne w żywym organizmie zachodzą wyłącznie w sposób ściśle kontrolowany i że mają charakter wyłącznie teleonomiczny. Wrażenie takie byłoby jednak złudne. Komórka żywa czy płyn pozakomórkowy (np. osocze krwi) są złożonymi układami zawierającymi wiele różnych związków chemicznych, podlegających „zwykłym” prawom kinetyki chemicznej, wchodzących ze sobą w reakcje niekontrolowane i nie zawsze pożyteczne dla organizmu. Układy enzymatyczne przyspieszają reakcje pożądane i w ten sposób ukierunkowują ciągi reakcji, których tłem pozostają jednak niezmiennie niezliczone akty elementarnych reakcji pomiędzy najróżniejszymi cząsteczkami, które zderzają się ze sobą i mogą ze sobą reagować. Ewolucja wyselekcjonowała organizmy o takiim składzie i tak sprawnym metabolizmie, by to niespecyficzne „tło chemiczne” było stosunkowo mało znaczące w ogólnej puli reakcji metabolicznych, nie mogła jdnak wyeliminować go całkowicie.
Ostatnie lata przyniosły szereg ciekawych danych dotyczących tego zagadnienia, istotnych m. in. z punktu widzenia patologii i gerontologii. Zaczęło się od
Hemoglobina ^2 ( a2^2^
F (oc2y2)
A ( cC2^2)
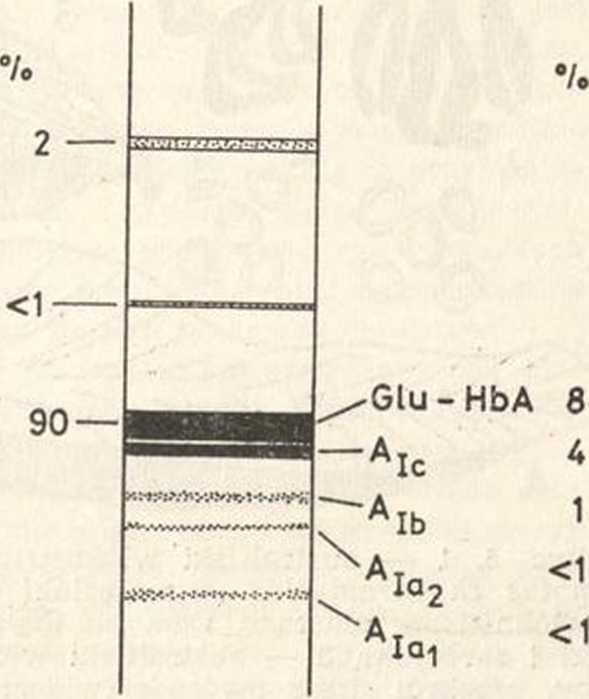
Schemat rozdziału elektroforetycznego hemoglobiny zdrowego dorosłego człowieka
hemoglobin. Wiadomo było już od dawna, że hemoglobina występująca w erytrocytach normalnych dorosłych ludzi jest niejednorodna (por. Wszechświat nr 6, 1981). Rozdział elektroforetyczny hemoglobiny wykazuje obecność głównej frakcji, jaką jest hem<?-globina (Hb) A (ok. 90% całości Hb). Jej tetrametrycz-ne cząsteczki złożone są z dwu łańcuchów a i dwu łańcuchów fi {.ctifid. Oprócz HbA występują śladowe (u osób dorosłych) ilości hemoglobiny płodowej (F) (a2yó i ok. 2% hemoglobiny At (ctgdg), także różniącej się sekwencją aminokwasów w jednej z par łańcuchów polipeptydowych (rys. 1). Poza tymi frakcjami występują także w niewielkich ilościach hemoglobiny „szybkie”, o dużej ruchliwości elektroforetycz-nej, wędrujące w polu elektrycznym szybciej niż HbA. Badania tych frakcji wykazały, że w przeciwieństwie do wyżej wymienionych nie są one kodowane przez oddzielne geny, ale powstają w wyniku reakcji hemoglobiny z metabolitami występującymi w krwinkach czerwonych.
Najwięcej uwagi poświęcono frakcji oznaczanej jako HbA1Ct której zawartość stanowi ok. 4% całej zawartości hemoglobiny. Tworzy się ona w wyniku przyłączenia glukozy do jednej z wolnych grup aminowych na N-końcach łańcuchów fi cząsteczki HbA. HbAial powstaje w efekcie przyłączenia difosforanu bliżej niezidentyfikowanego cukru do N-końcowej grupy aminowej łańcucha fi, a HbAia2 w wyniku reakcji HbA z glukozo-6-fosforanem. Czasem w żargonie laboratoryjnym nazywa się żartobliwie te hemoglobiny „słodkimi” — ze względu na obecność w ich cząsteczkach reszt glukozy czy innego cukrU. Glukoza może także przyłączać się do N-końctpwych grup aminowych łańcuchów a HbA lub do e-aminowych grup reszt Lizynowych w łańcuchach polipeptydowych HbA, jednak powstające w wyniku tych reakcji cząsteczki nfe różnią się ruchliwośoią elektroforetyczną od HbA. Frakcja HbA otrzymywana w wyniku rozdziału elektroforetycznego zawiera jeszcze ok. 8% cząsteczek, które przyłączyły 1 lub więcej reszt glukozowych w pozycjach innych niż N-końcowe grupy aminowe łańcuchów fi.
Stwierdzono, że reakcja pomiędzy glukozą a hemoglobiną zachodzi bez udziału żadnego enzymu. Począ-
Wyszukiwarka
Podobne podstrony:
62 Wszechświat, t. 84, nr 3/1983 ność rozwoju w ekskrementach tych zwierząt grzybów z rodzaju BacilL
64 Wszechświat, t. 84, nr 3/1983 Ryc. 3. Krople cieczy spływają wolno z rosnącego brzegu włóknouszka
74 Wszechświat, t. 84, nr 3/1983 56 dni), a trzymane z dużą grupą (osiem na dzień) — żyły średnio ty
76 Wszechświat, (. 84, nr 3/1983 formacje dotyczące biotopów słodkowodnych różnych regionów świata:
Wszechświat, t. 84, nr 311983 73 rzeni w ziemi, po dokładnem jednak uschnięciu łodygi, dosyć jest
Wszechświat, t. 84, nr 311983 63 Ryc. 1. Kapelusze włóknouszka płaczącego Inonotus dryadeus wyrastaj
60 Wszechświat, t. 84, nr 311083 Tabela 1. Udział fauny glebowej i słodkowocfnej w zalewanych glebac
Wszechświat, t. 84, nr 311983 65 Ryc. 4. Owocnik włóknouszka płaczącego wyrosły między korzeniami dę
Wszechświat, t. 84, nr 311983 67 ■tkowo tworzy się połączenie typu zasady Schiffa między grupą
68 Wszechświat, t. 84, nr 311988 troskę o potomstwo, stąd ich płodność osobnicza jest stosunkowo nie
Wszechświat, t. 84, nr 311983 69PRZEGLĄD NAUK NEUROBIOLOG1CZN YCHPlastyczność neuronalna, uczenie si
70 Wszechświat, t. 84, nr 311983 otwieranych i zamykanych maksymalnie pod wpływem potencjału błonowe
Wszechświat, t. 84, nr 311983 71 dominujących samców może stać się ojcami całego następnego
72 Wszechświat, t. 84, nr 311983 plemnienie wewnętrzne, po wielokrotnych kopulacjach zaobserwowano u
Wszechświat, t. 84, nr 311983 75 w sposób następujący. Książka zawiera podstawowe założenia fenologi
54 Wszechświat, t. 84, nr 3J1983 rodowy (Dz. U. z 8 V 1957, mir 24, poz. 114). Dyrektorem Parku zost
Wszechświat, t. 84, nr 311983 55 dujący się niedaleko stacji Osowa Góra, został poświęcony prof. Ada
56 Wszechświat, t. 84, nr 311983 Parku ma sięgać od zalewu rzeki Głuszy nki koło Głuszyny i rynny
Wszechświat, t. 84, nr 311983 57 wniosek, że jeżeli dalej pozwoli się na takie dewastowanie naturaln
więcej podobnych podstron