8009766948
Kinaza polinukleotydowa bakteriofaga T4 (T4 PNK) katalizuje przeniesienie y-fosforanu z ATP (Ryc. 4.3) na (patrz struktura nukleotydu po defosforylacji) koniec 5’ OH jedno- lub dwu-niciowego DNA, RNA lub oligonukleotydów.

ATP
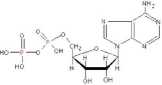
ADP
Ryc. 2.3 Struktura ATP (ang. adenosine triphosphate) i ADP (ang. adenosine diphosphate).
Aktywność T4 PNK wykorzystywana jest głównie w dwóch typach reakcji: reakcji podstawienia (ang. forward reactioń) i reakcji wymiany (ang. exchange reactioń) (Ryc. 2.4). W reakcji podstawienia y-fosforan przenoszony jest z ATP na DNA/RNA. Docelowy nukleotyd nie posiada reszty fosforanowej na końcu 5’ (została ona usunięta w reakcji defosforylacji lub w takiej postaci została zsyntetyzowana chemicznie). Reakcja ta jest odwracalna. W reakcji wymiany, nadmiar ADP powoduje, że T4 PNK najpierw przenosi 5’-fosforan z ufosforylowanego DNA, a następnie DNA jest ponownie fosforylowany przez przeniesienie y-fosforanu z ATP (np. [y-32P]ATP). W reakcji katalizowanej przez T4 PNK stężenie ATP powinno wynosić >lpM (reakcja podstawienia) lub >2pM (reakcja wymiany). Ponadto enzym posiada aktywność 3’ fosfatazy.
reakcja wymiany
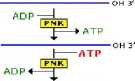
reakcja podstawienia
5' HO-OH 3'
ATP ——|
ICHBłSJ
I-► ADP
5’ O-OH 3'
Ryc. 2.4 Aktywność enzymatyczna T4 PNK.
Oczyszczenie kinazy polinukleotydowej bakteriofaga T4 z zainfekowanych komórek gospodarza jest niewydajne i trudne, dlatego też źródłem T4 PNK są komórki Escherichia coli z wklonowanym genem pseT bakteriofaga T4. T4 PNK jest homotetramerem zbudowanym z podjednostek o masie 28,9 kDa każda.
T4 PNK jest głównie wykorzystywana do:
- radioaktywnego znakowania na końcu 5’ kwasów nukleinowych (reakcja podstawienia lub wymiany), które następnie wykorzystywane są: (i) jako sonda hybrydyzacji; (ii) do mapowania transkryptu; (iii) jako markery do elektroforezy żelowej; (iv) jako startery w reakcji sekwencjonowania DNA; (v) jako startery do reakcji PCR lub w innych metodach wymagających terminalnie wyznakowanego DNA.
- 5-fosforylacji oligonukleotydowych łączników i DNA/RNA przed ligacją.
18
Wyszukiwarka
Podobne podstrony:
DSC00712 ATP jest aktywowanym przenośnikiem grup fosforanowych, ponieważ przeniesienie fosforanu z A
IMG759 Adsorpcja bakteriofaga T4 do błony zewnętrznej komórki
2. Określenie miana bakteriofaga T4 metodą płytek dwuwarstwowych. a) każda podgrup
str43 CW Komorka i proste formy zycia pcx Schemat do zadań 6 i 7 Proces namnażania się bakteriofaga
str43a CW Komorka i proste formy zycia pcx Schemat do zadań 6 i 7Proces namnażania się bakteriofaga
0000021 2 W podanym schemacie enzym I. czyli dehydrogenaza fosfogliceral-dehydowa, katalizuje przeni
02 (52) 2. Transferazy Klasa ta obejmuje enzymy katalizujące przeniesienie grup pomiędzy posaczegoto
- reakcje kaskadowe, - kataliza przeniesienia międzyfazowego, -
PRZEMIANY AMINKOWASÓW: 1. TRAN SAMI NACJA: przeniesienie gr.NH2z aminokw. na odpow 2-oskokwas katali
56240 IMGP4665 Procesatmosferycznego Proces wiązania azotu kontrolują bakteryjne geny *if ftx. Katal
35051 T4 (14) wismomoiiM kwalifikacyjnaPodkomi^do^r^acowam EGZAMiN NA UPRAWNIENIA ZAWODOWERZECZOZNAW
więcej podobnych podstron