2009-11-24
1
Chemia
Budowa atomu
Postulaty teorii Daltona
John Dalton,
angielski uczony, opracował w 1804r. tezę
atomistyczno -
cząsteczkową budowy materii. We współczesnej
formie jest ona aktualna do dzisiaj.
• Pierwiastek chemiczny złożony jest z bardzo małych cząstek, które
nazwano atomami.
•
• Wszystkie atomy danego pierwiastka wykazują identyczne
właściwości chemiczne.
•
• Atomy należące do różnych pierwiastków cechują się odrębnymi
własnościami fizycznymi oraz chemicznymi. W przyrodzie jest tyle
atomów ile pierwiastków.
•
• Atom określonego pierwiastka nie ulega przekształceniu w innego
rodzaju atom (który charakteryzuje inny pierwiastek) w wyniku
standardowej reakcji chemicznej.
•
2009-11-24
2
Postulaty teorii Daltona c.d.
• Tworzenie związków chemicznych przez pierwiastki jest związane z
łączeniem różnych atomów (należących do różnych pierwiastków) w
wyniku czego powstają cząsteczki.
•
• Związek chemiczny składa się cząsteczek. Cząsteczki, wchodzące
w skład związku chemicznego,
•
są identyczne pod względem budowy i właściwości.
•
• Rozkład związku chemicznego następuje w wyniku rozpadu
cząsteczek na atomy pierwiastków.
•
• Atomy należące do tego samego pierwiastka również mogą tworzyć
cząsteczki.
• Odkrycie elektronu
• Joseph Thomson w 1896r podczas
doświadczeń z życiem rozrzedzonych
gazów odkrył elektron. Jest to cząstka
elementarna, składowa atomu, oznaczana
symbolem e-
. Charakterystykę elektronu
zestawiono poniższej
• Masa 0,00055u - 9,11 x 10
-31
kg
• Ładunek 1,6 x 10
-19
C
2009-11-24
3
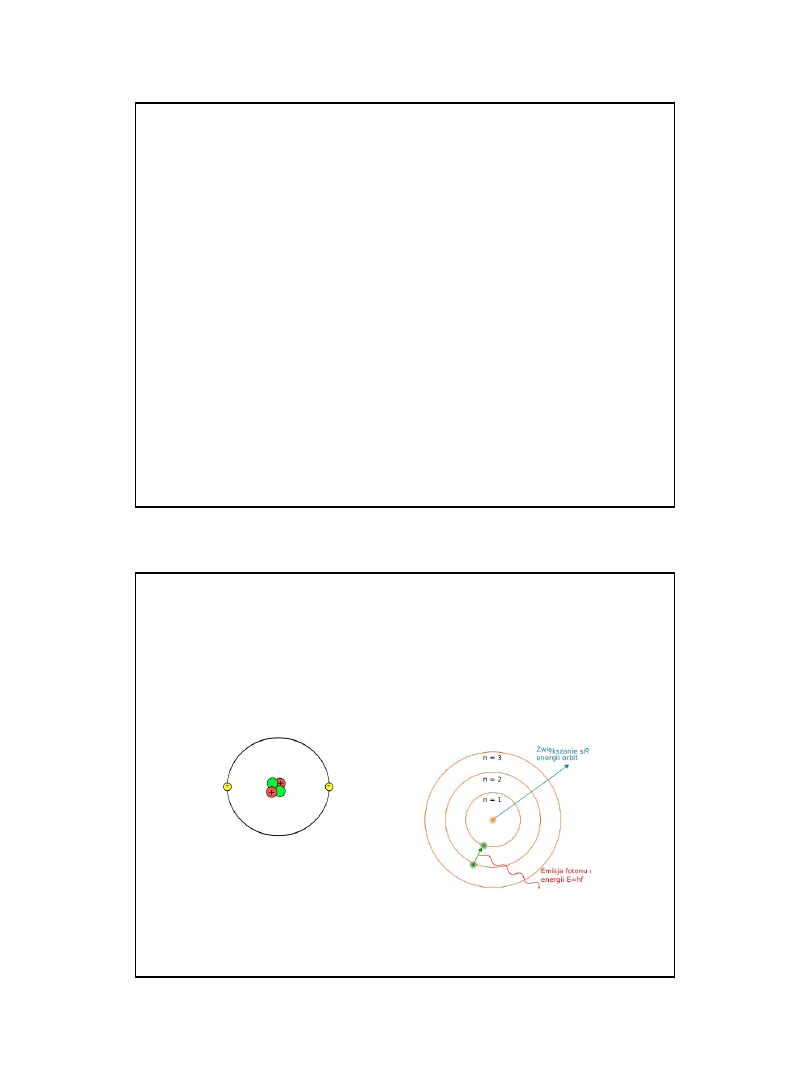
POSTULATY BUDOWY ATOMU BOHRA
Bohr (1913) teorię swą oparł na twierdzeniach, zwanych dziś postulatami
Bohra.
1.
Elektron w atomie może przebywać tylko w określonych stanach, o
określonej energii, zwanych stacjonarnymi
2. Elektron w stanie stacjonarnym nie promieniuje (nie traci energii).
•
= E1 + E2 =
h
– wartość emitowanej energii podczas przejścia do stanu
o wyższej energii.
3. Dozwolone stany dla ruchu elektronu odpowiadają tylko pewnym
dozwolonym wartościom (kwantom) orbitalnego momentowi pędu
będącego wielokrotnością liczby h/2
: mvr =n(h/2
)
4. W każdym z tych stanów elektron porusza się wokół jądra po orbicie kołowej.
Tylko takie orbity są dozwolone, dla których iloczyn długości orbity i pędu
elektronu jest równy całkowitej wielokrotności stałej Plancka.
2 rmv=nh ; n=1,2,3.......
Orbitalny model atomu helu i model
budowy atomu Bohra
2009-11-24
4
• Dwa pierwsze postulaty są poprawne i
zachowane w teorii kwantowej.
• Trzeci jest słuszny częściowo – moment pędu
elektronu jest wielkością stałą. Bohr nie
wyjaśnił dlaczego moment pędu jest
kwantowany
– założenie to dawało zgodność
między przewidywaniami a obserwacją.
• Czwarty jest całkowicie niesłuszny – elektron
porusza się po orbicie kulistej.
• Mimo pozornej poprawności modelu
zrezygnowano z niego.
• Zgodnie z elektrodynamiką klasyczną,
poruszający się po okręgu (lub elipsie), a
więc przyspieszany, elektron powinien, w
sposób ciągły, wypromieniowywać energię
i w efekcie "spadłby" na jądro już po
czasie rzędu 10
-6
sekundy.
• Fakt, że tak się nie dzieje, nie dawał się
wytłumaczyć na gruncie fizyki klasycznej.
2009-11-24
5
Model Bohra został ostatecznie odrzucony
również ze względu na to, że:
-
nie dawało go się zaadaptować do
atomów posiadających więcej niż dwa
elektrony
-
nie można było za jego pomocą stworzyć
przekonującej, zgodnej ze znanymi
faktami eksperymentalnymi teorii
powstawania wiązań chemicznych
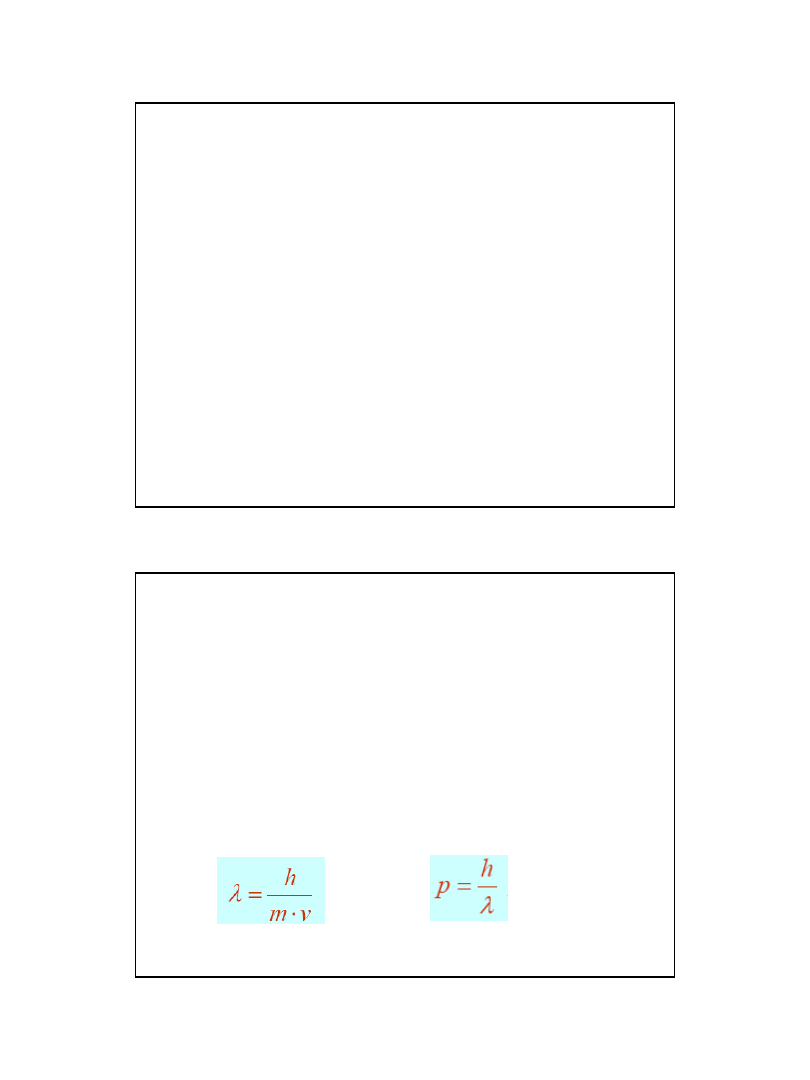
• Dopiero w 1924 de Broglie podał
wyjaśnienie – każda poruszająca się
cząstka ma falową naturę (jak światło)
•
= h/mv
– długość fali jest b. mała w
porównaniu z wymiarami cząstki
2009-11-24
6
Dualizm
• Dualizm korposkularny – każdą cząstkę
charakteryzuje masę i długość fali
• Zasada nieoznaczoności Heisenberga –
niemożliwość jednoczesnego, dokładnego
pomiaru położenia i pędu cząstki.
• Wyprowadził on wzór łączący masę cząstki
(m), prędkość (v) oraz energie kinetyczną (E):
E = mv
2
/ 2
Zasada nieoznaczoności
Heisenberga
• Zasada nieoznaczoności Heisenberga –
niemożliwość jednoczesnego, dokładnego
pomiaru położenia i pędu cząstki.
• Opis energii elektronu w atomie => to określenie
położenia i pędu elektronu
• Położenie
Pęd
2009-11-24
7
• Wyprowadził on wzór łączący masę
cząstki (m), prędkość (v) oraz energie
kinetyczną (E):
E = mv
2
/ 2
Model falowy
Teoria ta korzysta z praw mechaniki kwantowej.
Nie ma tu elektronu, jako korpuskuły, bo nie można
go dostrzec w określonym punkcie, a jedynie
mówić o prawdopodobieństwie jego
występowania w określonej przestrzeni.
Złożone wyrażenia matematyczne ustalają rozkład
gęstości elektronowej.
Stany energetyczne w atomie są określone,
podobnie jak w modelu Bohra, przez liczby
kwantowe.
2009-11-24
8
Teoria falowa w precyzyjniejszy niż
wcześniej sposób, opisuje zachowanie
się atomów wieloelektronowych.
Pomimo wielu niedokładności w modelu
Bohra, czasem okazuje się on być
przydatny przy wyjaśnianiu prostych
założeń chemicznych.
• W centralnej części atomu znajduje się dodatnio
naładowane jądro, w którym znajdują się
protony i neutrony.
• Za zwartą strukturę jądra atomowego
odpowiadają siły jądrowe.
• Natura tych sił nie została do dzisiaj poznana.
• Wokół jądra, w bardzo znacznej od niego
odleglości (biorąc pod uwagę rozmiar samego
jądra), bezustannie i z ogromną prędkością
krążą po eliptycznych torach elektrony.
2009-11-24
9
• Między jądrem a elektronami istnieje wolna
przestrzeń.
• Tę pozornie pustą przestrzeń wypełnia chmura
elektronowa i ich pole elektromagnetyczne.
• Elektrony krążą z ogromną prędkością (wykonują
około 6 mld okrążeń na mikrosekundę).
• Bardzo trudno jest jednoznacznie powiedzieć w
którym konkretnie miejscu, znajduje się elektron w
danej chwili.
• Elektron znajduje się wszędzie dokoła jadra i
tworzy coś w rodzaju chmury. Elektrony krążące w
tej samej odległości od jądra tworzą tzw. powłokę
elektronową
Kwarki
• Fizycy odkryli, że protony i neutrony są zbudowane z jeszcze
mniejszych cząstek, zwanych kwarkami.
• Według naszej dotychczasowej wiedzy kwarki są jak punkty w
geometrii.
• W chwili obecnej, po wielu doświadczeniach sprawdzających tę
teorię, naukowcy podejrzewają, że kwarki i elektron są
elementarne.
• Istnieje sześć rodzajów kwarków. Trzy z nich mają ładunek
+2/3e, a pozostałe ładunek -1/3e. Nazwy kwarków pochodzą
od pierwszej litery angielskich nazw.
• Proton składa się z 3 kwarków: 2 kwarków u i jednego d, a
neutron także z 3 kwarków, tyle że 2 kwarków d i jednego u.
Dzięki ułamkowym wartościom ładunku kwarków, cząstki
elementarne z nich zbudowane mają ładunek całkowity.

2009-11-24
10
Kwarki
kwarki i elektrony są mniejsze niż 10 do potęgi -18 metra, jest wiec możliwe ze
nie maja one w ogóle żadnego rozmiaru. Jest tez możliwe, ze kwarki i
elektrony nie są cząstkami elementarnymi, ale zbudowane są z jeszcze
mniejszych cząsteczek.
atomy są zbudowane z protonów, neutronów i elektronów. Protony i
neutrony są zbudowane z kwarków, które być może są zbudowane z
jeszcze bardziej podstawowych cząstek...
Trwałość jądra
• Trwałość jądra jest utrzymywana dzięki
siłom jądrowym - działające pomiędzy
nukleonami. Mają one bardzo niewielki
zasięg działania z powodu bardzo małego
promienia jądra atomowego, którego
średnica jest równa ok. 10
-15
– 10
-14
m
oraz brakiem związku z ładunkiem.
2009-11-24
11
• Energię wylicza się z równania Einsteina:
E = mc
2
• Jej wartość wskazuje na to jaka energia
musi być dostarczona, by rozbić jądro albo
jaka ilość jest wydzielona podczas jego
tworzenia. Wzrost energii wiązania oraz
defektu masy czyni jądro bardziej trwałe
(stabilne).
Jądra trwałe to takie, które:
• Posiadają równe ilości protonów i neutronów
• Posiadają parzyste ilości protonów oraz
neutronów
• Stosunek protonów do neutronów wynosi 2 : 3
W pozostałych przypadkach następuje
samorzutny rozpad.
Suma protonów oraz neutronów w zasadzie jest
równa masie jądra w jednostkach mas
atomowych u.
Wyszukiwarka
Podobne podstrony:
chemia budowa atomu
1. Budowa atomu...., chemia(2)
Budowa atomu testy chemia liceum, chemia liceum
Budowa atomu, Chemia
budowa atomu II
Budowa atomu 2, CHEMIA, semestr 1, chemia ogólna, wykłady
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
budowa atomu, Semestr 1, Chemia
scen. - budowa atomu a układ okresowy pierwiastków, chemia, scenariusze lekcji
Budowa atomu 1, CHEMIA, semestr 1, chemia ogólna
pods. - budowa atomu a układ okresowy 2, chemia, podsumowanie wiadomości
WYKŁAD (budowa atomu, CHEMIA
Chemia - Budowa atomu i wiązania chemiczne(1), EDUKACJA 35 000 TYS. plików z każdej branży
budowa atomu ukl okresowy, Chemia, Gimnazjum, kl1, Budowa atomu
Budowa atomu, Chemia, Korki chemia
CHEMIA- BUDOWA ATOMU(1), CHEMIA
więcej podobnych podstron