Testy z chemii - liceum, gimnazjum - zgodne z programem nauczania
Pytanie:
Zapisz systemem pełnym i skróconym konfigurację atomu
A. tlenu.
B. magnezu
Odpowiedż:
Atom tlenu
Zapis pełny: 1s22s22p4
Zapis skrócony: [He]2s22p4
Atom magnezu:
Zapis pełny: 1s22s22p63s2
Zapis skrócony: [Ne]2s2
Pytanie:
Jak jest wartość spinowej liczby kwantowej s.
Odpowiedż:
Spinowa liczba kwantowa s przyjmuje wartość 1/2.
Pytanie:
Które graficzne zapisy są niepoprawne.
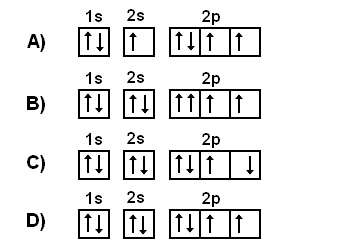
Odpowiedż:
A. Niepoprawny: powinno najpierw zapełnić się orbital s
B. Niepoprawny: w pierwszym orbitalu 2p zwroty powinny być przeciwne
C. Niepoprawny: w drugim i trzecim orbitalu 2p zwroty powinny być takie same
D. Poprawny
Pytanie:
O czym mówi zakaz Pauliego?
Odpowiedż:
Zakaz Pauliego.
W atomie nie mogą istnieć 2 elektrony o tych samych wartościach 4 przypisanych im liczb kwantowych: n, l, m, ms.
Pytanie:
Poboczna (orbitalna) liczba kwantowa l
- co określa
- jakie przyjmuje wartości
- jak nazwiesz stany kwantowe o takiej samej wartości liczby n i liczby l i jak są one oznaczane
Odpowiedż:
Poboczna (orbitalna) liczba kwantowa l
- określa stany energetyczne elektronów w tej samej powłoce elektronowej
- przyjmuje wartości liczb całkowitych od 0 do n-1 włącznie (n - główna liczba kwantowa)
- zbiór stanów kwantowych o tej samej liczbie kwantowej n i tej samej pobocznej liczbie kwantowej l jest nazwany podpowłoką elektronową.
- podpowłoki są oznaczane literami kolejno: s, p, d, f
Pytanie:
1. Wyjaśnij pojęcie orbitalu atomowego.
2. Podaj nazwisko uczonego z tym związane.
3. Co powiesz o torze elektronu w atomie
Odpowiedż:
1. Orbital to funkcja falowa opisująca ruch elektronu w atomie.
2. Fizyk szwajcarski Ernest Schrödinger ułożył po raz pierwszy równanie ruchu elektronu
3. Nie da się określić toru elektronu, lecz jedynie prawdopodobieństwo znalezienia w wybranym obszarze przestrzeni wokółjądrowej. Prawdopodobieństwo to podaje kwadrat funkcji falowej, zwanej orbitalem.
Pytanie:
Oblicz liczbę stanów kwantowych w podpowłoce d.
Odpowiedż:
Podpowłoce d odpowiada poboczna liczba kwantowa l=2 (s: l=0, p: l=1, d: l=2)
Każdej liczbie kwantowej l odpowiadają wartości magnetycznej liczby m od -l do +l
Więc: dla l=2 będzie to: -2, -1, 0, +1, +2 (5 liczb)
Każdej liczbie m odpowiadają 2 magnetyczne spinowe liczby kwantowe ms: +1/2 i -1/2
Liczbę stanów kwantowych dla podpowłoki d obliczymy mnożąc 5 i 2.
Liczba stanów kwantowych dla podpowłoki d (liczba elektronów) wynosi 10.
Pytanie:
Wymień 4 założenia hipotezy atomistycznej Daltona.
Odpowiedż:
1. Materia składa się z atomów
2. Atomy danego pierwiastka są jednakowe
3. Atomy są niepodzielne
4. Atomy mogą łączyć się i tworzyć cząsteczki
Pytanie:
Magnetyczna spinowa liczba kwantowa ms.
- co opisuje
- jakie przyjmuje wartości
Odpowiedż:
Magnetyczna spinowa liczba kwantowa ms.
- opisuje moment pędu elektronu obracającego się wokół własnej osi
przyjmuje wartości +1/2 lub -1/2
Pytanie:
Orbitale można przedstawić w postaci geometrycznych kształtów.
Co one obrazują?
Odpowiedż:
Geometryczne kształty orbitali pokazują rozkład prawdopodobieństwa znalezienia elektronu w przestrzeni - kontur orbitalu pokazuje największe prawdopodobieństwo znalezienia elektronu.
Pytanie:
Co to jest stan podstawowy i stan wzbudzony atomu?
Odpowiedż:
Stan podstawowy - stan o najniższej energii elektronów w atomie
Stan wzbudzony - każdy stan o wyższej energii elektronów niż w stanie podstawowym
Pytanie:
Wyjaśnij pojęcia:
- protony
- neutrony
- elektrony
- nukleony
Odpowiedż:
- protony - cząstki elementarne naładowane dodatnio
- neutrony - cząstki elementarne nienaładowane
- elektrony - cząstki elementarne naładowane ujemnie
- nukleony - protony i neutrony w jądrze
Pytanie:
Jak obliczysz ilość stanów kwantowych (ilość elektronów) na dowolnej orbicie elektronowej?
Ile stanów kwantowych (elektronów) może wypełnić powłokę M?
Odpowiedż:
Liczbę stanów kwantowych (liczbę elektronów) oblicza się wzorem:
2n2
gdzie n - główna liczba kwantowa
Powłoka M ma główną liczbę kwantową n=3 więc:
2 • 32 = 18.
W powłoce K może być maksymalnie 18 stanów elektronowych (elektronów)
Pytanie:
Z konfiguracji elektronowej atomu odczytaj:
a. ilość powłok elektronowych
b. ilość elektronów walencyjnych
c. liczbę atomową
d. symbol pierwiastka
Zapis konfiguracji: 1s22s22p63s23p5
Odpowiedż:
a. ilość powłok elektronowych: 3
b. ilość elektronów walencyjnych: 7 (2+5 ostatnich na powłoce 3)
c. liczbę atomową: 17 (dodane wszystkie elektrony)
d. symbol pierwiastka: Cl
Pytanie:
Podaj treść zasady nieoznaczoności Heisenberga.
Odpowiedż:
Zasada nieoznaczoności Heisenberga.
Nie jest możliwe jednoczesne dokładne wyznaczenie położenia i pędu elektronu, czyli podanie toru po jakim porusza się elektron i gdzie znajduje się on w danym momencie.
Wyszukiwarka
Podobne podstrony:
budowa atomu, Semestr 1, Chemia
CHEMIA - ZBIÓR I TESTY , BUDOWA ATOMU, UKŁAD OKRESOWY
chemia budowa atomu
Chemia II Budowa atomu
1. Budowa atomu...., chemia(2)
Budowa atomu, Chemia
Budowa atomu 2, CHEMIA, semestr 1, chemia ogólna, wykłady
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
scen. - budowa atomu a układ okresowy pierwiastków, chemia, scenariusze lekcji
Budowa atomu 1, CHEMIA, semestr 1, chemia ogólna
pods. - budowa atomu a układ okresowy 2, chemia, podsumowanie wiadomości
WYKŁAD (budowa atomu, CHEMIA
Chemia - Budowa atomu i wiązania chemiczne(1), EDUKACJA 35 000 TYS. plików z każdej branży
budowa atomu ukl okresowy, Chemia, Gimnazjum, kl1, Budowa atomu
Budowa atomu, Chemia, Korki chemia
CHEMIA- BUDOWA ATOMU(1), CHEMIA
Budowa atomu !, Chemia
Chemia, Chemia - Budowa atomu i wiązania chemiczne, LICZBA ATOMOWA(liczba porządkowa):wielkość chara
więcej podobnych podstron