
MC_OMEN
OPRACOWANIE
PYTAŃ
BIOFIZYKA
MC_OMEN

MC_OMEN
1. Pierwsza zasada termodynamiki
dQ
dW
dU
2. Średnia energia na cząsteczkę
T
ik
B
2
1
3. Energia układu zawierającego n moli gazu
inRT
U
2
1
4. Przykłady stopni swobody:
He – i=3
N_2,O_2 – i=5
NH_4,CO_2 – I>=6
5. Pojemność cieplna
x
x
dT
dQ
C
)
(
6. Cieplo w przemianie izohorycznej
iR
c
v
2
1
7. Ciepło w przemianie izobarycznej
R
i
c
p
)
2
(
2
1
8. Prawo Hessa
Ciepło reakcji chemicznej nie zależy od sposobu jej przeprowadzenia, a tylko od stanu początkowego i
końcowego reagentów.
9. Entropia
)
ln(W
k
S
B
Gdzie W – prawdopodobieństwo termodynamiczne
10. Przeliczenie prawdopodobieństwa termodynamicznego na zwykłe pradopodobieństwo
i
i
W
W
P
11. Wzrost entropi względem ciepła w ujęciu termodynamiki fenomenologicznej
dQ
T
dS
1
12. II zasada termodynamiki
W procesie nieodwracalnym, do wzrostu entropii w danej temperaturze przyczynia się nie tylko ciepło
doprowadzone z zewnątrz (e) , ale także ciepło rozproszone w układzie nieodrwacalnym, tzw ciepło
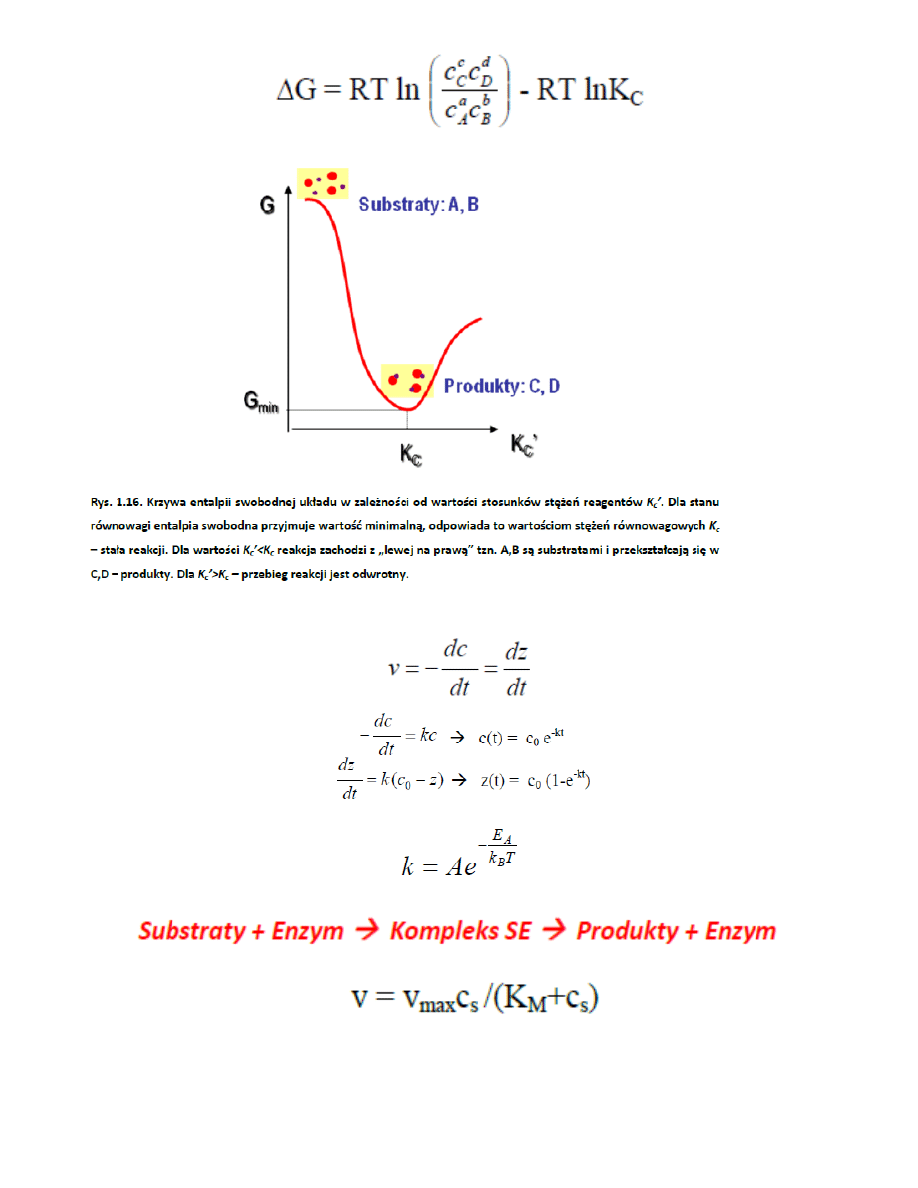
nieskomensowane (i)
i
e
i
e
dS
dS
dQ
T
dQ
T
dS
1
1
W procesach rzeczywistch suma entropii układu i otoczenia nie może się zmniejszać
13. Organizm żywy to układ otwarty w stanie stacjnoarnym.
14. Szybkość zmian entropii
0
dt
dS
dt
dS
dt
dS
i
e
15. Źródło (produkcja) entropii
MC_OMEN
dt
dS
dV
i
1
16. Zasada Prigogine’a
W stanie stacjonarnym układu otwartego produkcja entropii utrzymuje się na stałym poziomie,
const
, przjmując jednocześnie najmniejszą wartość
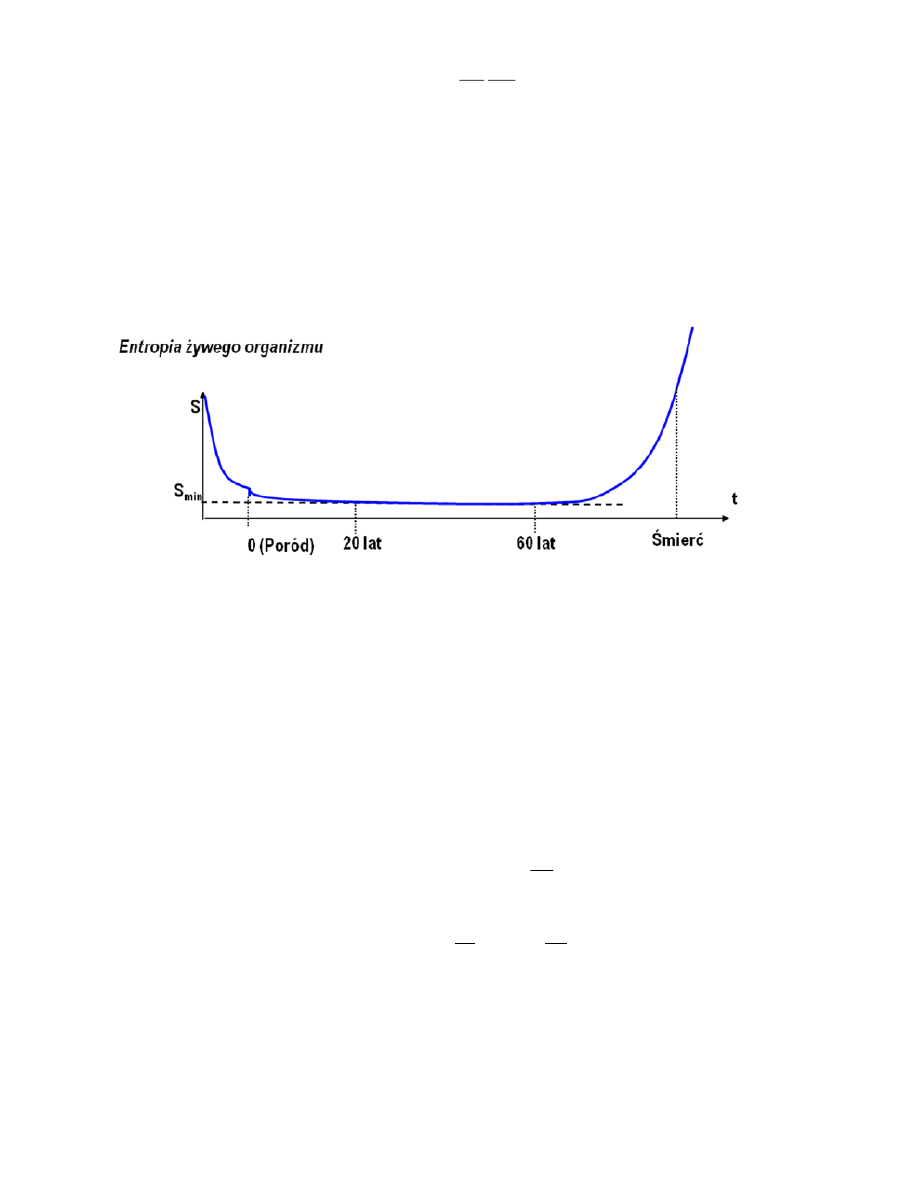
17. Entropia żywego organizmu:
Faza pierwsza, okres życia płodowego i młodośd to czas specjalizowania się komórek, porządkowania
układu, opisywany na wykresie funkcją malejącą entropii, przy jednocześnie znacznej wartości bezwzględnej
szybkości zmian entropii (tangens nachylenia stycznej do wykresu do osi czasu). W przedziale wieku od ok.
20 do 60 roku życia (umowne granice) wykres wskazuje na stały poziom entropii, co odpowiada produkcji
entropii bliskiej 0. W koocowej fazie procesy generujące entropię zaczynają przeważad i przebieg wykazuje
charakter rosnący, aż do momentu gdy dezorganizacja układu uniemożliwi jego funkcjonowanie.
18. Praca wykonywana przez układ (z I zas termodynamiki)
dQ
dU
dW
19. Rownanie z II zas termodynamiki
TdS
dQ
20. Funkcja stanu energii swobodnej (Helmholtza)
TS
U
F
21. Praca wykonana przez układ w procesie izotermicznym (dT=0)
dF
TS
U
d
dW
)
(
22. Entalpia swobodna, proces izotermiczno-izobaryczny
Jest to potencjał termodynamiczny, inaczej nazywany funkcja Gibbsa
TS
H
G
23. Zmiana entalpii swobodnej w procesach endo,egzo-ergicznych:
TdS
dG
1
2
ln
p
p
nRT
dW
dG
24. Zmiana entropii w procesach endo,egzo-erginczych
1
2
1
2
ln
ln
p
p
nR
V
V
nR
dS
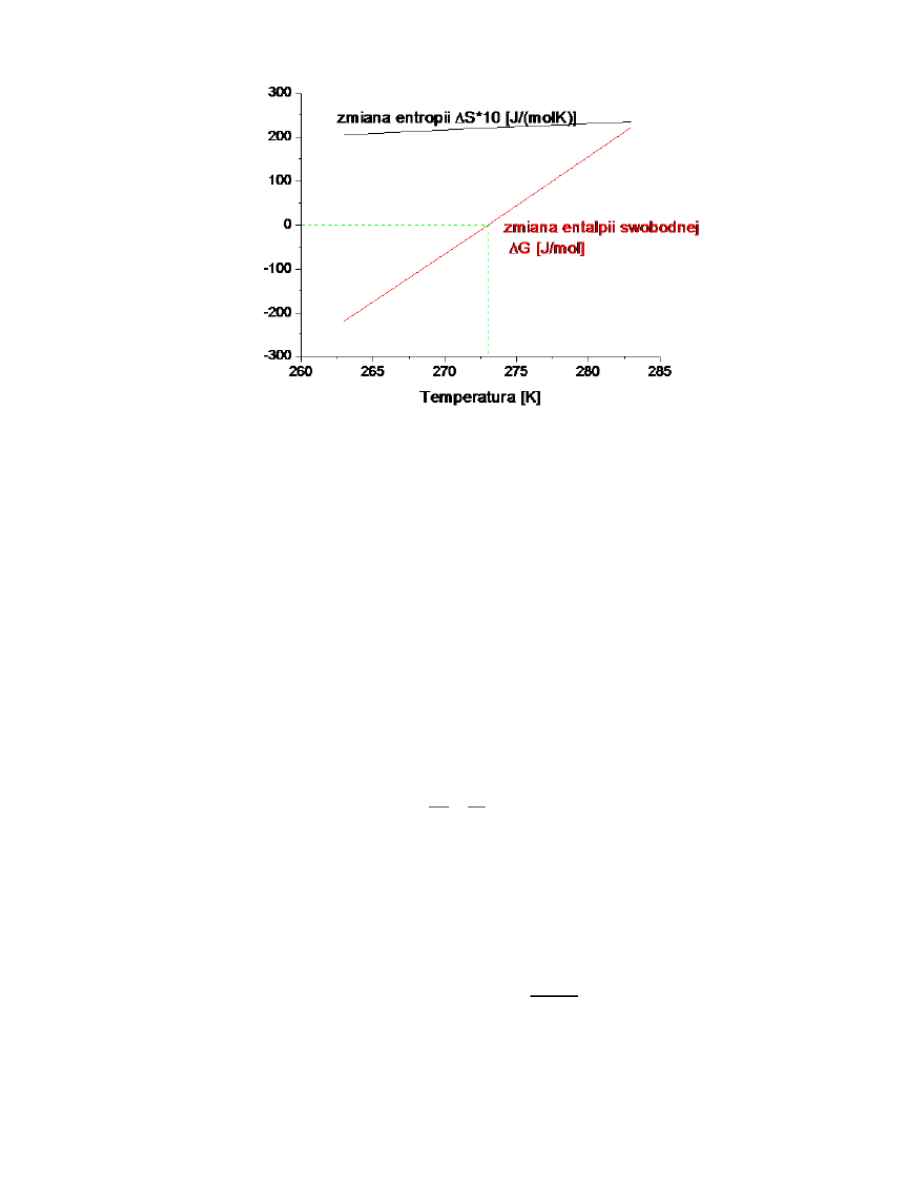
25. Zmiana etropii i entalpi swobodnej w procesie krzepnięcia wody
MC_OMEN
26. Typowy proces egzoergiczny zachodzący w żywych organizmach – proces spalania glukozy
O
H
CO
O
O
H
C
2
2
2
6
12
8
6
6
6
27. Warunki egzo,endo ergiczności
0
dG
- egzoergiczny
0
dG
- endoergiczny
28. Procesy endoergiczne mogą zachodzić w organizmie tylko w sprzężeniu z procesami egzoregicznymi
np:
woda
sacharoza
fruktoza
glukoza
Reakcja ta przechodzi w dwóche etapach:
4
1
1
PO
sacharoza
fruktoza
fosforan
glukozo
ADP
fosforan
glukozo
glukoza
ATP
29. Potejcnał chemiczny
Pochodna cząstkowa energii wewnętrznej po liczbie cząstek, przy stałej objętości i entropii układu.
Może być definiowany jako pochodna innej funkcji stanu,: entalpii, energii swobodnej czy entalpii
swobodnej po liczbie cząstek.
30. Stosunek ciśnienia parcjalnego
i
i
i
x
n
n
p
p
Jest to ułamek molowy substancji w mieszaninie.
31. Entalpia swobodna ‘i-tego’ składnika w roztworze
i
i
i
i
x
RTn
G
G
ln
0
Gdzie
0
i
G
- entalpia swobodna substancji w stanie czystym
32. Potencjał chemiczny (wzór)
i
j
n
T
p
i
i
i
n
G
x
RT
,
,
)
(
ln
MC_OMEN
Gdzie G
- infinitezymalna zmiana entalpii swobodnej wywoływana niewielką zmiany
i
n
liczby moli
substancji w warunkach niezmienności ciśnienia, tempartury i innych składników.
33. Potencjał chemiczny (inny wzór)
i
ii
i
x
RT ln
0
34. Sens fizyczny potencjału chemicznego
Jest to miara pracy dW, wykonana przez układ przy zmianie liczby moli –tego składnika mieszaniny o 1
w warunkach izotermiczno- izobarycznych.
35. Stan równowagi
Stan równowagi zachodzi jeżeli potencjały chemiczny substancji są w całej objętości jednakowe.
0
2
2
1
1
2
1
dn
dn
dG
dG
dG
36. Warunek istatniea dwóch faz
Dwie fazy mogą współistnieć w stanie równowagi termodynamicznej wtedy gdy ich potencjały są
jednakowe.
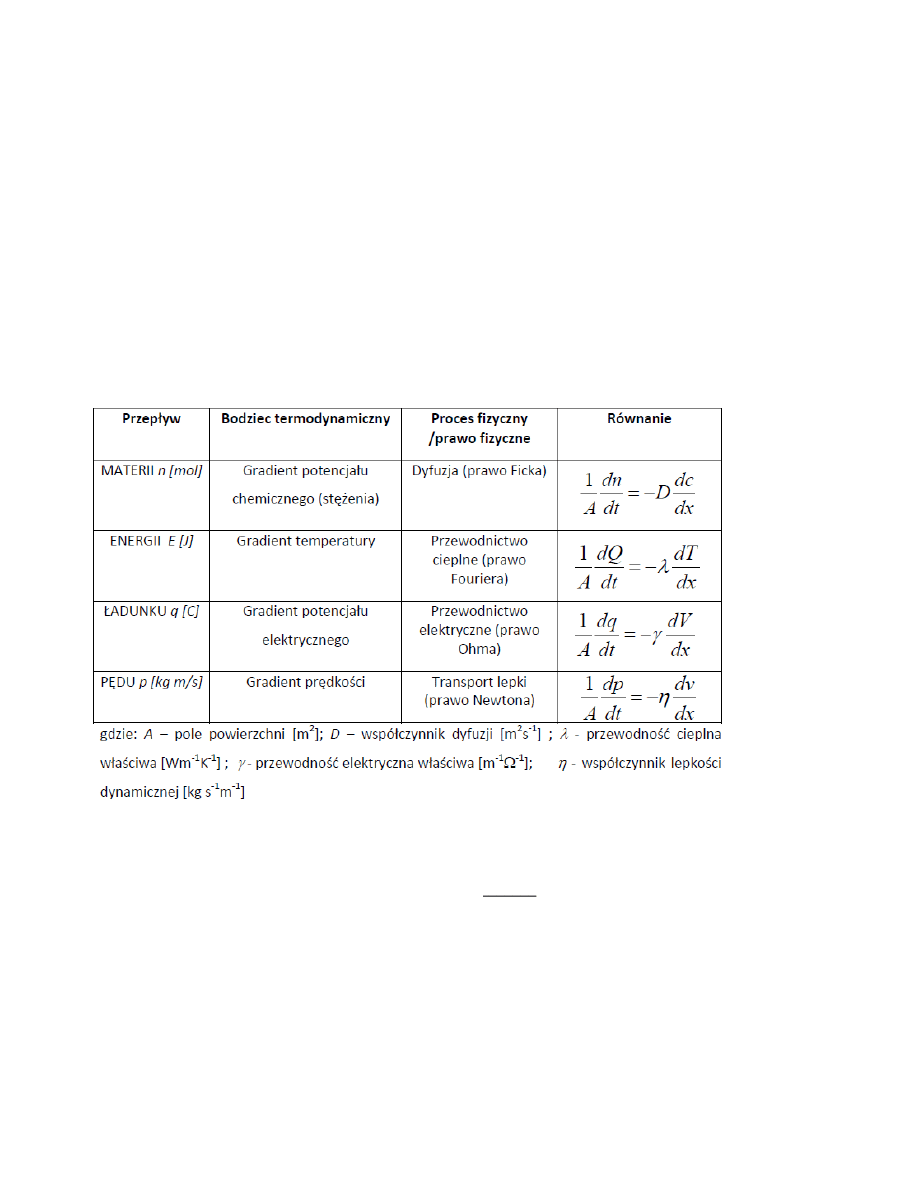
37. Zjawiska transportu:
38. Dyfuzja
Współczynnik dyfuzji, jest zależny od temperatury, lepkości ośrodna oraz promiania cząstki
dyfuncującej zgodnie z zależnością:
r
T
k
D
B
6
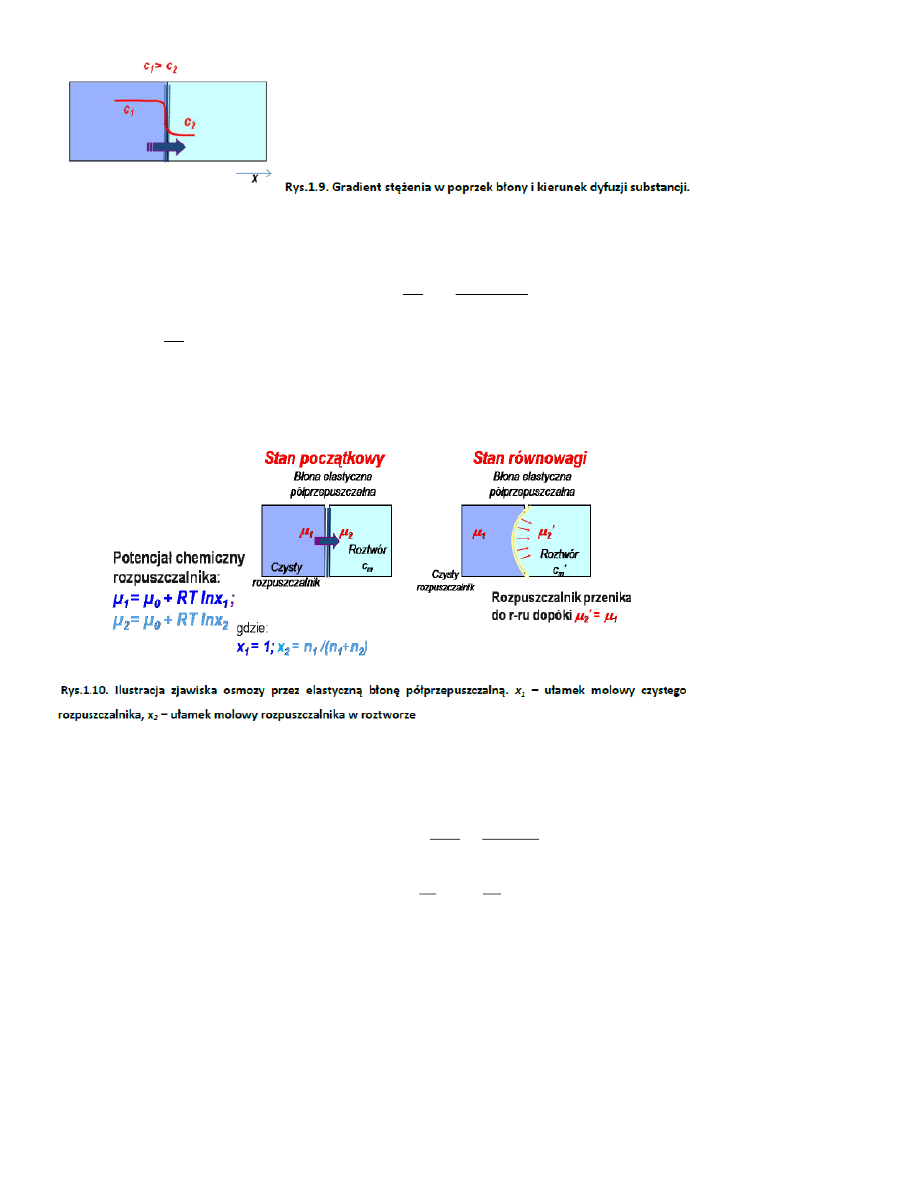
39. Dyfuzja przez błonę
MC_OMEN
w poprzek błony następuje przepływ substancji z obszaru o większym stężeniu do obszaru o mniejszym
stężeniu. Błona jest obiektem o znikomej grubości.
40. Równanie Ficka dla dyfuzji przez błonę:
A
dx
c
c
D
dt
dn
)
(
1
2
Gdzie:
P
dx
D
- przepuszczalność błony (wartość charakterystyczna) [m/s]
41. Osmoza
Wtedy gdy własności błony pozwalają tylko na transport cząsteczek rozpuszsczalnika (najczęściej
wody)
Dla przykładu powyżej, praca powiększania potencjału chemicznego:
dV
dW
2
2
'
Stąd cisnienie osmotyczne możemy zapisać jako:
2
1
1
ln
n
n
n
dV
RT
Dla słabych roztworów
2
1
n
n
zatem
1
2
1
)
ln(
n
n
N
n
, tak więc ciśnienie osmotyczne w tym przypadku
zależy tylko od stężenia substancji rozpuszconej..
42. Prawo van’t Hoffa
m
RTc
Ciśnienie osmotyczne zależy tylko od stężenia substancji rozpuczonej
43. Pomiar ciśnienia osmotycznego w oparciu o pomiar ciśnienia hydrostatyczneg
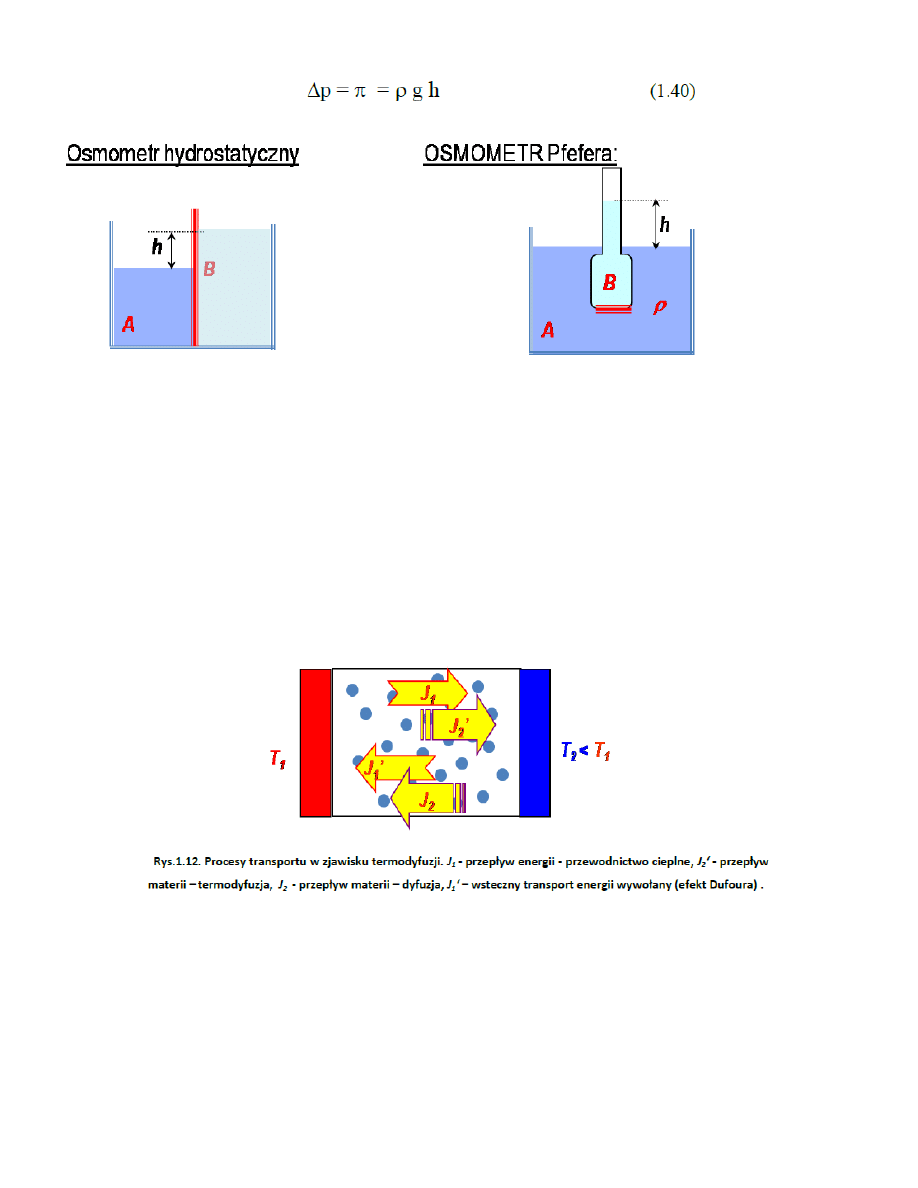
MC_OMEN
44. Równanie transportu:
i
i
i
X
L
J
Gdzie, J – strumień, X- bodziec termodynamiczny, L – współczynnik proporcjonalności (wsp.
Fenomenologiczny).
45. Równanie transportu w układach rzeczywistch,
Opisywane przez n-równań stylu:
n
nn
n
n
n
X
L
X
L
X
L
J
...
2
2
1
1
Równania tego typu używa sięgdy jeden przepływ generuje drugi itp.
46. Przewodnictwo cieplne jako proces transportu w zjawisku termodyfuzji
Z przepływem energii J1 jest sprzężony przepływ materii J2’ – termodyfuzja, z kolei ta termodyfuzja generuje
bodziec w postaci gradientu stężeń – do obszaru zimnego napływa coraz więcej cząsteczek z obszaru ciepłego.
Odpowiedzią na ten bodizec jest przepływ materii J2 wywołany różnicą stężeń , czyli dyfuzja. A przemieszane
cząsteczki unoszą ze sobąenergiędając wsteczny transporty energii J1’ wywołany różnicą stężeń, zwany
efektem Dufoura.
J1 i J2 – przepływy niszczące bodźce, tworzące entropię
J1’ i J2’ – przepływy sprzężone zmniejszające entropię i generujące nowe podźce , podtrzymujące bodźce
pierwotne.
47. Zjawiska fizyczne i powiązane z nimi procesy krzyżowe
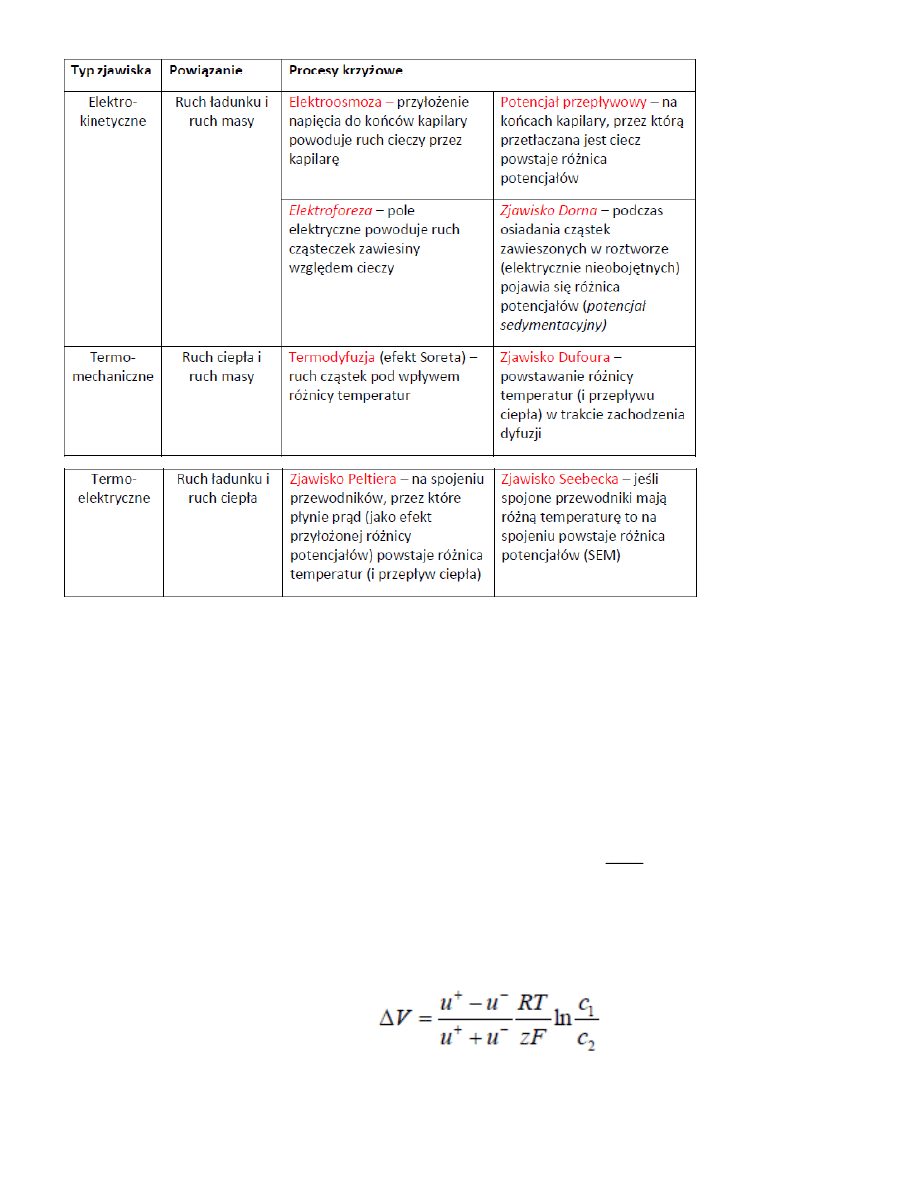
MC_OMEN
48. Potencjał elektrochemiczny
F
z
x
RT
F
z
i
i
i
i
i
ln
'
0
1
Gdzie F – stałą Faradaya, z- wartościowość jonu, fi – potencjał elektryczny
49. Mechanizm procesu pobudzenia komórek nerwowych i mięśniowych
[Bodziec] Różnica potencjałów elektrochemicznych
[Skutek] Różnica potencjałów elektrycznych
(potencjał elektrodowy, dyfuzyjny, błonowy)
[Skutek’] Stan polaryzacji lub przepływ prądu.
50. Potencjał elektrodowy
Powstaje na pograniczu metal-elektrolit
zF
RT
Inc
V
V
E
Met
1
0
1
Ogniwo stężeniowe to deltaV_1 – deltaV_2
51. Potencjał dyfuzyjny
Powstaje na granicy zetknięcia roztworów elektrolitów o różnych stężeniach i różnych ruchliwościach
kationów i anionów
jest to wzór Hendersona
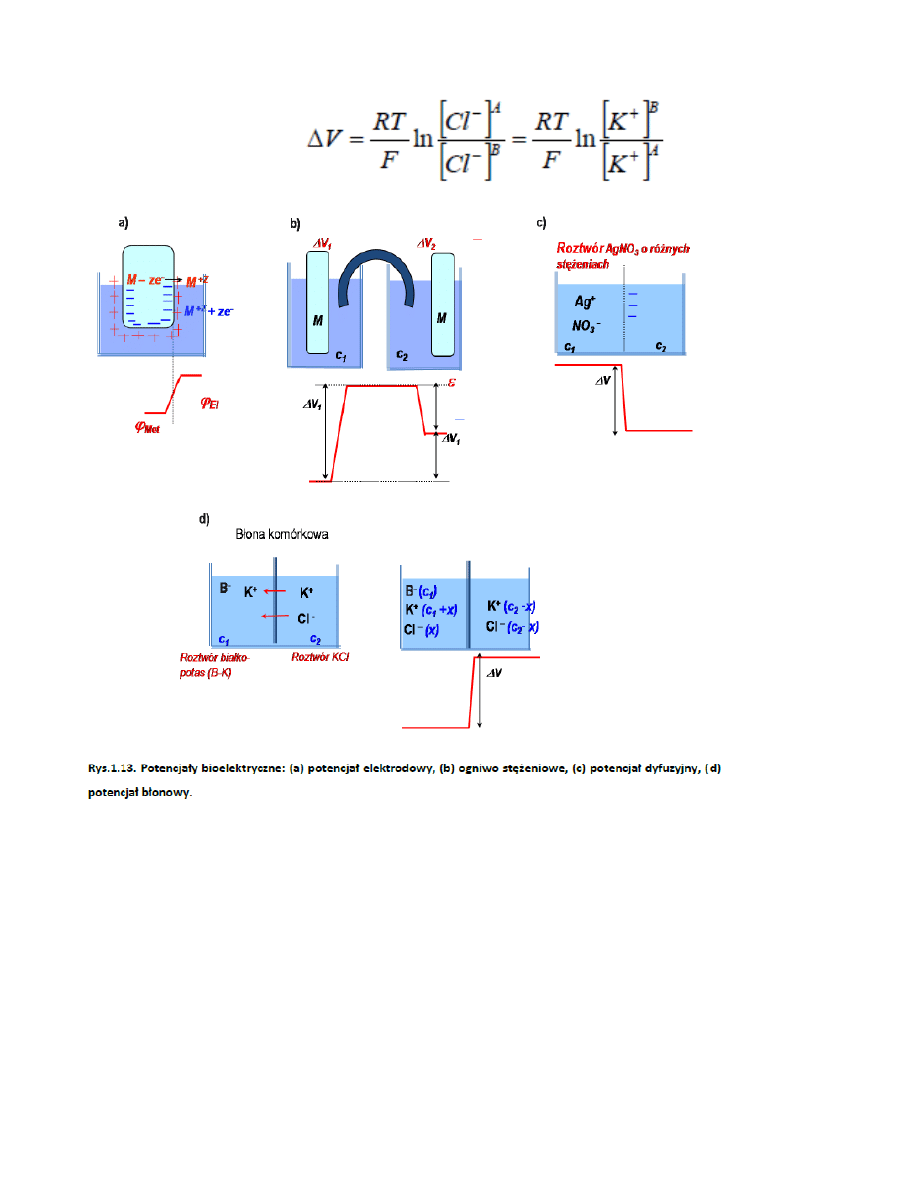
MC_OMEN
52. Potencjał błonowy, powstaje gdy elektrolity o różnych stężeniach rozdziela błona nie przepuszcająca
jonów jenego znaku.
53. Potencjały (rysunki)
54. Energia potencjalna oddziaływania w cząsteczce dwuatomowej
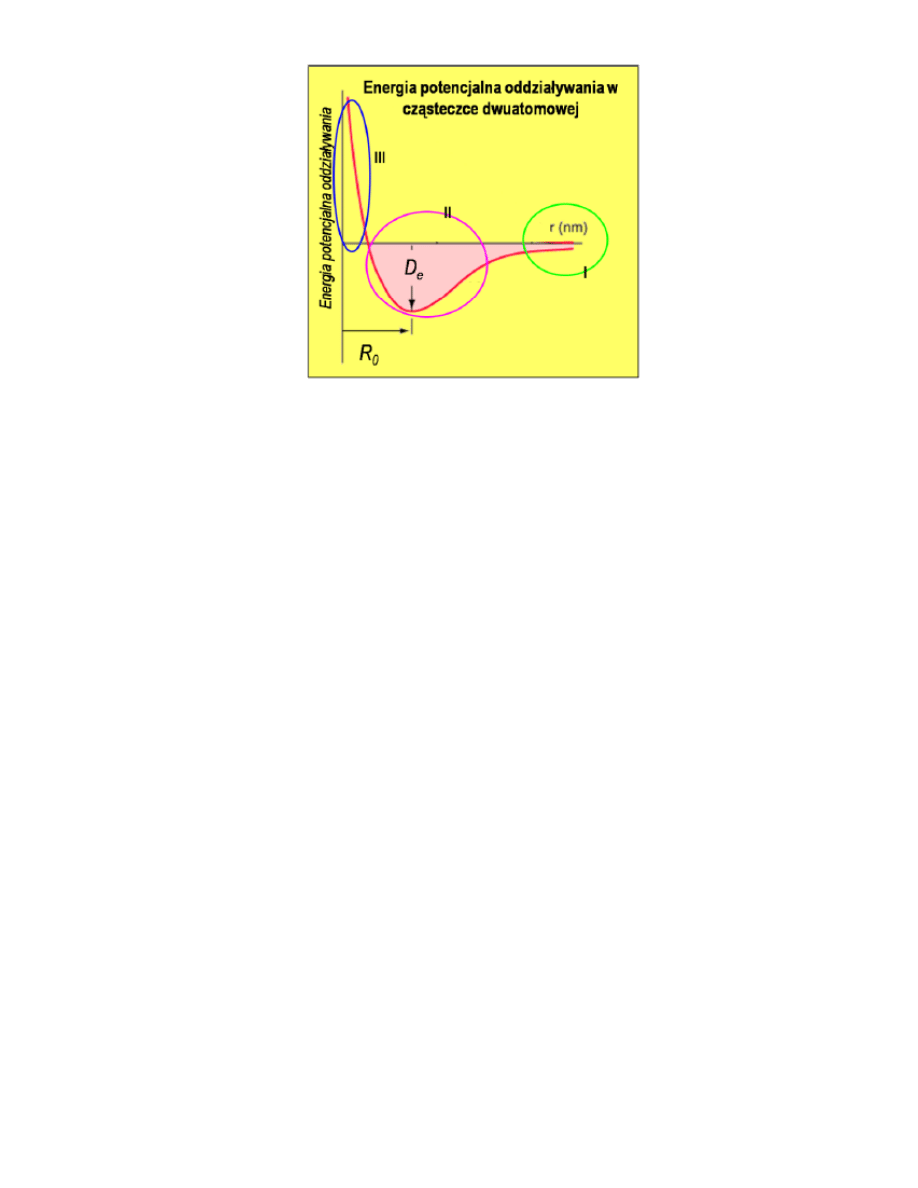
MC_OMEN
I -
b
E
E
U
0
II – powstanie stanu związanego, odpowiadającego minimum energetycznemu krzywej oddziaływania
III – zaczynają dominować siły wzajmenego odpychania się jąder atoomowych i chmur elektronów na zbyt
bliskiej odległości
Trwały związek powstanie dla odległości zbliżonych do R_0, Energia odpowiadająca położeniu minimum
D_0 nosi nazwę energii wiązania
55. Wiązanie kowalencyjne :powstaje przez uwspólnienie pary elektronów walencyjnych tak, że
elektronowa gęstośc prawdopodobieństwa jest maksymalna w obszarze pośrodku między atomami.
56. Wiązanie kowalencyjne spolaryzowane – wiązanie kowalencyjne, ale chmura elektronowa jest
nierównomiernie podzielnoa między atomami, elektrony spędzają wiecej czasu w poblizu atomu
bardziej elektroujemnego, skutkiem jest trwały moment dipolowy cząsteczki
57. Wiązanie koordynacjne – wiązanie kowalencyjne, w którym oba elektrony pochodzą od jednego
pierwiastka
58. Wiązanie metaliczne – wiązanie kowalencyjne rozszreone na większągrupęatomów, które uwspólniaja
elektrony walencyjne tworząc tzw. Gaz elektronowy.
59. Wiązanie jonowe – polega na przeniesieniu jednego lub kilku elektronów walencyjnych pierwiastka
bardziej elektroujemnego. Powstaje para jonów o przeciwnych znakach przyciągająca się
elektrostatycznie
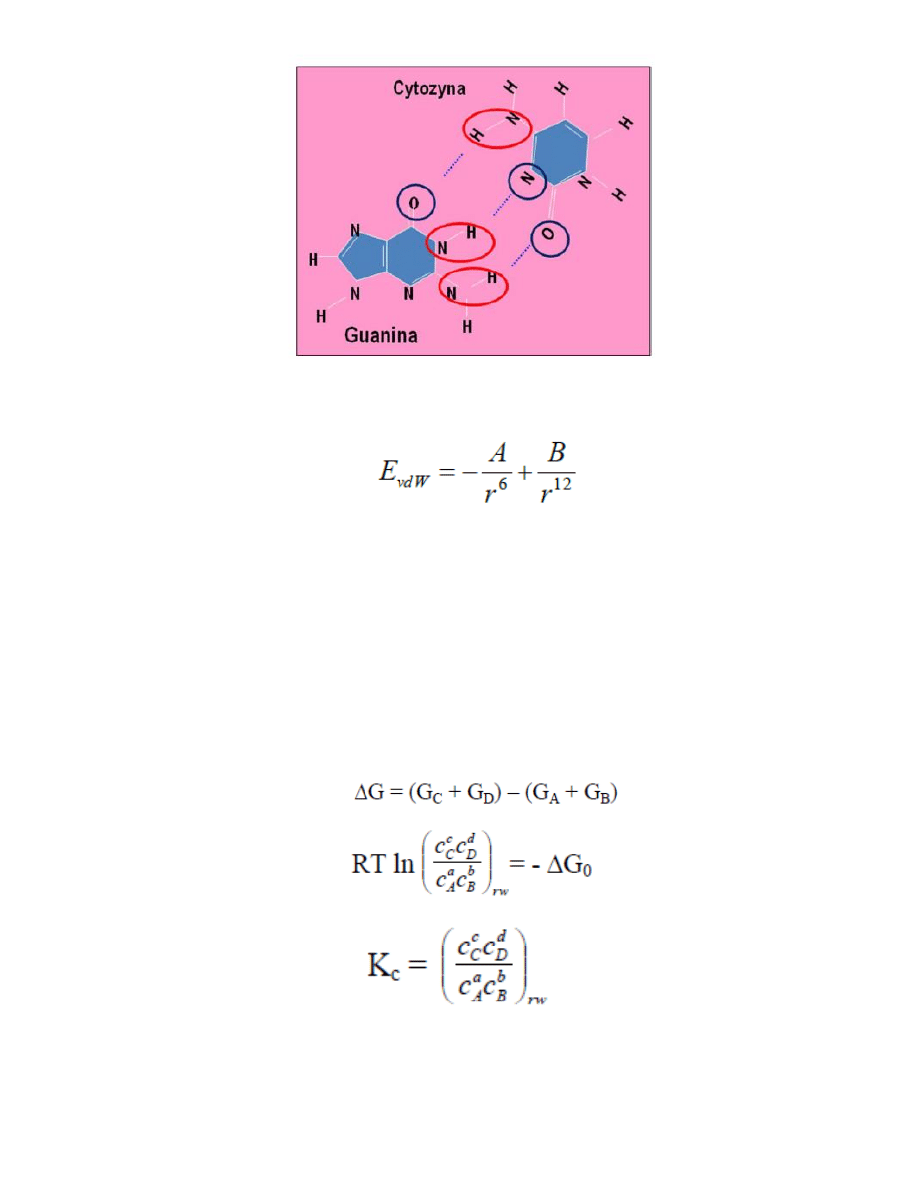
60. Wiązanie wodorowe – powstaje między atomem wodoru jednej molekuły a lekkim atomem
elektroujemym drugiej molekuły.np:
MC_OMEN
61. Wiązanie Van der Waalsa – powstaje między cząśteczkami w których występuje trwały lub indukowany
moment dipolowy np woda.
62. Potencjał lennarda-Jonesa
63. Reakcja chemiczna
Przemiana jednych substancji chemicznych w inne, które mają odmienne właściwości chemiczne
64. Reakcja analizy – rozkład substancji na substancje protsze, może zachodzi pod wpływem czynników
zewnętrznych
65. Reakcja syntez – powstwanie substancji bardziej złożonej z prostzych
66. Reakcja wymiany pojedńczej lub podwójnej – wymianie ulegają atomy lub grupy atomów
67. Reakcja addycji – reakcja syntezy polegająca na łączeniu się dwóch cząsteczek organicznych w jedną
zachodząca ze zmnijszeniem krtności wiązania wielokrotnego
68. Reakcja eliminacji- prowdzi do zwiększenia krotności wiązanai chemicznego
69. Kierunek reakcji
O kierunku reakcji decyduje znak zmiany entalpii swobodnej produktów względem substratów, jezeli
jest mniejsza od 0 to zachodzi od lewej do prawej, jezeli wieksza od zera – od prawej do lewej, jezeli
jest równa zero – nie zachodzi
70. Stan równowagi reakcji
71. Stała równowagi
72. Równanie izotermy van’t Hoffa
MC_OMEN
73. Krzywa entalpii swobodnej
74. Szybkość reakcji wyraża tempo zmniejszania się stężenia substratów i jednocześnie temopo wzrostu
stężęnia produktów.
75. Stała szybkości k:
76. Katalizaotr – substancja która nie beirze udziału w reakcji ale ułatwia jej przebieg
77. Równanie Michaelisa-Menten
Gdiz K_M – stała Michaelis-Menten – stężenie przy którym prędkość reakcji wynosi ½ V_max
Wyszukiwarka
Podobne podstrony:
Opracowanie wykładów biofyzka 2 MC OMEN
Opracowanie wykładów biofyzka 3 MC OMEN
Opracowanie pytań RÓŻNE MC OMEN
Opracowanie wykladow MC OMEN
Opracowanie wykladow MC OMEN
Opracowanie Sciaga MC OMEN
Opracowanie pytań MC OMEN 2
Opracowanie pytań MC KULA MC OMEN 2
Opracowanie pytań MC OMEN 3
Opracowanie projektu MC OMEN
Opracowanie pytań MC OMEN
Opracowanie pytań MC OMEN
Opracowanie do kolokwium part 2 MC OMEN
Opracowanie MC OMEN
Opracowanie Sciaga MC OMEN
Opracowanie pytań MC OMEN 2
więcej podobnych podstron