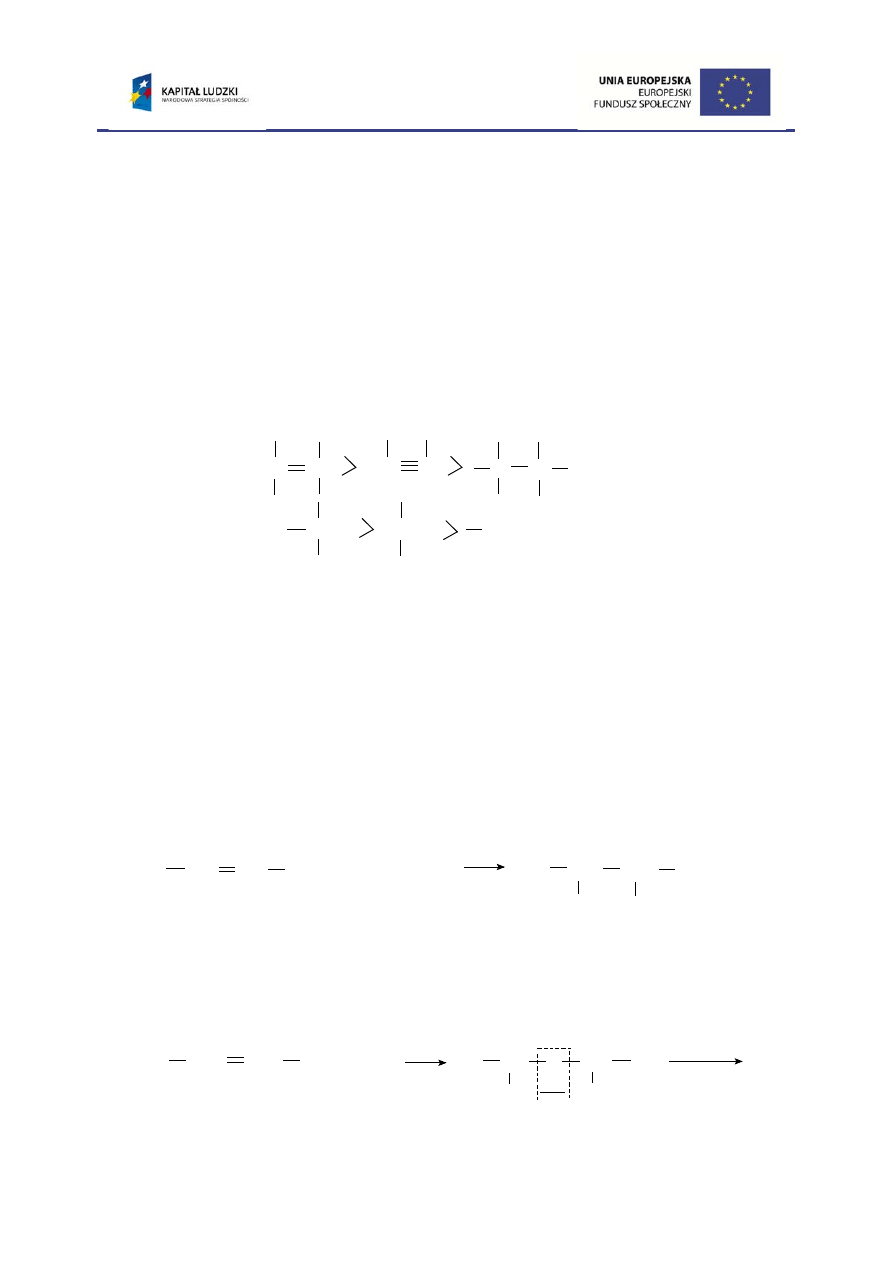
Projekt współfinansowany przez Unię Europejską
w ramach Europejskiego Funduszu Społecznego
1
ĆWICZENIE 8
Utlenianie związków organicznych
W reakcjach utleniania związków organicznych utleniaczami są elektrofilowe
odczynniki, głównie nieorganiczne, charakteryzujące się dużym powinowactwem do
elektronów. Spośród wielu różnorodnych utleniaczy najczęściej wykorzystywane to:
kwas azotowy(V), ozon, tlen oraz jego związki o charakterze nadtlenków (nadtlenek
wodoru, nadtlenki metali, nieorganiczne i organiczne kwasy nadtlenowe), siarka,
chlorowce, związki metali o wysokim stopniu utlenienia (związki żelaza(III), tlenek
manganu(IV), manganian(VII) potasu, kwas chromowy(VI), tlenek chromu(VI) i in.).
Łatwość utleniania związku organicznego jest uzależniona od jego
nukleofilowości, im większa nukleofilowość, tym większa podatność na utlenienie, np.
Szczególnym przypadkiem utleniania jest odwodorowanie polegajace na
oderwaniu z substratu dwóch atomów wodoru (ściślej na oderwaniu dwóch
elektronów i dwóch protonów).
W preparatyce i analityce organicznej reakcje utleniania mają duże znaczenie
ze względu na możliwość badania za ich pomocą struktury związków organicznych
np. określenie miejsca położenia wiązania podwójnego czy określenie miejsca
położenia i liczby grup alkilowych w pierścieniu aromatycznym itp.
Przykłady reakcji utleniania związków organicznych
1. Wśród węglowodorów najłatwiej utleniają się alkeny, przy czym produkty
utleniania zależne są od warunków reakcji i mocy utleniacza np.:
a. Utlenianie alkenów manganianem(VII) potasu w środowisku zasadowym
prowadzi do otrzymania dioli:
alken
diol
b. W wyniku ozonolizy alkenów dochodzi do całkowitego rozerwania wiązania
podwójnego. Reakcja ta jest wykorzystywana do określenia miejsca położenia
wiązania podwójnego w cząsteczce.
C
C
C
C
C
C
CH
CH
2
CH
3
CH
CH
CH
1
R
R
1
R
R
"
O"
H
2
O
OH
OH
CH
+
+
CH
CH
CH
CH
R
R
1
1
R
R
O
H
2
O
O
3
+
+
O
O
alken
Projekt współfinansowany przez Unię Europejską
w ramach Europejskiego Funduszu Społecznego
2
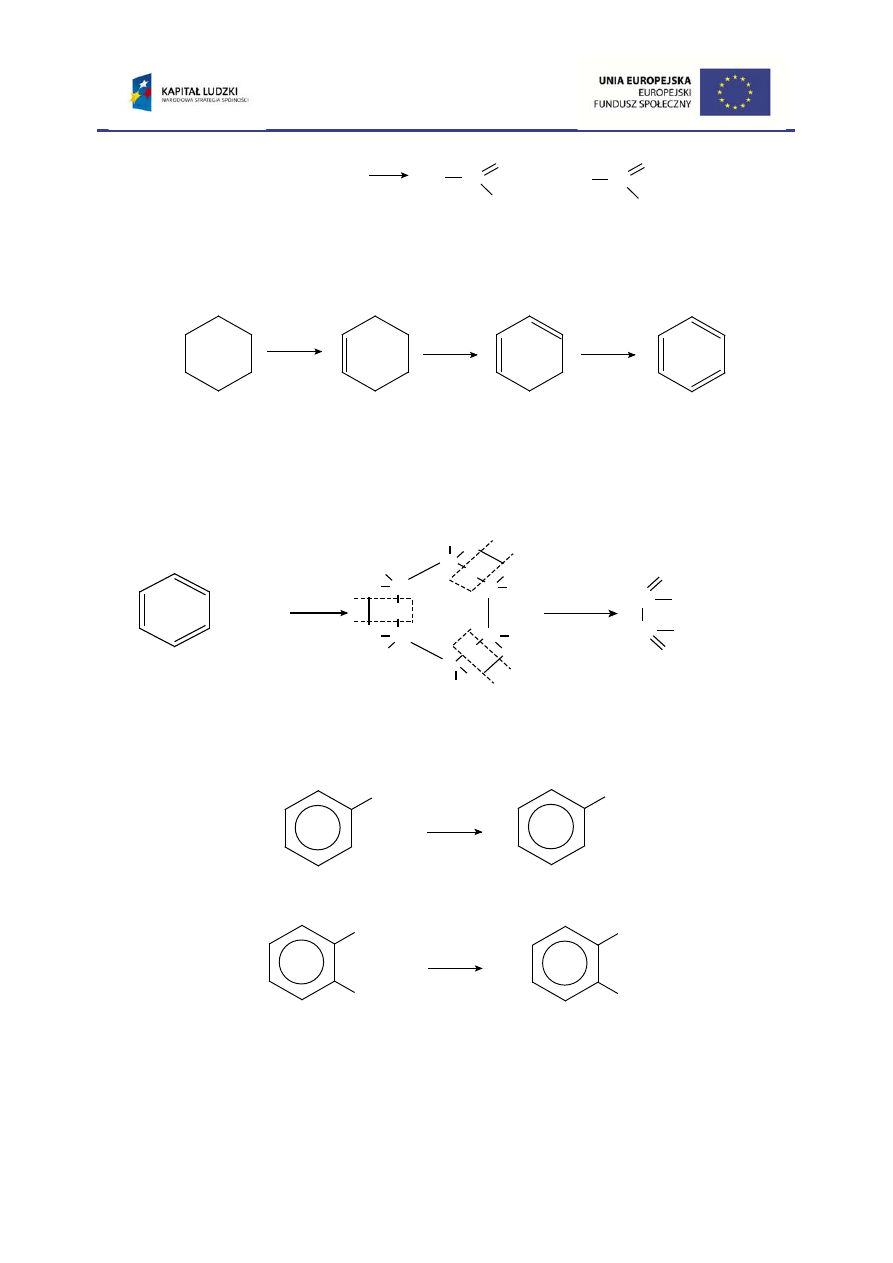
2. Przykładem utleniania przez odwodornienie jest reakcja katalitycznego
odwodornienia cykloheksanu w temp. 300
0
C, w wyniku której powstaje benzen:
3. Benzen jest odporny na działanie takich czynników utleniających jak
manganian(VII) potasu, kwas chromowy(VI). Jedynie ozon reaguje z benzenem
tworząc triozonek, z którego po redukcji i hydrolizie uzyskuje się glioksal:
Natomiast homologi benzenu poddane utlenieniu dają kwasy aromatyczne:
Charakterystycznym jest przy tym fakt, że długość łańcucha bocznego nie ma
wpływu na jakość produktów utleniania. Utlenieniu do grupy – COOH ulega bowiem
C
C
R
1
R
+
+
O
O
H
H
H
2
O
2
aldehydy
Pt
Pt
Pt
-H
2
-H
2
-H
2
cykloheksan cykloheksen cykloheksadien benzen
3 O
3
3H
2
O
3H
2
O
2
+
+
+
C
C
C
C
C
C
C
C
O
O
O
O
O
O
O
O
O
O
O
H
H
H
H
H
H
H
H
3
benzen
glioksal
(dialdehyd)
triozonek benzenu
benzoesowy
kwas
toluen
utl.
COOH
CH
3
CH
3
CH
3
COOH
COOH
utl.
o-ksylen
kwas o-ftalowy
Projekt współfinansowany przez Unię Europejską
w ramach Europejskiego Funduszu Społecznego
3
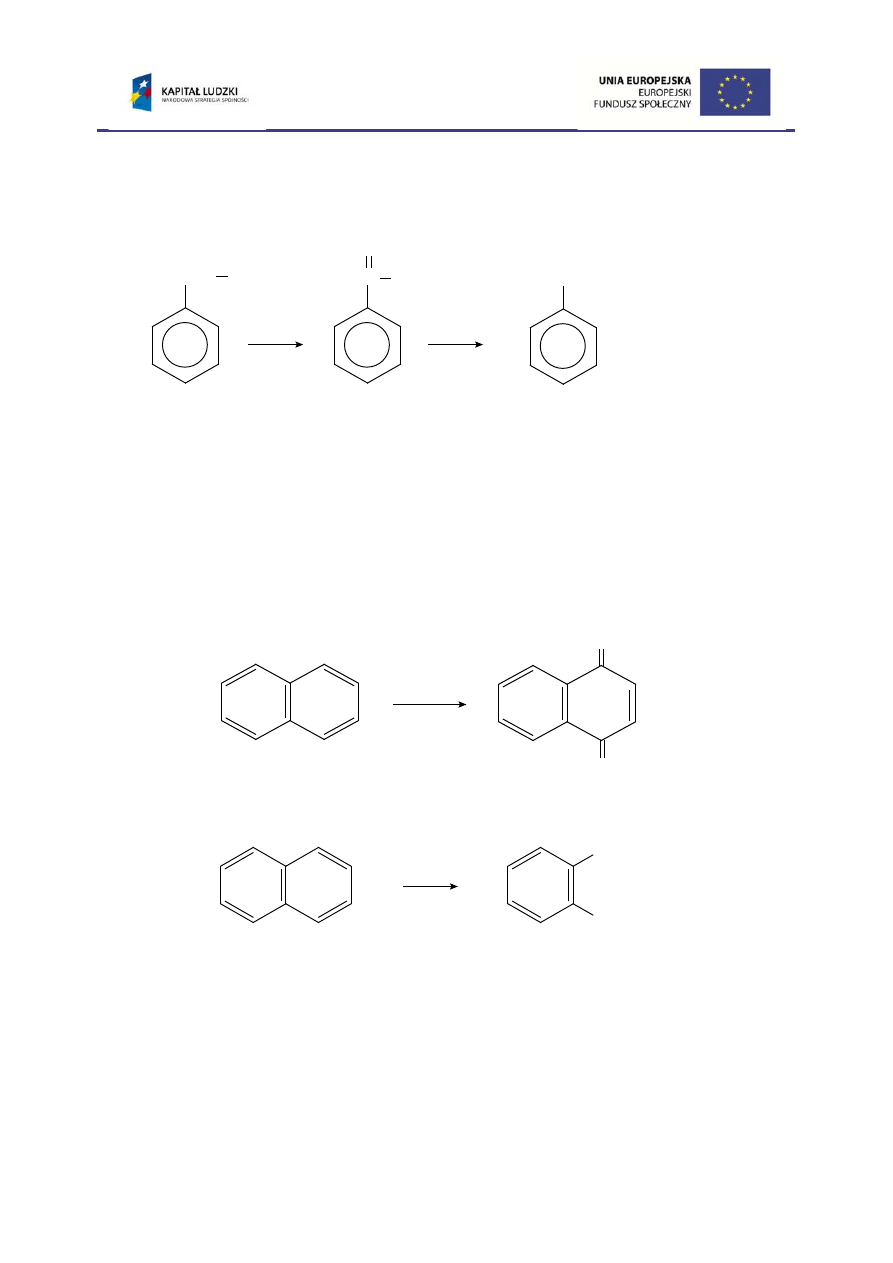
tylko atom węgla α łańcucha bocznego, natomiast dalsze grupy węglowodorowe
łańcucha bocznego utleniają się do CO
2
i H
2
O. Tak więc utlenienie etylobenzenu,
podobnie jak metylobenzenu, prowadzi do kwasu benzoesowego.
W przypadku utleniania ksylenów otrzymuje się głównie kwasy dikarboksylowe,
jednakże, dobierając odpowiednie warunki reakcji, można utlenić tylko jedną grupę
metylową ksylenu do grupy karboksylowej uzyskując odpowiednie pochodne
metylowe kwasu benzoesowego (kwasy: o-, m- lub p-metylobenzoesowe czyli
toluilowe).
Związki aromatyczne wielopierścieniowe (o pierścieniach skondensowanych)
są bardziej podatne na utlenienie niż benzen, przy czym, w zależności od mocy
utleniacza, otrzymuje się różne produkty utlenienia np.:
4. Utlenianie alkoholi pierwszo-, drugo-
i trzeciorzędowych – instrukcja do
Ćwiczenia 2
5. Utlenianie aldehydów –
instrukcja do Ćwiczenia 2
CH
3
CH
3
COOH
utl.
utl.
CH
2
CO
2
2 H
2
O
C
O
+
+
etylobenzen
acetofenon
kwas benzoesowy
CrO
3
naftalen
1,4-naftochinon
O
O
COOH
COOH
O
3
naftalen
kwas o-ftalowy
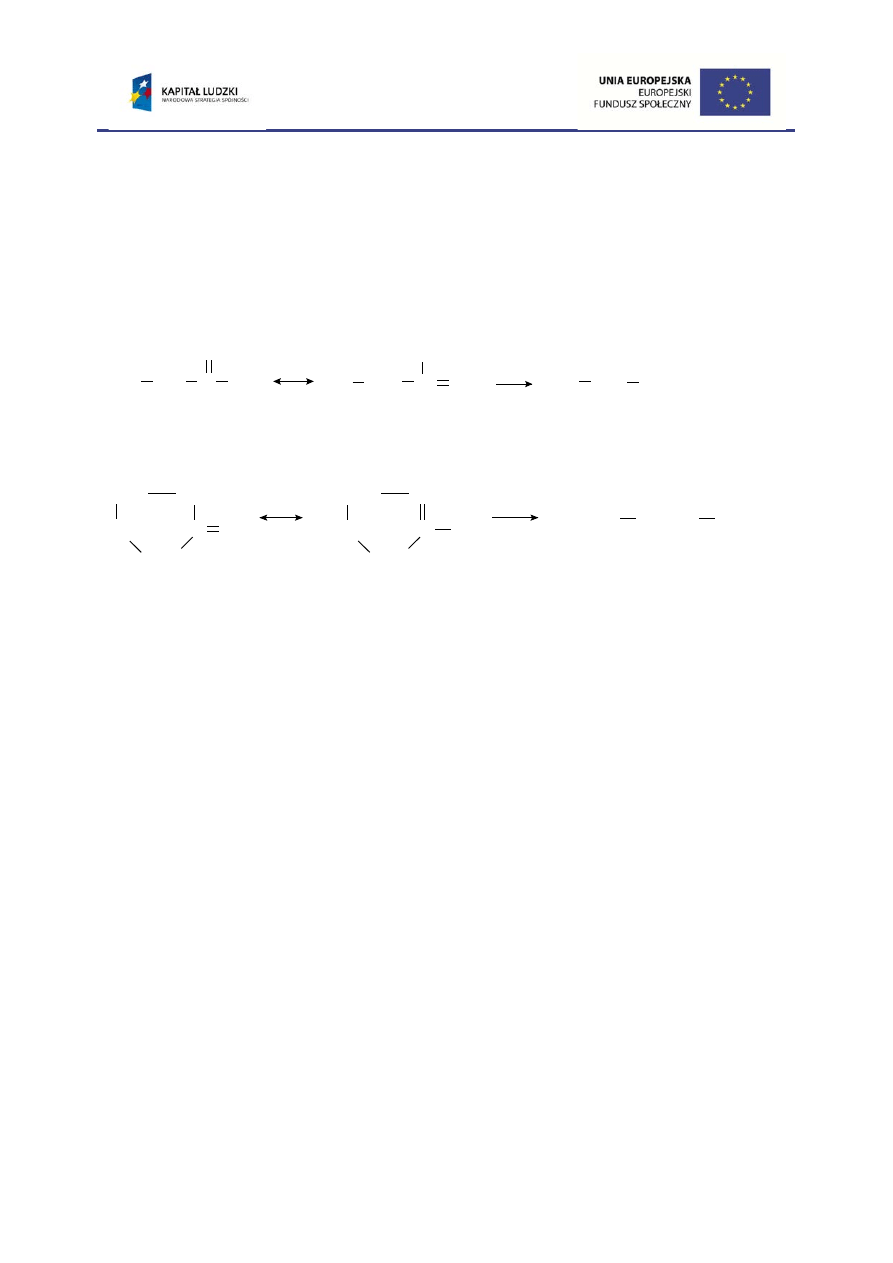
Projekt współfinansowany przez Unię Europejską
w ramach Europejskiego Funduszu Społecznego
4
6. Ketony (z wyjątkiem metyloketonów – instrukcja do Ćwiczenia 2) ulegają
utlenieniu
znacznie trudniej od aldehydów i dlatego utlenianie ketonów może
zachodzić tylko pod wpływem bardzo mocnych utleniaczy np. stężonego kwasu
azotowego(V). Podczas reakcji keton tworzy przejściowo postać enolową, której
podwójne wiązanie ulega rozerwaniu pod wpływem czynnika utleniającego.
Produktem utleniania ketonów łańcuchowych jest mieszanina dwóch kwasów
karboksylowych, a w przypadku utleniania ketonów cyklicznych – odpowiedni kwas
dikarboksylowy.
Doświadczenie 1. Otrzymywanie kwasu p-nitrobenzoesowego
S p r z ę t :
O d c z y n n i k i :
2
Kolby okrągłodenne 100 i 500 cm
3
szlif
p-Nitrotoluen
Zlewka 600 cm
3
Na
2
Cr
2
O
7
3 Menzurki 25,100 i 500 cm
3
H
2
SO
4
stężony
Wodna chłodnica zwrotna szlif
Węgiel aktywowany
Zestaw do sączenia
Zestaw do
sączenia pod zmniejszonym
ciśnieniem
W kolbie okrągłodennej o pojemności 100 cm
3
umieszcza się 2 g
p-nitrotoluenu, 8 g Na
2
Cr
2
O
7
i 20 cm
3
wody. Kolbę zaopatruje się w chłodnicę
zwrotną i dodaje porcjami przez górny otwór chłodnicy 14 cm
3
stęż. H
2
SO
4
stale
wstrząsając zawartością. Jeżeli reakcja nie rozpocznie się samorzutnie, to
mieszaninę reakcyjną ogrzewa się.
Po zakończeniu reakcji roztwór ogrzewa się do wrzenia przez 25 min., po czym
rozcieńcza 60 cm
3
wody, chłodzi, a wydzielony osad odsącza pod zmniejszonym
ciśnieniem. Otrzymany kwas krystalizuje się z 300 cm
3
wody, gotując go przez 10
min. z 1 g węgla aktywowanego. Wykrystalizowany produkt suszy się w suszarce
w
temp. 110°C, waży i oblicza wydajność procesu.
kwas propanowy
utl.
O
metanowy
kwas
HCOOH
+
CH
2
OH
COOH
C
C
CH
2
CH
2
CH
2
CH
3
CH
3
CH
3
CH
3
forma enolowa
butanon
forma enolowa
utl.
cyklopentanon
kwas pentanodiowy
CH
2
CH
2
CH
2
CH
2
C
CH
HOOC
COOH
OH
O
C
CH
2
CH
2
CH
2
(CH
2
)
3
Wyszukiwarka
Podobne podstrony:
Ferment alkohol to?ztlen niecałk rozkład związkó organic głównie utlenia cukrów
Aminy związki pochodne - ćw. 7, Rok I, Chemia organiczna
Utlenianie i redukcja związków organicznych, Technologia żywności i żywienia człowieka, Inżyneria ch
izomeria zwiazkow organicznych
NAUKA O ORGANIZACJI ĆW T6, Nauka o Organizacji
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
Analiza klasyczna związku organicznego I 2012
Identyfikacja zwiazkow organicznych
Izomeria związków organicznych
analiza zwiazkow organiczna id Nieznany (2)
chemia sprawdzian ze zwiazkow organicznych
Naturalne związki organiczne spotykane w życiu codziennym
sprawozdanie cw 3 chemia techniczna organiczna
Analiza klasyczna związku organicznego II 2012
ISE powtorka z chemii, ISE zwiazki organiczne zawierajace azot, P 8 Związki organiczne zawierając az
ROZDZIELANIE ORAZ SYNTEZA ZWIĄZKÓW ORGANICZNYCH
więcej podobnych podstron