ROZDZIAŁ II PODSTAWY BIOTECHNOLOGII
4. IMMOBILIZOWANE BIOKATALIZATORY
4.1. WSTĘP
Ze względu na wzrost zanieczyszczenia środowiska, brak paliwa, żywności dla ludzi i zwierząt, w szczególności łatwo przyswajalnego białka, zaczęto coraz częściej zwracać się do naturalnych źródeł energii, nowych źródeł żywności, metod produkcji podpatrzonych w przyrodzie. Dowodem na to może być wykorzystanie enzymów - katalizatorów biologicznych w wielu dziedzinach życia oraz procesach przemysłowych. Niestety są to procesy dość kosztowne ze względu na wysoką cenę biokatalizatorów natywnych. Problem ten próbowano rozwiązać stosując enzymy immobilizowane,
Immobilizacja jest zjawiskiem powszechnie występującym w przyrodzie. Wiele procesów enzymatycznych i mikrobiologicznych przebiega przy udziale enzymów i komórek związanych w sposób naturalny z rozpuszczalnymi lub nierozpuszczalnymi matrycami oraz nośnikami mechanicznymi.
Począwszy od lat 60-tych naszego stulecia obserwuje się dynamiczny wzrost zainteresowania immobilizowanymi biokatalizatorami, gdyż istnieje wiele korzyści płynących ze stosowania takiej formy enzymów.
Stosowanie enzymów w formie immobilizowanej ułatwia prowadzenie i kontrolę zarówno procesu okresowego jak i ciągłego. Immobilizacja umożliwia separację biokatalizatora z mieszaniny reakcyjnej. Oznacza to, że można go odzyskać i ponownie użyć w procesie okresowym lub stosować w procesach ciągłych. Zastosowanie immobilizowanych enzymów skraca wieloetapowe procesy i umożliwia prowadzenie ich w łagodniejszych warunkach (temperatura, ciśnienie), co pociąga za sobą likwidację części aparatury, zwiększenie stężenia biokatalizatora i szybkości rozcieńczenia. W efekcie prowadzi to do obniżenia kosztów operacyjnych aparatury.
Immobilizacja powoduje zwykle zwiększenie stabilności białek enzymatycznych. W odróżnieniu od natywnych enzymów, immobilizowane biokatalizatory są bardziej odporne na działanie podwyższonej temperatury, inhibitorów, odczynników chemicznych i wielu innych czynników niszczących białko enzymatyczne.
Zgromadzona wiedza o immobilizowanych enzymach jest dużym i bardzo użytecznym działem biotechnologii. Praktyczne zastosowanie jej nie tylko ułatwia i obniża koszty przeprowadzenia wielu procesów, ale także stwarza możliwości rozwoju nowych kierunków biotechnologii.
definicja
Istnieje kilka czynników sprawiających, że ogromny potencjał syntetyczny enzymów wykorzystywany jest na razie w ograniczonym zakresie. Obok przyczyn subiektywnych, wynikających z niedostatecznej znajomości współczesnej enzymologii, istnieje szereg przyczyn obiektywnych: wysoki koszt wyodrębniania i oczyszczania niektórych enzymów oraz większości kofaktorów. Wiele substancji będących przedmiotem współczesnej syntezy organicznej to hydrofobowe, słabo rozpuszczalne w wodzie substancje, których synteza pociąga za sobą konieczność tworzenia wiązań C-C oraz regioselektywnej funkcjonalizacji szkieletów węglowych. Substancje te różnią się niekiedy dość znacznie od naturalnych substratów, co powoduje, że aktywność enzymów w stosunku do nich jest niewystarczająca. Istnieje wreszcie szereg problemów technicznych związanych z trwałością biokatalizatorów, możliwością ich wielokrotnego użycia oraz efektywnym wyodrębnieniem produktu z mieszaniny poreakcyjnej. Wymienione przeszkody, stojące na drodze do szerszego stosowania enzymów w syntezie organicznej oraz w praktyce przemysłowej są usuwane przez rozwój enzymologii w kierunku określanym jako inżynieria enzymatyczna, która obejmuje m.in.: immobilizację enzymów, katalizę enzymatyczną w rozpuszczalnikach organicznych, metody ukierunkowanej mutagenezy i chemiczną modyfikację struktury centrum aktywnego.
Proces immobilizacji jest techniką wprowadzoną stosunkowo wcześnie do grupy metod usprawniających praktyczne wykorzystanie enzymów.
Unieruchomienie enzymów jest jedną z form ich modyfikacji. Enzymy te podzielono na dwa typy: inkludowane i związane. Pierwszy z tych typów podzielono na enzymy inkludowane w polimerach i mikrokapsułkowane, a drugi na zaadsorbowane i związane kowalencyjnie.
Najczęściej używaną ostatnio techniką immobilizacji jest kowalencyjne wiązanie enzymu do nośnika. Stosowane są wszelkiego rodzaju nośniki naturalne, w tym organiczne (celuloza, agaroza, chityna, skrobia) i nieorganiczne (szkło porowate, materiały ceramiczne, tlenki metali) oraz syntetyczne polimery [1]. Jedne z tych materiałów stosuje się jako nośniki bezpośrednio, inne muszą być poddane wstępnej, specjalnej obróbce chemicznej aktywatorami lub czynnikami modyfikującymi. Jeżeli na powierzchni nośnika są obecne grupy funkcyjne (hydroksylowe, aminowe, karboksylowe) zdolne do wstępowania w reakcję chemiczną z grupami funkcyjnymi enzymu z utworzeniem wiązań kowalencyjnych, to procedura otrzymywania immobilizowanego enzymu jest prosta; do roztworu enzymu wprowadza się nośnik i enzym przyłącza się do nośnika jednym lub większą liczbą wiązań kowalencyjnych.
Ścisły kontakt białka z nośnikiem może być niepożądany np. ze względu na ograniczenia dyfuzyjne. Wyjściem z takiej sytuacji jest oddalenie cząsteczki immobilizowanego enzymu od powierzchni nośnika. Można to uzyskać przez traktowanie nośników związkami o różnej długości cząsteczki. Mogą to być związki bifunkcyjne jak i złożone związki wielofunkcyjne. Wiele różnych możliwości kowalencyjnej immobilizacji enzymów istnieje również wówczas, gdy stosuje się jedynie enzym i czynnik sieciujący.
Białka można przyłączyć do nośnika lub czynnika sprzęgającego przez wiązania kowalencyjne amidowe, karbamidowe, disiarczkowe, estrowe lub przez tworzenie amin drugorzędowych czy związków azowych [3].
Immobilizacja enzymów ma pewne zalety. Przede wszystkim istnieje możliwość łatwego oddzielenia produktu od katalizatora oraz możliwość wielokrotnego użycia związanego enzymu. Reakcje katalizowane immobilizowanymi enzymami są zatem o wiele łatwiejsze do kontroli i automatyzacji. Ponadto, immobilizacja często pociąga za sobą wzrost trwałości termicznej enzymu oraz jego odporność na denaturację [1].
Unieruchomienie enzymów okazało się również doskonałą metodą ich stabilizacji w obecności różnych rozpuszczalników. Aby zachować właściwości katalityczne enzymów w systemach wodno-organicznych przy wysokich stężeniach składników organicznych koniecznością jest utrwalenie ich konformacji, która pozostaje aktywna nawet w warunkach całkowitego zniszczenia warstwy wody niezbędnej otaczającej cząsteczkę enzymu.
Innym aspektem immobilizacji jest zdolność nośnika do powodowania zmian w mikrośrodowisku w sąsiedztwie cząsteczek enzymów. Ma to swoje zalety wówczas, gdy preparat immobilizowanego enzymu zastosuje się w układzie wodno-organicznym. Jeżeli do unieruchamiania biokatalizatorów użyje się nośnika hydrofilowego, to nie można wykluczyć możliwości, iż faktyczna zawartość wody w pobliżu immobilizowanego enzymu jest większa niż w całej objętości układu, właśnie z powodu hydrofilowych właściwości nośnika [4]. Zastosowanie, z kolei, hydrofobowego nośnika rozwiązuje problem rozpuszczalności związków hydrofobowych w sąsiedztwie cząsteczki enzymu [5].
Oprócz wymienionych korzyści, immobilizowanie enzymów powoduje także niepożądane efekty, takie jak obniżenie powinowactwa do substratu, manifestujące się zwiększeniem stałej Michaelisa (KM) oraz zmniejszenie szybkości maksymalnej katalizowanej reakcji (VM). Efekty te tłumaczy się trudnościami sferycznymi w dotarciu substratu do enzymu, a także zmniejszoną dyfuzją [2].
Ważnym aspektem praktycznego wykorzystania katalitycznej własności enzymów jest możliwość prowadzenia reakcji enzymatycznych w rozpuszczalnikach organicznych [1].
Nośniki.
Przykładowo, celulozę dialdehydową (DAC) można otrzymać przez utlenienie celulozy Whatmana nadjodanem sodu. Stopień utlenienia celulozy określa się na podstawie przereagowania nadjodanu.
Aminową pochodną dialdehydowej celulozy (AC) można otrzymać przez mieszanie w ciągu 3 godzin w 55°C 2g DAC z 50cm3 5% roztworu siarczanu etylenodiaminy (EA) i następnie przez oddzielenie nośnika przez filtrację i przemycie wodą destylowaną.
Glutaraldehydową pochodną AC (GC) można z kolei otrzymać przez mieszanie w ciągu 3 godzin 1g AC z 44cm3 10% aldehydu glutarowego, oddzielenie nośnika i przemycie wodą.
Aktywacji celulozy Whatman można również dokonać, stosując metody: glutaraldehydową, diizocyjanianową, diazosprzęgania lub S-triazynową.
Sposób osadzania enzymu na nośnikach.
Do 30 cm3 roztworu proteinazy po I lub II etapie oczyszczania dodano 1 g uaktywnionego nośnika i pozostawiono na 24 godz. w 4°C przy ciągłym mieszaniu. Następnie nośnik oddzielono od roztworu, przemyto trzema porcjami 0,1% octanu wapnia i pozostawiono w temp. pokojowej przez 24 godziny celem wysuszenia. W przypadku celulozy uaktywnionej przez diazowanie, na uzyskany nośnik z osadzonym enzymem działano nasyconym roztworem -naftolu (zablokowanie wolnych grup diazowych), a następnie przemywano roztworami: 1 M glukozy, 1 M NaCl i 0,1% octanu wapnia.
Dialdehydowa celuloza jako nośnik do immobilizacji subtilizyny.
Dialdehydową celulozę DAC otrzymano przez utlenienie celulozy NaJO4. Na tak otrzymanym nośniku oraz na jego modyfikowanych etylenodiaminą (EA) i aldehydem glutarowym (GA) pochodnych (rys.1) osadzono subtilizynę z B.subtilis IBTC-3. W tabeli 1 przedstawiono wyniki immobilizacji subtilizyny z roztworu po I etapie oczyszczania (o aktywności właściwej rzędu 2,3 jA/g białka).
Rys. 1. Modyfikacja dialdehydowej celulozy (DAC) diaminą (EA) i aldehydem glutarowym (GA).
Przedstawione wyniki wskazują, że DAC jak i jej modyfikowane pochodne (AC i GC) w założonych warunkach eksperymentu nie są odpowiednimi nośnikami subtilizyny. Pomimo wiązania sporej ilości białka (do 70 mg/g), aktywność proteinazy na nośniku jest niewielka (sięgająca 0,6-2,8 mjA/g nośnika). Wydajność procesu immobilizacji subtilizyny w przeliczeniu na aktywność proteolityczną jest bardzo mała (0,1-0,49%). Wydajność procesu liczona względem aktywności esterazowej jest znacznie większa (około 10-krotnie) i sięga 2,3-5,1%. Zależność tą obserwowaną również przez innych autorów [2-4] można wytłumaczyć łatwiejszym dostępem do centrum aktywnego unieruchomionego enzymu mniejszego substratu jakim jest BAEE (ester etylowy N-benzoiloargininy) niż np. hemoglobiny czy kazeiny będących substratem przy oznaczaniu aktywności proteolitycznej.
Immobilizacja z zastosowaniem różnych metod aktywacji celulozy.
W następnych eksperymentach jako nośnik do immobilizacji subtilizyny zastosowano celulozę Whatmana aktywowaną: metodą glutaraldehydową, chlorkiem cyjanurowym, heksametylenodiizocyjanianem oraz przez diazowanie. W badaniach stosowano ciekłe preparaty subtilizyny po I i II etapie oczyszczania, odpowiednio o aktywności właściwej rzędu 2300 i 4000 mjA/g białka. Wyniki immobilizacji przedstawiono w tabeli 2.
Z tych czterech badanych metod, najlepsze rezultaty unieruchamiania subtilizyny zapewnia metoda aktywacji celulozy przy użyciu heksametylenodiizocyjanianu. Stosując oczyszczone po DEAE-celulozie roztwory enzymu o zawartości białka około 120 mg w przeliczeniu na 1 g nośnika i o aktywności właściwej sięgającej 4 jA/g białka) można uzyskać w optymalnych warunkach z dużą powtarzalnością immobilizowany preparat subtilizyny o aktywności proteolitycznej 68-72 mjA/g nośnika z wydajnością 14% i aktywności esterazowej 2,2-2,4 jE/g nośnika tj. ok. 40% wydajności teoretycznej (tab.3). Z przeliczeń teoretycznych, biorąc za podstawę aktywność właściwą homogennego preparatu natywnej subtilizyny równą 8,3 jA/g białka wynika jednak, że tylko 14-18% białka enzymatycznego związanego przez ten nośnik przejawia aktywność proteolityczną, natomiast prawie połowa nadal wykazuje aktywność esterazową. Immobilizacja subtilizyny na celulozie aktywowanej aldehydem glutarowym lub chlorkiem cyjanurowym prowadzi do inaktywacji jeszce większej ilości związanego białka (teretycznie 3% i odpowiednio 7% proteinazy w przeliczeniu na aktywność proteolityczną osadza się zaledwie w formie aktywnej). Najlepsze pod tym względem wyniki uzyskano przez diazosprzęganie enzymu z celulozą. Prawie 1/4 część związanego enzymu nadal przejawia aktywność proteolityczną i 57% aktywność esterazową.
Przyczyna utraty własności katalitycznych części cząsteczek leży, jak należy przypuszczać, w samej naturze budowy przestrzennej subtilizyny. Z uwagi na brak mostków disulfitowych -S-S- [13], rolę stabilizującą jej przestrzenną strukturę, pełnią wiązania jonowe -NH ... OOC- [14]. Wiązanie białka z wolnymi grupami aldehydowymi nośnika (co miało miejsce m.in. przy celulozie dialdehydowej lub metodzie glutaraldehydowej), zachodzi prawie wyłącznie poprzez wolne grupy aminowe enzymu, co prawdopodobnie niszczy część wiązań jonowych i powoduje destabilizację struktury proteinazy i w konsekwencji jej inaktywację. W przypadku aktywacji nośnika chlorkiem cyjanurowym, a zwłaszcza diizocyjanianem obok grup -NH2 , enzym wiąże się z nośnikiem poprzez grupy -OH [10,15]. Można założyć, że cząsteczki subtilizyny wiązane przez grupy -OH są nadal aktywne, natomiast te wiązane przez -NH ulegają w przeważającej części inaktywacji. Z kolei sprzęganie związków diazowych z białkiem zachodzi głównie poprzez łańcuchy boczne tyrozyny i histydyny [15]. Ta ostatnia jak wiadomo, wchodzi w skład centrum aktywnego subtilizyn [16] i stąd inaktywacja pewnej części cząsteczek tych enzymów podczas immobilizacji tą metodą. Gdyby nie względnie niska aktywność proteolityczna (do 30 mjA/g nośnika) metoda ta mogłaby być uznana za najlepszą spośród badanych. Niewielkie straty enzymu (ok. 16% w przeliczeniu na aktywność proteolityczną) umożliwiają powtórne użycie filtratu po oddzieleniu nośnika do procesu immobilizacji.
Przedstawione wyniki badań potwierdzają, że subtilizyny są enzymami trudnymi do immobilizacji. Główna tego przyczyna, jak w pośredni sposób wykazano, leży w przestrzennej budowie tych enzymów (brak wiązań -S-S-). Tym niemniej udało się znaleźć sposób (poprzez aktywację celulozy heksametylenodiizocjanianem) umożliwiający otrzymywanie z dużą powtarzalnością preparatów immobilizowanej subtilizyny B. subtilis IBTC-3, o aktywności proteinazy serynowej 68-72mjA/g nośnika i aktywności esterazowej 2,3jE/g nośnika. Wydajność procesu liczona względem aktywności proteolitycznej pomimo, że nie jest wysoka (14% teoretycznej), może być wystarczająca do podjęcia w małej skali opłacalnej produkcji tych preparatów.
4.1.2. Możliwości aplikacji enzymów proteolitycznych w środowisku niewodnym
Immobilizowane proteinazy (subtilizyna, trypsyna, pronaza) mogą być użyte w studiach nad degradacją białek (przy określaniu ich struktury), w procesie kontrolowanego otrzymywania hydrolizatów białkowych dla celów spożywczych i przy wytwarzaniu kosmetyków. Ogólnie stwierdza się, że immobilizacja tych enzymów wiąże się z utratą znacznej części ich wyjściowej aktywności [1]. Ponadto po immobilizacji, ich właściwa aktywność oznaczana wobec syntetycznych substratów (np. BAEE, ATEE itp.) jest większa od aktywności wyznaczanej wobec substratów białkowych (np. kazeiny) [1-4]. W prezentowanej pracy przedstawiono wyniki badań nad immobilizacją subtilizyny typu Novo (wytwarzanej pozakomórkowo przez B.subtilis IBTC-3) na nośnikach celulozowych, będące próbą wyjaśnienia przyczyn tego zjawiska.
Postęp, jaki współcześnie osiągnięto w dziedzinie enzymologii niewodnej, doprowadził do tego, iż pojawiło się wiele interesujących możliwości praktycznego zastosowania enzymów w środowisku rozpuszczalników organicznych. Do najczęściej używanych enzymów należą lipazy, esterazy i enzymy proteolityczne w tym: chymotrypsyna, subtilizyna, termolizyna i papaina [14].
W roztworach wodnych wymienione enzymy katalizują reakcje hydrolizy. Mechanizm działania tych enzymów jest dobrze znany, są one wysoko stabilne i ogólnie dostępne. Ponadto nie wymagają kofaktorów. Te atrybuty czynią je atrakcyjnymi w stosowaniu zarówno w wodzie jak i systemach wodno-organicznych. W środowisku rozpuszczalników organicznych enzymy te katalizują reakcje: estryfikacji, transestryfikacji, laktonizacji, tiotransestryfikacji, syntezy peptydów [5].
W 1975 roku Ingalls, Squires oraz Butler [15] ogłosili rezultaty badań nad syntezą estrów N-acetylo-L-tyrozyny katalizowaną przez chymotrypsynę i subtilizynę Carlsberg w mieszaninie etanolu i glicerolu. Szybkość reakcji estryfikacji oraz wydajność zostały przedstawione jako funkcja zawartości wody w środowisku reakcji. Subtilizyna Carlsberg, w formie natywnej, katalizowała estryfikację przy nawet 2% zawartości wody. Maksymalną szybkość reakcji syntezy estrów zaobserwowano w układzie syntetycznym z zawartością wody 5-15%. Zawartość wody w środowisku reakcji chymotrypsyny musiała być większa-wynosiła 50%-poniżej tej wartości nie zmodyfikowany enzym nie katalizował reakcji estryfikacji.
Aby umożliwić pracę przy niższych stężeniach wody, a tym samym zwiększyć uzysk estru zastosowano immobilizowaną chymotrypsynę i subtilizynę Carlsberg. Wydawałoby się, że unieruchomiona subtilizyna powinna katalizować reakcję syntezy estru N-acetylo-L-tyrozyny przy znacznie niższej zawartości wody niż enzym w formie natywnej. Jednakże Ingalls i współpracownicy stwierdzili, iż jej kowalencyjne związanie z nośnikami: CM-celulozą, AE-celulozą i innymi, powoduje inaktywację enzymu. Jedynie subtilizyna immobilizowana przez adsorpcję na szkle porowatym i celulozie wykazywała niewielką aktywność w reakcji estryfikacji. W późniejszych latach także Kise, Hayakawa i Noritomi [13] badali zdolność katalizowania reakcji estryfikacji N-acetylo-L-tyrozyny i N-acetylo-L-tryptofanu przez chymotrypsynę i subtilizynę Carlsberg. Jako środowisko reakcji zastosowali etanol i stwierdzili, iż oba enzymy w formie natywnej funkcjonują w nim przy zawartości wody mniejszej niż 10%. Zaobserwowali oni również, że jeżeli stężenie wody wynosi więcej niż 10% to szybkość syntezy estrów ulega spowolnieniu. Kise i wsp. prowadzili również doświadczenia z chymotrypsyną i subtilizyną BPN' immobilizowanymi na różnego typu nośnikach. Największe wydajności w syntezie estrów uzyskali dla chymotrypsyny związanej z CM-celulozą czy chitozanem, a w przypadku subtilizyny BPN' związanej z chitozanem i TEAE-celulozą (reakcje przebiegały w etanolu przy zawartości wody 2,4%).
Okazało się również, że chymotrypsyna i subtilizyna Carlsberg są aktywnymi katalizatorami transestryfikacji estru metylowego N-acetylo-L-tyrozyny w etanolu, także przy stężeniu wody niższym niż 10%. Aktywności katalityczne w transestryfikacji w etanolu danych enzymów proteolitycznych znacznie wzrosły dzięki procesowi ich immobilizacji [13].
Inny rodzaj reakcji syntezy katalizowanej przez enzymy proteolityczne, to synteza peptydów. Procesy te prowadzi się w dwu alternatywnych wodno-organicznych układach syntetycznych: woda/rozpuszczalnik organiczny hydrofobowy bądź woda/rozpuszczalnik hydrofilowy. Syntezę peptydów w układzie difazowym katalizowaną przez wolną i immobilizowaną chymotrypsynę opisali m.in. Semenov i wsp.[16]. Największą zaletą układu woda/rozpuszczalnik hydrofobowy jest jego niewielki wpływ na strukturę enzymu, nawet w przypadku wysokiego stężenia użytego solwentu [17]. Z kolei, dużą wadą tego systemu reakcyjnego jest niska rozpuszczalność pochodnych substratów i produktów [13], jak również powolny przebieg reakcji [18]. Homandberg i wsp. [19] zaproponowali w 1978 roku metodę syntezy peptydów katalizowaną przez wolną chymotrypsynę z zastosowaniem układu woda/rozpuszczalnik hydrofilowy (etanol, polialkohole). Okazało się jednak, że gdy stężenie kosolwentu wynosiło ponad 50% peptydy nie były syntetyzowane ze względu na inaktywację chymotrypsyny. W późniejszych latach Nilsson i Mosbach [17] ogłosili, iż chymotrypsyna immobilizowana na agarozie aktywowanej przez chlorek tresylu posiada większą trwałość w środowisku monofazowym i może katalizować reakcję syntezy peptydów z N-acetlowych estrów aminokwasów i amidów aminokwasów. Stwierdzili ponadto, iż wydajność syntezy wzrastała wraz ze wzrostem stężenia składnika organicznego środowiska reakcji (np. w 90% butanodiolu wydajność była wyższa niż w 50%). Zaobserwowali również, że dzięki użyciu sześciokrotnie większej ilości Ala-NH2 w porównaniu z ilością N-acetylo-L-Phe-OMe wydajność uzyskanego dipeptydu wynosiła 97% w 50% DMF. Oprócz DMF, Nilsson i Mosbach, w swych doświadczeniach, zastosowali inne rozpuszczalniki np.: aceton, glicerol czy 1,4-butanodiol. Jak wynika z badań, użycie acetonu lub DMF korzystniej wpływa na wydajność peptydów niż glicerolu czy butanodiolu (użytych w tych samych stężeniach) [17].
Z kolei, Kise , Fujimoto i Noritomi [18] prowadzili próby nad syntezą peptydów z N-acetylo-L-Tyr-OEt i amidem glicyny katalizowaną przez chymotrypsynę w DMF lub acetonitrylu zawierającymi niewielką ilość wody. W tych systemach reakcyjnych, wytrącony osad soli fosforanowej, która została użyta jako składnik roztworu buforowego, działał prawdopodobnie jak nośnik chymotrypsyny. Wydajność peptydów po 24 godzinach reakcji zależała od zawartości wody w środowisku reakcji - maksymalna wydajność peptydu została uzyskana przy zawartości wody poniżej 10%. Dodatek amin trzeciorzędowych np. trietyloaminy znacznie podwyższył wydajność. Również immobilizacja enzymu na chitozanie czy TEAE-celulozie dała duże wydajności w syntezie peptydów w etanolu przy zawartości wody poniżej 10%.
Wolne i immobilizowane subtilizyny: Carlsberg oraz BPN' również są efektywnymi katalizatorami reakcji syntezy peptydów w systemach wodno-organicznych z niską zawartością wody [18].
Na przestrzeni ostatniej dekady prowadzono intensywne badania nad izolacją dużej liczby krótkich aktywnych peptydów oraz zrozumieniem ich biologicznych funkcji. Konsekwencją tego był wzrost zainteresowania zastosowaniem oligopeptydów jako dodatków do leków czy żywności. Jednakże, na przeszkodzie stoją takie ograniczenia, jak: niska produktywność w syntezie peptydów w systemach wodno-organicznych oraz niemożność stosowania tak uzyskanych peptydów jako dodatków do żywności. Jednakże Lopez-Fandino i wsp. [20] stwierdzili na podstawie badań, iż reakcje syntezy z użyciem różnorodnych enzymów: chymotrypsyny, subtilizyny Carlsberg, proteinazy K, pronazy E, termolizyny bądź papainy mogą być katalizowane w środowisku mieszanin eutektycznych, w obecności niewielkich ilości solwentów (glicerolu, etanolu, octanu 2-metoksyetylu). Efektem tego jest pozyskanie bioaktywnych di-, tri- i pentapeptydów (aspartam, angiotensyna, enkefaliny) w skali preparatywnej.
Ponadto, subtilizyna z Bacillus subtilis została użyta do regioselektywnej katalizy acylacji di- i oligosacharydów (włączając acylację z użyciem pochodnych aminokwasów) w niewodnym dimetyloformamidzie. Ten zaskakujący wynik pokazał, iż nie wszystkie enzymy są inaktywowane przez ten rozpuszczalnik; ma to duże znaczenie dla acylacji węglowodanów, ponieważ dimetyloformamid jest znakomitym rozpuszczalnikiem dla oligosacharydów.
Inna możliwość aplikacji enzymów proteolitycznych to kataliza regiospecyficznej oksydacji steroidów bez użycia oksydoreduktaz. Proces ten polega na estryfikacji steroidów w acetonie i chemicznemu utlenieniu pozostałych wolnych grup hydroksylowych [5].
4.2. Nośniki i metody stosowane do immobilizacji proteinaz.
Immobilizacja (unieruchomienie) jest techniką wprowadzoną stosunkowo wcześnie do arsenału metod usprawniających praktyczne wykorzystanie enzymów. Pierwsze doniesienia na temat adsorbcji enzymów na nośnikach ukazały się prawie 70 lat temu. Immobilizacja enzymów odbywa się poprzez przyłączenie do stałego nośnika w drodze adsorbcji, inkluzji w matrycy polimerycznego żelu lub kowalencyjnego związania z aktywnymi grupami nośnika [1].
4.2.1. Inkluzja enzymów.
Enzymy mogą być immobilizowane przez zamknięcie w usieciowanym polimerze, a proces inkluzji może być realizowany przez polimeryzację monomeru jedno- i dwufunkcyjnego (czynnik sieciujący), w obecności wodnego roztworu enzymu, stosując jako inicjatory nadsiarczyny [2]. Najczęściej stosowano żel poliakryloamidowy, w którym immobilizowano wiele enzymów. Proces immobilizacji może być przeprowadzony metodą blokową lub suspensyjną. Żel otrzymany metodą blokową rozdrabnia się mechanicznie, uzyskując cząstki żelu o nieregularnym kształcie i rozmiarach. Jest to powodem ścierania się cząsteczek podczas mieszania, prowadzi do obniżenia aktywności enzymu, co utrudnia stosowanie tego żelu w reaktorach.
W metodzie suspensyjnej, wodny roztwór enzymu z monomerami (akryloamid i N,N'-metyleno-bis-akryloamid) i inicjatorem (nadsiarczan i tetrametyloetyleno-diamina) rozprasza się w organicznej fazie (np. toluen z chloroformem) przy użyciu detergentu (Span 85) jako stabilizatora suspensji. Otrzymuje się sferyczne granulki żelu, których średnicę można regulować warunkami polimeryzacji . Podczas immobilizacji galaktozydazy przez polimeryzację suspensyjną, zastosowano inhibitor enzymu (lakton kwasu glukonowego lub galaktorunowego) oraz glutation i ditiotreitol, środki ochraniające enzym przed dezaktywacją [2]. W żelu alginianu wapniowego immobilizowano inulazę i oksydazę glukozy, Otrzymując preparat w postaci włókien. Przykładem nieorganicznego żelu może być kwas polikrzemowy, w którym inkludowana cholinoesteraza zachowała 90% aktywności [2].
Proces inkluzji enzymów może być także inicjowany promieniowaniem γ. Sposób ten umożliwia prowadzenie procesu w niskiej temperaturze, co pozwala zachować wysoką aktywność enzymu. Możliwe jest także wyeliminowanie chemicznego środka sieciującego, lecz w celu usieciowania polimeru konieczne jest zastosowanie większej dawki promieniowania, co prowadzi do obniżenia aktywności enzymu [2].
Promieniowanie γ w procesie inkluzji enzymów zostało po raz pierwszy użyte przez Maedę i wsp [2]. Autorzy ci immobilizowali glukoamylazę, inwertazę i -galaktozydazę w żelu poliakryloamidowym w temperaturze pokojowej. W celu usieciowania polimeru zastosowano bardzo dużą dawkę promieniowania (1-2 Mradów). Immobilizowane enzymy nie ulegały wymywaniu w żelu, a ich aktywność wynosiła 80-90% aktywności enzymów natywnych.
4.2.2. Mikrokapsułkowanie.
Metoda ta polega na zamknięciu wodnego roztworu enzymu w mikrokapsułkach z półprzepuszczalnych, syntetycznych membran, przez które mogą dyfundować tylko małocząsteczkowe związki. Mikrokapsułkowane enzymy mogą być otrzymywane metodą polikondensacji na granicy faz, najczęściej chlorku sebacylu i diaminoheksanu, międzyfazowej koacerwacji i podwójnego emulgowania [55,56]. Metoda międzyfazowej polikondensacji i koacerwacji wymaga stosowania inertnych wypełniaczy, którymi najczęściej są 10% hemoglobina, albumina lub żelatyna, a dla enzymów proteolitycznych stosowano polietylenoiminę [57]. Wypełniacze utrzymują kulisty kształt mikrokapsułki, a także w niektórych przypadkach stabilizują inkludowany enzym. W metodzie podwójnego emulgowania, roztwór wodny enzymu dyspergowano w roztworze polimeru (głównie estry lub etery celulozy) rozpuszczonego w rozpuszczalniku organicznym, otrzymując mikrokapsułki polimeru, zawierające w swoim wnętrzu mikrokropelki z roztworem enzymu [55]. Enzym immobilizowany w mikrokapsułkach znajduje się w roztworze w stanie wolnym, a jego stabilność nie jest zbyt duża. Dlatego często mikrokapsułkowane enzymy poddaje się sieciowaniu lub mikrokapsułkuje się enzymy uprzednio zaadsorbowane, związane kowalencyjnie lub inkludowane w innym nośniku [55].
4.2.3. Adsorbcja enzymów na jonitach i sorbentach.
Immobilizowanie enzymów przez adsorbcję jest stosowane ze względu na łatwość przeprowadzenia tego procesu oraz możliwość regeneracji nośników. Niestety wiązania pomiędzy enzymami a sorbentami nie są trwałe i pod wpływem stężonych roztworów soli lub substratów enzymy ulegają desorbcji. Od dawna stosowane są CM- i DEAE-polisacharydy, węgiel aktywny, żelatyna, szkło porowate, żel krzemionkowy, syntetyczne jonity [34]. Do swoistej sorbcji niektórych glikoproteidowych enzymów można zastosować immobilizowaną konkanawalinę A (Con A). Jest to lektyna wydzielona z fasoli, wykazująca duże biopowinowactwo do glikoprotein, posiadających reszty -D-mannozy i -D-glukozy. Con A kowalencyjnie związaną z agarozą lub Sepharose zastosowano do immobilizowania inwertazy z drożdży [59,60], karboksypeptydazy Y z drożdży [61] i oksydazy glukozy z Aspergillus niger [60]. Stwierdzono iż wraz ze wzrostem ilości Con A związanej z Sepharose 4B, maleje procent zachowanej aktywności immobilizowanej oksydazy glukozy lub inwertazy [60].
Zjawisko spadku procentowej zachowanej aktywności wraz ze wzrostem ilości związanego enzymu jest często obserwowane podczas immobilizacji biokatalizatorów różnymi metodami. Sorbenty zawierające długie łańcuchy alifatyczne [62-64] lub pierścienie aromatyczne [65-67] stosowano do immobilizacji enzymów na zasadzie hydrofobowej sorbcji. Stwierdzono, że ze wzrostem długości łańcucha alifatycznego, zwiększała się ilość zaadsorbowanego enzymu, lecz malała aktywność z powodu dezaktywującego działania hydrofobowych grup nośnika.
Do adsorbcji enzymów stosuje się także Tritylo-agarazę lub Tritylo-Sepharose [67,68]. Nośnik ten w łagodnych warunkach wiąże wiele enzymów. Jego pojemność jest duża, a immobilizowane w ten sposób enzymy zachowują 60 - 100% aktywności. Stwierdzono że Tritylo-Sephadex G10 zupałnie nie wiązał enzymów, lecz adsorbował ilościowo detergenty, co wykorzystano do oddzielenia tych ostatnich od enzymów [68].
Orginalny sposób immobilizowania enzymów przedstawił Furusaki i Asai [69]. Za pomocą pola elektrycznego, wprowadzili oni amyloglukozydazę do wnętrza porowatej membrany teflonowej, pokrytej jednostronnie poliuretanem. Podczas reakcji enzymatycznej, enzym utrzymywany był w membranie przez pole elektryczne, a następnie można go było usunąć przez przyłożenie przeciwnego pola elektrycznego [69]. Silną hydrofilowość osiągnięto przez zastosowanie nowego akrylowego monomeru: N-akryloilo-2-amino-2-hydroksymetylo-1,3-propandiolu oraz hydrofilującego czynnika sieciującego, diallilodiamidu kwasu winowego. Nośnik ten posiada kationowe (CM i SP) lub aminowe (DEAE) grupy jonowymienne.
4.2.4. Immobilizowanie przez kowalencyjne wiązania.
Do immobilizacji enzymów metodami chemicznymi można stosować różnorodne materiały: nieorganiczne (szkła, materiały ceramiczne, tlenki metali itd.), naturalne polimery (celuloza, chityna, agaroza, skrobia i inne polisacharydy) oraz syntetyczne polimery i kopolimery. Jedne z tych materiałów stosuje się jako nośniki bezpośrednio, inne muszą być poddane wstępnej obróbce chemicznej aktywatorami lub czynnikami modyfikującymi.
Można wyróżnić trzy zasadnicze elementy chemicznej konstrukcji preparatów. Są nimi: cząsteczka enzymu (E), nośnik (N) i czynnik sprzęgający (W). Pojęcie kowalencyjnej immobilizacji oznacza więc utworzenie konstrukcji, złożonej z połączonych wiązaniami chemicznymi trzech elementów N-W-E (jako maksimum) lub dwóch elementów N-E albo W-E (jako minimum). Zasady odpowiednich koniugatów można poglądowo określić jako bezpośrednie przyłączenie do nośnika
(dla N-E), pośrednie przyłączenie do nośnika (dla N-W-E) i sieciowanie (dla W-E).
Do roztworu enzymu wprowadza się nośnik i enzym przyłącza się do nośnika jednym lub większą liczbą wiązań kowalencyjnych (rys. 11a).
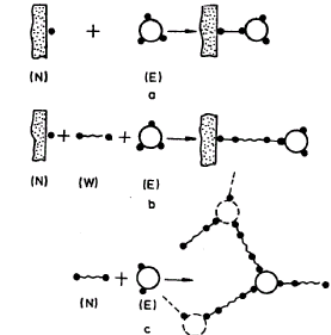
Rys.1. Schemat kowalencyjnej immobilizacji enzymów.
E-enzym; N-nośnik; W-czynnik sprzęgający
Ścisły kontakt białka z nośnikiem może być niepożądany, np. ze względu na niekorzystne zmiany mikrośrodowiska oraz ograniczenia sferyczne i dyfuzyjne. Wyjściem z takiej sytuacji jest oddalenie cząsteczki immobilizowanego enzymu od powierzchni nośnika. Można to uzyskać przez traktowanie nośników zwązkami o różnej długości cząsteczki. Mogą to być zarówno proste związki dwufunkcyjne, posiadające dwie jednakowe lub różne reaktywne grupy chemiczne, jak i złożone związki wielofunkcyjne, np. mające człony o różnej budowie, połączone wiązaniami o różnej trwałości. Wspólną zasadą kowalencyjnej immobilizacji jest w tym przypadku przyłączenie enzymu do nośnika za pośrednictwem czynnika sprzęgającego (rys 1b).
Wiele różnych możliwości kowalencyjnej immobilizacji enzymów istnieje również wówczas, gdy stosuje się jedynie enzym i czynnik sieciujący, a nośnik jako ciało stałe powstaje dopiero w procesie immobilizacji albo sam enzym staje się równocześnie nośnikiem. W tych przypadkach można mówić o kowalencyjnym "wszywaniu" cząsteczki enzymu w różne typy sieci (rys. 1c).
Jedynym lub głównym składnikiem każdego enzymu jest białko. Jest ono złożone z jednego lub kilku łańcuchów polipeptydowych. Oprócz białka enzymy mogą zawierać również składniki niebiałkowe: grupy prostetyczne o charakterze nieorganicznym i organicznym, lipidy (w lipoproteinach), i węglowodany (w glikoproteinach). Chemiczne metody immobilizacji są ukierunkowane na modyfikację białkowej części cząsteczki enzymu.
Immobilizacja enzymu przez kowalencyjne wiązanie daje najlepsze wyniki w przypadku stabilizacji enzymów. Kowalencyjne połączenie enzymu z nośnikiem zapewnia dużą trwałość powstałego koniugatu. Zmiany pH i temperatury nie powodują desorbcji enzymu z nośnika i tym samym nie następuje zanieczyszczenie końcowych produktów katalizowanej reakcji. Jest to szczególnie ważne w przypadku preparatów przeznaczonych dla medycyny i przemysłu spożywczego oraz wykorzystanych w analityce.
4.3. Zastosowanie preparatów immobilizowanych proteinaz.
Immobilizowane enzymy i komórki zostały już zastosowane w przemyśle (farmaceutycznym, organicznym i spożywczym), w praktyce biochemicznej i chemicznej, a także w analityce. Ponadto badania prowadzone w wielu ośrodkach naukowych i przemysłowych zmierzają do zastosowania immobilizowanych enzymów w ochronie środowiska, w medycynie, a także w produkcji energii.
Proteinazy w formie immobilizowanej są wykorzystywane do oczyszczania ścieków. Ścieki przemysłu mleczarskiego zawierają głównie zanieczyszczenia organiczne. Do nich należą w różnych stosunkach ilościowych kazeina i inne białka, laktoza oraz tłuszcze. Ścieki z hal uboju zawierają przede wszystkim składniki organiczne, jak krew, treść przewodu pokarmowego i inne. W wielu krajach ścieki przemysłowe oczyszczane są w oczyszczalniach, w których dominującą rolę odgrywają złoża biologiczne różnych konstrukcji. Ścieki oczyszczane są metodą osadu czynnego. Z uwagi na skład chemiczny ścieków mleczarskich (duże ilości białka głównie kazeiny) i ścieków przemysłu mięsnego (pewne ilości hemoglobiny) pożądane jest aby w skład osadu czynnego wchodziły bakterie produkujące enzymy proteolityczne o dużym powinowactwie do kazeiny i hemoglobiny. Tę właściwość wykazują właśnie proteinazy.
Bar-Eli i Katchalski zastosowali unieruchomioną trypsynę w badaniach degradacji białek i peptydów w celu oznaczenia ich składu aminokwasowego. Abel i Hofsten użyli unieruchomioną na agarozie proteinazę do degradacji mioglobiny.
Niektóre nierozpuszczalne pochodne enzymów proteolitycznych zastosowano w badaniach struktury pewnych białek fibrylarnych [51].
Subtilizyny są enzymami o bardzo szerokiej specyficzności substratowej. Ta szeroka specyficzność sprawia, że proteinazy serynowe Bacillus subtilis służą do otrzymywania hydrolizatów białkowych w przemyśle spożywczym, paszowym, kosmetycznym i farmacji.
Podjęto próby zastosowania immobilizowanych komórek drobnoustrojów do biosyntezy niektórych antybiotyków.
Immobilizowaną proteinazę wykorzystano do produkcji penicyliny. Zainteresowanie wzbudzają optycznie czynne D-aryloglicyny ze względu na możliwość wykorzystania ich w przygotowaniu półsyntetycznych penicylin na "cephalosporins". Związki te wydzielono z racemicznych mieszanin ich pochodnych z użyciem unieruchomionej subtilizyny w dwu fazowych systemach woda-rozpuszczalnik organiczny [57].
Immobilizowane biokatalizatory zastosowano do rozdziału racematów aminokwasów, do produkcji aminokwasów i niektórych kwasów organicznych. Pierwsze z tych związków są stosowane jako wartościowe dodatki do produktów żywnościowych i do mieszanek paszowych.
W firmie Corning Glass, do produkcji glukozy ze skrobi kukurydzianej użyto natywną -amylazę z Bacillus licheniformis, immobilizowaną na materiale ceramicznym [228, 229].
Aby zapobiec wytrącaniu się osadów z ochłodzonego, świeżego piwa, należy przepuścić ten napój przez kolumnę z immobilizowaną papainą [197]. Powoduje ona stabilizację piwa przez usuwanie zmętnień białkowych.
Immobilizowaną trypsynę i subtilizynę zastosowano do syntezy estrów peptydów [243].
Immobilizowane proteinazy wykorzystano także w selektywnej izolacji rodzimego pochodzenia inhibitorów proteinaz [52]. Związaną kowalencyjnie z Sepharose 4B trypsynę zastosowano do oczyszczania niektórych polipeptydowych inhibitorów trypsynowych, takich jak: zasadowego trzustkowego inhibitora [245], inhibitora z nasion dyni [246] i inhibitora z gryki [247]. -chymotrypsynę związaną z usieciowanym alkoholem poliwinylowym stosowano do izolowania występujących w naturze inhibitorów -chymotrypsyny o małej i dużej masie cząsteczkowej [53].
Immobilizowane proteinazy (pronaza, subtilizyna, trypsyna) mogą być używane do kontrolowanej hydrolizy stężonych protein żywnościowych i w przygotowaniu kosmetyków [35]. Chymotrypsynę, kowalencyjnie związaną z rozpuszczalnym dekstranem, stosowano w ultrafiltracyjnym reaktorze do hydrolizy kazeiny [24].
Unieruchomione enzymy znalazły również zastosowanie jako modele do badań kinetyki enzymów natywnych, naturalnie unieruchomionych w biologicznych membranach i w strukturach wewnątrzkomórkowych [54,55]. Badania te pozwoliły na wyjaśnienie niektórych zagadnień związanych z aktywnym transportem oraz zjawiskami elektrostatycznymi i dyfuzyjnymi zachodzącymi w żywych komórkach.
Immobilizowane enzymy znalazły zastosowanie w analityce do oznaczania substancji będących substratami, aktywatorami lub inhibitorami enzymów. Użycie swoistych enzymów pozwala na selektywne i czułe oznaczanie we krwi, moczu, bezpośrednio w tkankach i innych biologicznych obiektach, fizjologicznych substratów, takich jak: mocznik, kwas moczowy, glukoza i inne cukry, lipidy i fosfolipidy, cholesterol, etanol, aminokwasy, nukleotydy i antybiotyki [248-251].
Wykorzystując hamujące działanie niektórych substancji, immobilizowane enzymy użyto do ciągłej kontroli stężenia w powietrzu i wodzie takich toksycznych substancji jak: fenole, aromatyczne aminy, związki fosforu i siarki, środki ochrony roślin [250,252]. Opracowano także metody oznaczania jonów metali, nieorganicznych anionów (NO2-, NO3-, CN-, S2-, PO43- i inne) i innych nieorganicznych substancji (np. NH3, O2, H2O2) [250].
Przewiduje się że w przyszłości zostanie rozszerzone spektrum zastosowania immobilizowanych biokatalizatorów.
Wyszukiwarka
Podobne podstrony:
Enzymy przemysłowe - 2008, Studia PŁ, Ochrona Środowiska, Biochemia, Biotechnologia
Semantyka pojęć biotechnologii, Studia PŁ, Ochrona Środowiska, Biochemia, Biotechnologia
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr2, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Zadanie końcowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
tabEnzymy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki
sprEnzymyII, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
tabKinetykaEnzymów, Studia PŁ, Ochrona Środowiska, Biochemia, laborki
bialka spr(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprKwasy nukleinowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
LABORATORIUM 4(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
LABORATORIUM Z BIOCHEMII 3(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprAminokwasy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
enzymy - sprawozdanie, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwieczenie nr8, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr5, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprOksydoreduktazy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
SPRAWOZDANIE 1 AMINOKWASY, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
kwasy nukleinowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
więcej podobnych podstron