Tadeusz Trzmiel
Instytut Biochemii Technicznej
Enzymy przemysłowe
(2008)
SPIS TREŚCI
1. Hydrolazy peptydowe
2. Endopeptydazy bakterii z rodzaju Bacillus
3. Kierunki wykorzystania endopeptydaz
4. Lipazy
EC 3.4. Hydrolazy peptydowe
EC 3.4.11.- 3.4.19. Peptydazy
EC 3.4.11. aminopeptydazy (hydrolazy α-aminoacylopeptydowe)
metaloenzymy (Zn, Ca),
niektóre wysoce specyficzne -np. z E.coli odrywają prolinę, argininę
z Costridium - pozakomórkowe!, aminopeptydaza I B.thermoproteolyticus
EC 3.4.16.-18. karboksypeptydazy (hydrolazy peptydyloaminoacylowe)
usuwają C-terminalny aminokwas
16. serynowe karboksypeptydazy
u wielu drobnoustrojów
szeroka specyficzność
pH= 4,5- 6,0
17. metalokarboksypeptydazy
podobne do karboksypeptydazy A
18. tiolowe lub cysteinowe
u Clostridium
EC 3.4.13 dipeptydazy (hydrolazy dipeptydowe)
powszechne u bakterii
niektóre wysoce specyficzne (np. karnozinaza- aminoacyl-histydyna)
centrum aktywne i warunki działania zróżnicowane
EC 3.4.14 peptydazy dipeptydylowe (dipeptydylopeptydazy )
usuwają N-terminalne dipeptydy
w centrum aktywnym -SH, podobne do katepsyny C
występują rzadko u bakterii
EC 3.4.15. karboksypeptydazy dipeptydylowe (peptydylo dipeptydazy)
usuwają N-terminalny dipeptyd
metaloenzymy (Zn) u E.coli cynkoglikoproteid
EC 3.4.19. Omegapeptydazy u B.subtilis !
odrywają aminoacyloacyl N-acetyl, N-formyl
EC 3.4.21.-3.4.99. Endopeptydazy
EC 3.4.21. Endopeptydazy serynowe
a) trypsynopodobne (u Streptomyces)
pH=8, pI=9, M=20000
specyficzność: Arg, Lyz (2 miejsca)
b) alkaliczne proteinazy (szeroko rozpowszechnione)
pH >10, pI=10, M= 15-30 tys.
brak cysteiny
specyficzność szeroka: aromatyczne, hydrofobowe (Leu, Tyr, Fen, )
1) subtilizyny Carlsberg i Novo
w 7 miejscach
2) subtilizyno-podobne (Streptomyces, Arthrobacter)
w 11 miejscach
3) wewnątrz komórkowe (np. endopeptydaza W, Bacillopeptydaza F)
wysoka aktywność esteraz
4) inne (np. z B.pumilis - hybryd, keratynaza ze Streptomyces fradie)
c) α-lityczne proteinazy (z Myxobacter)
elastazo- podobne
pH= 9, M=20000
specyficzność: Wal, Ala
brak aktyw. esteraz
d) proteinazy Staphylococus
pH= 3,5- 9,5 (hemogl.7,8), M= 12000
specyficzność: kw.Asp, Glu
e) proteinazy inne (np. z Gram - bakterii)
EC 3.4.22. Endopeptydazy tiolowe (u roślin)
a) Clostridiopeptydaza B
pH= 7, pI= 4,8, M= 50000
wrażliwa na czynniki redukujące HCN, cysteinę
specyficzność: jak trypsynopodobne
b) ze Streptpcocus papaino-podobne
pH=7,5, pI=8,4, M=32000
specyficzność: b.szeroka, w 10 miejscach identycznie jak papaina
EC 3.4.23. Endopeptydazy aspartylowe (kwaśne)
u pleśni i drożdży u B.cereus pepsyno-podobna
pH=3,5, pI= 4,3 M= 33000
specyficzność: Tyr, Fen z obu stron
EC 3.4.24. Metaloendopeptydazy
a) proteinazy obojętne
szeroko rozpowszechnione u bakterii
pH = 7, pI= 4-9, M=35-40000
w centrum katalitycznym Zn
specyficzność: 6 miejsc (Leu, Fen)
hydrolizują syntetyczne substraty
u rodzaju Bacillus kilka odmian (m.in. termolizyna, megateriopeptydaza
b) metaoloproteinazy alkaliczne
u bakterii G-, Pseudomonas (kolagenazo-podobne)
pH= 7-9, pI=5,5, M= 50-60000
w centrum Zn, Ca,
specyficzność: 3 miejsca (Asp, Glu, Cys-SO H)
hydrolizują syntetyczne substraty
c) proteinazy α-lityczne (z Myxobacter)
u Arthrobacter
pH= 9, M= 14000
d) proteinazy nielityczne z Myxobacter
pH= 9, M= 17000
EC 3.4.25.Endopeptydazy treoninowe
2. Endopeptydazy bakterii z rodzaju Bacillus
W tabeli 1 wyszczególniono najważniejsze ze znanych obecnie endopeptydaz (proteinaz) otrzymywanych z podłoży po hodowli bakterii z rodzaju Bacillus. Wszystkie są endopeptydazami serynowymi lub też metaloendopeptydazami. Jedynie wyjątkowo w filtratach pohodowlanych B.cereus znaleziono proteinazę aspartylową.
Tabela 1.Pozakomórkowe endopeptydazy bakterii z rodzaju Bacillus
Nazwa enzymu lub synonim |
Szczep |
Charakterystyczne właściwości |
Rok publi-kacji |
Subtilizyna Carlsberg |
B.subtilis
|
Endopeptydaza serynowa, pH 10,6 |
1947 |
Subtilizyna BPN` |
B.subtilis var. amylosacchariticus |
Endopeptydaza serynowa, pH 10,2 |
1958 |
Subtilizyna Novo |
B.subtilis
|
Endopeptydaza serynowa, pH 10,2 |
1960 |
Termolizyna
|
B.thermoproteolitycus |
Metaloenzym termostabilny, pH 7-9 |
1962 |
Obojętna proteinaza I |
B.subtilis |
Metaloenzym, pH 7,3 |
1964 |
Alkaliczna proteinaza |
B.licheniformis
|
Endopeptydaza serynowa, pH 10,6 |
1964 |
Proteinaza W1
|
mutant B.subtilis |
Endopeptydaza serynowa, pI 4.5 |
1965 |
Obojętna proteinaza II |
B.subtilis var. amylosacchariticus |
Metaloenzym, pH 7.3 |
1966 |
Bacillopeptydaza F |
mutant B.subtilis |
Endopeptydaza serynowa, pH 9.5 |
1968 |
Megateriopeptydaza |
B.megaterium
|
Metaloenzym, pH 7.5 |
1968 |
Alkaliczna Endopeptydaza |
B.alcalophilus
|
Endopeptydaza serynowa, pH 10.6, alkalostabilna |
1971 |
Mikroproteaza
|
B.cereus
|
Metaloenzym, Mr=34000 |
1974 |
Alkaliczna proteinaza |
B.alcalophilus subsp. halodurans |
Endopeptydaza serynowa, pH 11.5, alkalostabilna |
1991 |
Spośród serynowych endopeptydaz bakterie Bacillus wytwarzają głównie subtilizyny, subtilizyno-podobne enzymy i proteinazy wewnątrzkomórkowe (np. bacillopeptydazę F czy proteinazę W1). Do nielicznych należą szczepy produkujące proteinazy trypsyno- lub elastazopodobne.
Endopeptydazy serynowe wewnątrzkomórkowe charakteryzują się wysoką aktywnością esterolityczną, niskim pI, ścisłą zależnością od Ca+2 przy niewysokiej aktywności w stosunku do substratów białkowych.
Subtilizyny (EC 3.4.21.62.) występują w kilku odmianach różniących się właściwościami fizyko-chemicznymi (m.in. optymalnym pH, masą cząsteczkową, punktem izoelektrycznym, składem aminokwasowym, a także zdolnością do hydrolizy syntetycznych substratów). Dzieli się je na dwie grupy:
a) subtilizyny typu Carlsberg (dawniej subtilopeptydazy A), obejmujące alkaliczne proteinazy B.pumilus i B.licheniformis.
b) subtilizyny typu BPN` (dawniej subtilopeptydazy B), obejmujące subtilizyny BPN` i Novo, a także alkaliczne proteinazy B.subtilis NRRL B-3411 i B.subtilis var. amylosacchariticus.
Alkalofilne szczepy Bacillus, produkują subtilizyno-podobne proteinazy, odbiegające nieco właściwościami od typowych subtilizyn. Enzymy te wyróżniają się wysoce alkalicznym optimum pH działania, sięgającym nawet 11-12. Szczepy wytwarzające te enzymy (np. B.alcalophilus) rosną przy pH wyższym od 10. Niektórzy uważają, że enzymy te są pochodnymi subtilizyny Carlsberg. Jednakże własności immunologiczne alkalicznej serynowej proteinazy wytwarzanej przez B.alcalophilus subsp. haloduram odbiegają od własności subtilizyny Carlsberg i BPN`.
Pomimo wspomnianych różnic, wszystkie subtilizyny mają identyczne centrum aktywne, w którym decydującą rolę odgrywa seryna i przejawiają identyczny mechanizm działania. Wszystkie też ulegają całkowitej inhibicji przez DFP, który reaguje z seryną centrum aktywnego. Obok seryny, ważną rolę w ich funkcjonowaniu odgrywa histydyna znajdująca się w pozycji 64 oraz kwas asparaginowy w pozycji 32.
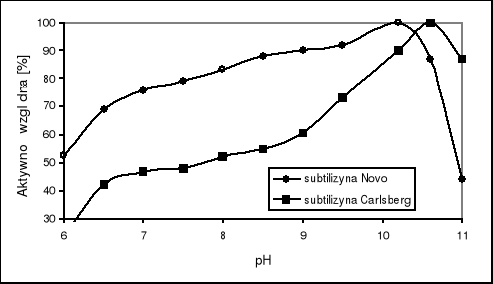
Optimum pH subtilizyn różni się nieco dla obu odmian enzymu (rys.2). Subtilizyny typu Carlsberg wykazują optimum pH równe 10,6 z zachowaniem 50% aktywności w pH 7,5. Subtilizyny typu BPN` charakteryzują się bardziej płaskim profilem zależności aktywności od pH w przedziale 7-10. Optimum wynosi 10,2 z zachowaniem 78% aktywności w pH 7,5.
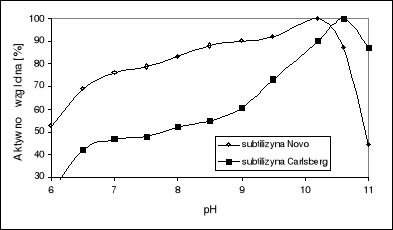
Rys. 2. Wpływ pH na aktywność subtilizyn
Subtilizyny znane są z niewrażliwości ich struktury na obecność związków denaturujących. Utrzymują aktywność proteolityczną i esteraz w stężonych roztworach mocznika, etanolu czy dioksanu, nie tracą również aktywności w środowisku silnie alkalicznym, w obecności detergentów, wybielaczy tkanin i środków piorących. Subtilizyny wykazują szeroką specyficzność substratową. Rozszczepiają ponadto estry różnych N-acetylowanych i N-benzoilowanych aminokwasów.
W celu lepszego poznania podstaw funkcjonowania subtilizyn, podejmowano próby zbadania ich struktury.
Wright i wsp. podjęli badania nad ustalenia struktury przestrzennej subtilizyn BPN' i Novo z użyciem metody rentgenograficznej. Z kolei, Bode oraz McPhalen [26, 27] starali się określić strukturę krystaliczną subtilizyny Carlsberg (w kompleksie z inhibitorem o nazwie eglin C, izolowanym z pijawki lekarskiej) również metodą krystalografii rentgenowskiej. Strukturę trójwymiarową proteinazy alkalostabilnej PB 92 ustalili van der Laan i Dijkstra.
Ich badania ujawniły, iż struktury tych enzymów wykazują wysoki stopień podobieństwa.
Subtilizyny są białkami globularnymi. Centrum aktywne ulokowane jest w stosunkowo płytkim zagłębieniu na powierzchni cząsteczki.
W subtilizynach BPN', Novo oraz Carlsberg wyróżniono siedem odcinków struktury równoległej β znajdujących się w centrum cząsteczki oraz dziewięć odcinków α-helisy. Dwie z nich są ukryte we wnętrzu cząsteczki, pozostałe siedem (amfipatycznych) leży na jej powierzchni. Zauważono, jednakże, że istnieją pewne niewielkie różnice pomiędzy subtilizynami BPN', Novo oraz Carlsberg w pozycji zajmowanej przez jeden z zewnętrznych łańcuchów α-helikalnych wynikającą z odmiennego składu aminokwasowego.
Proteinazę alkalostabilną PB 92 tworzy dziewięć nici β i siedem struktur α-helikalnych. Tak jak w przypadku wyżej opisanych subtilizyn, siedem odcinków struktury równoległej β oraz dwie α-helisy stanowią centrum molekuły zamknięte przez pięć amfipatycznych α-helis i dwa odcinki przeciwrównoległe β.
Subtilizyny wykazują zdolność do wiązania przynajmniej dwóch jonów Ca2+, a dwa miejsca wiążące te jony są usytuowane podobnie w każdej z nich. Martin, Mulder i wsp.[23] podjęli próby zbadania struktury proteinazy PB 92 w roztworze przy użyciu spektroskopii NMR. Wyszli oni z założenia, iż uzyskane tą metodą dane mogą dostarczyć więcej informacji o mechanizmach funkcjonowania subtilizyn, tym bardziej, że w formach krystalicznych tych enzymów, w ich miejscach wiążących obecne są pewne zniekształcenia. Ich obecność może być przyczyną zafałszowania rzeczywistych informacji na temat tych kluczowych regionów cząsteczek subtilizyn.
Wykazali oni, iż struktura proteinazy alkalostabilnej w roztworze jest sztywna, wyjąwszy określoną liczbę miejsc. Wśród nich znajduje się miejsce wiążące substrat. Mobilność miejsca wiążącego potwierdza zaproponowany wcześniej mechanizm indukowanego dopasowania do substratu.
Subtilizyny znane są z niewrażliwości ich struktury na obecność biopolimerów denaturujących. Utrzymują one aktywność proteolityczną i esterazową w stężonych roztworach mocznika, etanolu, dioksanu czy chlorowodorku guanidyny. Subtilizyny nie tracą aktywności w środowisku silnie alkalicznym, w obecności detergentów, wybielaczy tkanin i środków piorących. Subtilizyny wykazują szeroką specyficzność substratową. Rozszczepiają one estry różnych N-acetylowanych i N-benzoilowanych aminokwasów.
W literaturze opisano przykłady wykorzystania subtilizyn jako katalizatorów w reakcjach syntez różnorodnych związków. We wczesnych etapach rozwoju biotechnologii uznawano, że enzymy te mają niewielki potencjał syntetyczny. W środowisku wodnym równowaga rzeczywiście przesunięta jest na korzyść hydrolizy. Jednakże zmiana warunków środowiska reakcji poprzez dodanie rozpuszczalników organicznych i jednoczesne obniżenie zawartości wody, może przesunąć równowagę reakcji tak, aby uzyskać użyteczną proporcję produktów syntezy.
Znane są gatunki bakterii z rodzaju Bacillus pozakomórkowo wydzielające do podłoża subtilizyny łącznie z meteloendopeptydazami (np. B.subtilis, B.amyloliquefaciens, B.subtilis var. amylosacchariticus), produkujące wyłącznie subtilizyny (np. B.pumilus, B.licheniformis i B.mesentericus) albo też wyłącznie metaloproteinazy. Do tych ostatnich należą B.megaterium wytwarzający megateriopeptydazę, B.thermoproteoliticus wytwarzający termolizynę czy B.cereus produkujący "mikroproteazę".
Pozakomórkowe metaloproteinazy syntetyzowane przez bakterie z rodzaju Bacillus należą do obojętnych proteinaz i pod taką nazwą są często opisywane w literaturze. Enzymy te zawierają w cząsteczce jeden atom Zn2+ (jako komponent centrum aktywnego) i kilka atomów Ca2+. Ich inhibitorami są związki chelatujące, takie jak: EDTA, ditizon. Ogólnie, metaloproteinazy z wyjątkiem termolizyny należą do najmniej stabilnych drobnoustrojowych hydrolaz peptydowych. Są mało odporne na działanie mocznika, wyższych temperatur oraz zmian pH poza zakresem 6-8. Metaloproteinazy wytwarzane przez B.subtilis (obojętna endopeptydaza I) i B.subtilis var. amylosacchariticus (obojętna endopeptydaza II) wykazują ostrą granicę działania w zakresie pH 7,0-7,5 z optymalnym pH 7,3. Ich masy cząsteczkowe są rzędu 35-45 kDa. Obojętne proteinazy nie hydrolizują końcowych wiązań estrowych w syntetycznych substratach.
4. Kierunki wykorzystania endopeptydaz
4.1. Przemysł mięsny i rybny.
Mięso jest ważnym produktem żywnościowym, szczególnie ze względu na obecność w nim pełnowartościowych białek, to jest takich, które dostarczają człowiekowi wszystkich egzogennych aminokwasów. Zawartość białek w mięsie waha się od 10 do 20 % i są one jego najważniejszym składnikiem. W tkance mięśniowej występują różne rodzaje białek prostych (albuminy i globuliny) i złożonych. Albuminy (miogen: 0,5 - 5 %) i globuliny (miozyna: 5 - 15 %) zawierają prawie wszystkie niezbędne dla człowieka aminokwasy (jedynie zbyt mało tryptofanu). Oprócz albumin i globulin w jadalnej tkance mięśniowej w mniejszych ilościach występuje: kolagen, elastyna, retikulina, których funkcją jest utrzymanie struktury tkanki i łączenie jej ze szkieletem. Wśród białek złożonych dominują barwniki oddechowe, przede wszystkim mioglobina i hemoglobina. Natomiast w tkance łącznej podstawowymi białkami są skleroproteiny: kolagen i elastyna. Występują one w postaci włókienek nierozpuszczalnych w wodzie. Są to białka nie trawione przez organizm człowieka. Kolagen przez długie gotowanie można przeprowadzić w formę rozpuszczalną w wodzie - żelatynę tworzącą żel po ostygnięciu. W skład niejadalnych części tuszy mięsnej wchodzi także keratyna, główny składnik włosów, rogów, kopyt i powierzchniowej warstwy naskórka.
Jednakże, jako składnik żywności człowieka, mięso nabiera pełnej wartości dopiero w procesie dojrzewania. W wyniku złożonych przemian biochemicznych zachodzących głównie w białkach pod wpływem endogennych enzymów proteolitycznych mięso uzyskuje odpowiednią kruchość, soczystość, delikatność oraz pełne walory smakowe.
Podstawowe przemiany biochemiczne zachodzące podczas dojrzewania to: glikogenoliza (rozpad glikogenu do kwasu mlekowego i spadek pH do 5,3-5,4) oraz rozpad kwasu adenozynotrifosforanowego (ATP). Oba te procesy przebiegają równolegle. Rozkład, jednak, ATP przebiega stopniowo: w wyniku odłączenia jednej reszty fosforanowej tworzy się ADP z wyzwoleniem energii, w wyniku odłączenia dwóch grup fosforanowych tworzy się adenozynononofosforan (AMP) i energia. Dalsze przemiany są rozkładem enzymatycznym AMP, w wyniku którego powstaje adenozyna (adenina połączona z rybozą) + fosforan (V). Adenozyna rozkładana jest dalej; końcowym stadium rozkładu jest deaminacja pod wpływem enzymu deaminazy. Po tych etapach następuje dojrzewanie właściwe, które ma charakter bardzo złożony. Spośród składników mięsa największym zmianom w tym okresie ulegają białka: kolagen i elastyna, a charakter zmian decyduje w głównej mierze o cechach mięsa. Część białka ulega hydrolizie, najpierw zachodzi depolimeryzacja włókienek, a w wyniku dalszych zmian wzrasta ilość białek rozpuszczalnych. Struktura mięsa ulega rozluźnieniu, poszczególne włókienka nie są już ze sobą związane. Zwiększa się ilość peptydów. W trakcie dojrzewania mięs następuje również rozbicie wiązań disiarczkowych w białkach (powstanie wolnych grup sulfhydrylowych) oraz zwiększenie reaktywności grup wodorotlenowych, karboksylowych i aminowych. Wszystkie, w/w modyfikacje białek zachodzą pod wpływem proteolitycznych enzymów endogennych mięsa. Badając procesy dojrzewania różnych mięs wykryto wiele aktywnych endopeptydaz : tiolowych, serynowych i karboksylowych występujących w sarkoplazmie, ziarnistościach sarkoplazmatycznych i bezpośrednio w tkance mięśniowej. Stwierdzono, iż charakteryzują się one wąskimi przedziałami optymalnego pH działania. Są wśród nich enzymy aktywne w środowisku o wysokiej kwasowości (pH ok. 2,5) jak i enzymy działające w zasadowym środowisku. Wykryto ponadto, że największy udział w naturalnych zmianach struktury mięsa mają katepsyny i CAF (calcium activated factor).
Tradycyjny proces dojrzewania mięsa (w wyniku działania wyłącznie endogennych enzymów) trwa 14-28 dni. Obecnie, w celu jego przyspieszenia, stosuje się dodatek rozmaitych preparatów proteolitycznych. Pozwala to na 1,5-2 krotne skrócenie procesu dojrzewania mięsa, a w przypadku przemysłu rybnego nawet na 6-10 krotne. Oczywiście, ma to duże znaczenie ze względów ekonomicznych, gdyż przyczynia się do ograniczenia ubytków wagowych mięs i jednocześnie zmniejsza ryzyko zakażeń mikrobiologicznych. Ponadto, w przypadku gorszego gatunku mięs i ryb, pozwala na podwyższenie wydajności przerobu tych surowców.
Pod względem możliwości wykorzystania proteinaz do celów przetwarzania mięsa i ryb przebadano enzymy pochodzenia zwierzęcego takie jak pepsyna czy trypsyna oraz wiele preparatów pochodzenia roślinnego (np. papaina. bromelaina, ficyna). Sprawdzono też handlowe preparaty grzybowe (Rhozyne P-11, Rhozyne A-4, endopeptydaza 15) i bakteryjne (np. z Bacillus subtillis). Preparaty te wykazują różną specyficzność w stosunku do różnych białek znajdujących się w mięsie. Uważa się, ze w celu uzyskania optymalnego efektu dojrzewania najkorzystniejsze jest stosowanie mieszaniny różnych enzymów proteolitycznych, które wzajemnie się uzupełniają. Stąd w praktyce stosuje się mieszaniny proteinaz zwierzęcych (np. pepsynę, trypsynę), proteinazy pochodzenia roślinnego (papainę, bromelainę, ficynę) z dodatkiem proteinaz drobnoustrojowych (w tym głównie z bakterii Bacillus). Należy jednak przyznać, że preparaty proteinaz bakteryjnych (może z wyjątkiem B.subtilis) stosowane są w ograniczony sposób, wynikający prawdopodobnie z zahamowań kulturowych. Natomiast powszechnie stosuje się je do przerobu odpadowych (niejadalnych) części przemysłu mięsnego i rybnego.
W praktyce napotyka to jednak trudności, gdyż wbrew przewidywaniom wykazano niekorzystne oddziaływanie między sobą szeregu enzymów pochodzących z różnych źródeł. Według niektórych autorów najlepsze efekty „zmiękczenia" dają proteinazy bakteryjne, hydrolizujące wyłącznie włókna mięśniowe,- gdyż nie powodują gąbczastości mięsa i nie nadają mu niekorzystnego posmaku. Jednak z piśmiennictwa dotyczącego zastosowania preparatów enzymatycznych w przemyśle mięsnym i rybnym wynika, że najpowszechniej stosowane są do tego celu preparaty papainy i bromelainy. Przyspieszenie procesu tenderyzacji ma duże znaczenie ze względów ekonomicznych, gdyż przyczynia się do zmniejszenia ubytków wagowych mięs i zmniejsza niebezpieczeństwo zakażenia mikrobiologicznego, które jest możliwe podczas długiego okresu dojrzewania. Poza tym enzymatyczna tenderyzacja, zwłaszcza gorszego gatunku mięs i ryb, pozwala na podwyższenie wydajności przerobu tych surowców. W przypadku ryb, ponadto, dzięki przemianom enzymatycznym produkt uzyskuje pożądaną teksturę, smak i zapach, przez co staje się jadalny bez wcześniejszej obróbki cieplnej! Praktycznym problemem w technologii mięsa jest osiągnięcie jednakowego, równomiernego rozprowadzenia enzymów w całej objętości tkanki, w taki sposób, aby nie spowodować nadmiernej hydrolizy poszczególnych partii; jeśli preparaty są rozprowadzane na powierzchni mięsa jego wnętrze pozostaje niedojrzałe (twarde). Alternatywą jest wielokrotna iniekcja roztworów enzymów (pod ciśnieniem) do wnętrza tkanki mięsnej. Aktualnie prowadzone są badania w kierunku opracowania takich warunków dojrzewania, które umożliwiłyby w maksymalnym stopniu wykorzystanie własnego aparatu enzymatycznego mięsa (bez dodatku egzogennych enzymów). Jedną z nowych metod przyspieszania enzymatycznego kruszenia mięsa jest drażnienie go prądem o stałym natężeniu równym 4 A, przy napięciu szczytowym 600 - 700 V. Elektrostymulacja powoduje szybki spadek pH mięsa w ciągu 2 minut (normalnie proces ten trwa do 7 godzin) przez co stwarza się dogodne warunki działania endogennych enzymów.
4.2. Przemysł mleczarski.
Podstawowym surowcem przemysłu mleczarskiego jest mleko. Mleko jest przede wszystkim źródłem wartościowego białka o pełnym składzie aminokwasów niezbędnych dla organizmu ludzkiego. Poza tym zawiera ono łatwo przyswajalne tłuszcze, cukier mlekowy (laktozę), sole mineralne i witaminy. Również z przemysłowego punktu widzenia najważniejszym jego składnikiem jest białko, którego modyfikacje dają możliwość otrzymania różnorodnych produktów mlecznych.
W skład białek mleka wchodzą: białka proste - laktoalbuminy i laktoglobuliny oraz złożone - kazeiny (α1, α2, β i χ) W mleku krowim około 75 % azotu ogólnego przypada na kazeinę, reszta to albuminy, globuliny i azot niebiałkowy. Kazeina, białko o największym znaczeniu dla przemysłu mleczarskiego, należy do fosfoprotein. W mleku świeżym o pH 6,5 kazeina wykazuje przewagę zjonizowanych grup karboksylowych (-COO-) i zachowuje się jak kwas tworząc sole z jonami wapnia. Ponadto z wodorofosforanami wapnia tworzy związki kompleksowe.
Pierwszym etapem przetwarzania białek mleka jest uzyskanie skrzepu kazeinowego. Do tego celu tradycyjnie stosuje się podpuszczkę - enzym wyodrębniany z trawieńców cieląt.
Działanie podpuszczki (zwanej też renniną lub chymozyną) na mleko jest dwojakie:
1) wywołuje ona koagulację białek mleka tzn. powoduje wytwarzanie skrzepu parakazeinowego, który jest surowcem do produkcji serów
2) powoduje częściową hydrolizę skoagulowanej parakazeiny w czasie dojrzewania serów.
Mechanizm podpuszczkowego krzepnięcia mleka polega na tym, że rennina hydrolizuje wybiórczo wiązanie peptydowe między fenyloalaniną a metioniną (reszty aminokwasówe 105 - 106) w χ-kazeinie (rys. 1) pełniącej rolę koloidu ochronnego miceli kazeinowej w mleku.
Wskutek tego następuje wydzielenie z miceli rozpuszczalnego glikomakropeptydu stanowiącego 1/3 χ-kazeiny (5 % kazeiny mleka), natomiast z micelą pozostaje związane w dalszym ciągu 2/3 χ-kazeiny, tzw. para-χ-kazeina (reszty_aminokwasów 1 - 105). Uwolnieniu glikomakropeptydu towarzyszy znaczna utrata pawłoki hydratacyjnej z miceli kazeinowej i obniżenie jej potencjału elektrokinetycznego. Prowadzi to do modyfikacji struktury przestrzennej miceli i odsłonięcia aktywnych hydrofobowych miejsc łańcucha polipeptydowego. Efektem tych zmian jest agregacja miceli kazeinowych, a w konsekwencji powstanie trójwymiarowej sieci mocnych wiązań utrzymujących strukturę skrzepu kazeinowego. Większość dodanej do mleka renniny (ok. 90 %) zostaje oddzielona z serwatką, jednakże jej część pozostała w skrzepie spełnia istotną rolę w procesie jego dojrzewania wpływając na uzyskanie odpowiedniego aromatu i struktury serów.
Czas krzepnięcia mleka pod wpływem podpuszczki jest na ogół tym krótszy, im większa jest dawka enzymu, im wyższą temperatura oraz kwasowość mleka. Optymalna temperatura procesu podawana jest różnie przez licznych autorów. W praktyce stosuje się zwykle temperaturę w granicach 29 - 34°C. Natomiast optymalne pH dla krzepnięcia mleka pod wpływem podpuszczki wynosi około 6,0. W praktyce serowarskiej krzepnięcie zachodzi zwykle przy pH 6,4 - 6,5 (7,0 - 7,5°SH). Powyżej pH = 9,0 zachodzi inaktywacja enzymu (choć niektórzy autorzy podają, że już w pH > 6,5) [4].
Od połowy lat 50-tych notuje się jej światowy deficyt podpuszczki spowodowany ogromnym spożyciem serów, a tym samym coraz większą ilością mleka przeznaczanego na ich produkcję. Deficytową i stąd coraz droższą podpuszczkę przemysł mleczarski zaczął zastępować jej substytutami. Początkowo próbowano stosować preparaty endopeptydaz zwierzęcych i pochodzenia roślinnego (m.in. trypsynę, chymotrypsynę, ficynę, papainę, itp.). Sery wytwarzane z użyciem tych enzymów wykazywały jednak wady w smaku, jak też w konsystencji.
Spośród enzymów pochodzenia zwierzęcego dość szerokie zastosowanie do koagulacji mleka znalazła pepsyna używana w preparatach mieszanych z podpuszczką w stosunku 1:1. Jednak zastosowanie tego typu preparatów mieszanych często daje skrzepy o nietypowych właściwościach, tzn. o małej zwartości i gorzkim posmaku. Najbardziej znany w Europie preparat tego typu to duński preparat składający się z pepsyny świńskiej i podpuszczki cielęcej rozpowszechniony pod nazwą Hansen Lab. Fifty/Fifty.
Alternatywą dla enzymów roślinnych i zwierzęcych stały się proteinazy pochodzenia drobnoustrojowego. Pierwsze wzmianki o zastosowaniu proteinaz bakteryjnych jako substytutu podpuszczki pochodzą z 1944 roku. Jednym z pierwszych jest patent brytyjski na wyrób sera z zastosowaniem preparatu proteolitycznego otrzymanego z bakterii B.subtilis. Kolejne patenty, ogłoszone głównie w USA, dotyczą również preparatów proteinaz otrzymywanych z różnych szczepów Bacillus. Obecnie preparaty proteolityczne otrzymywane z hodowli bakterii z rodzaju Bacillus stosuje się chętnie do produkcji miękkich serów krótko dojrzewających i pleśniowych (Camembert, münster, romadour). Jak wiadomo, odznaczają się one dobrym smakiem i delikatną konsystencją.
Również bardzo dobre wyniki uzyskuje się stosując do produkcji serów preparat chymozyny „Maxiren". Preparat ten otrzymuje się z drożdży Kluyveromyces lactis. Badano jakość serów (Camambert, kortowskiego i edamskiego), do wyrobów których zastosowano preparat „Maxiren". Wykazano, że stopień wykorzystania składników mleka w produkcji sera przy użyciu w/w preparatu był zbliżony do wartości uzyskanych dla naturalnej podpuszczki oraz nie stwierdzono różnic w intensywności degradacji białek w czasie dojrzewania serów.
Do enzymów koagulujących mleko pochodzenia mikrobiologicznego dobrze zastępujących chymozynę należą także proteinazy syntetyzowane przez pleśnie. Już w 1965 r. duńska firma Novo zgłosiła patent na produkcję substytutu podpuszczki z pleśni Mucor michei (nazwa handl. Rennilasa). Stosunek aktywności podpuszczkowej preparatu do jego ogólnej aktywności proteolitycznej (RU/AU) wynosi 270.000. Preparaty Rennilazy są bardzo stabilne podczas przechowywania i wysoko termostabilne w procesie technologicznym. Podczas wyrobu sera, Rennilasa zachowuje się w taki sam sposób jak podpuszczka cielęca i przez wielu autorów uważana jest za jedną z najbardziej obiecujących „podpuszczek", zastępujących podpuszczkę cielęcą. Jest stosowana w wielu krajach w tym również w Polsce.
Jednak instytuty badawcze związane z przemysłem mleczarskim nadal rozwiązują problem braku chymozyny. Na przykład, ostatnio podjęto próby wytwarzania skrzepu parakazeinowego przy użyciu cielęcej podpuszczki unieruchomionej. W tym celu przez kolumnę z immobilizowanym enzymem (renniną) przepuszczono mleko oziębione do temp. 15°C, (aby opóźnić zjawisko koagulacji). Zastosowanie immobilizowanej podpuszczki pozwoliłoby na ciągły, automatyczny proces produkcji serów oszczędzający w znaczny sposób użycie enzymu. Ale jak dotąd, żadna z dotychczas sprawdzonych metod unieruchomienia podpuszczki nie zapewniła otrzymania biopreparatu o wystarczająco wysokiej aktywności i stabilności. Mała stabilność operacyjna unieruchomionego enzymu spowodowana jest intensywnym rozwojem mikroorganizmów na złożu (gdyż mleko jest kompleksowym źródłem wszystkich substancji niezbędnych dla rozwoju
W niektórych krajach, dysponujących wysoko rozwiniętym zapleczem badawczym, w latach 70-tych podjęto próby otrzymania preparatu podpuszczkowego z wykorzystaniem metod inżynierii genetycznej. Po latach intensywnych badań firma Pilzer (USA) podjęła na skalę przemysłową produkcję preparatu enzymatycznego „Chymox" przy użyciu bakterii Escherichia coli K12, do których wprowadzono gen odpowiedzialny za produkcję chymozyny A (wyizolowany z komórek ścian trawienia cielęcego). Preparat ten posiada właściwości nie różniące go w żaden sposób od podpuszczki cielęcej.
Oprócz tworzenia skrzepu kazeinowego specjalnie dobrane mieszaniny proteinaz powodują znaczne przyspieszenie i ulepszenie procesu dojrzewania serów w procesie ich wytwarzania. Enzymatycznie modyfikowane sery są źródłem wielu korzystnych smakowo związków oraz posiadają obniżoną zawartość substancji starych (tzw. „zdrowa żywność"). Źródłem enzymów stosowanych w procesie dojrzewania serów mogą być szczepy pleśni z gatuńku Penicillium candidum i Penicillium reąuefortii o wysokiej aktywności proteolitycznej. Enzymy te zapewniają dobry smak wyprodukowanych z ich udziałem serów.
4.3. Przemysł fermentacyjny.
Podstawowym źródłem enzymów (m.in. proteolitycznych) stosowanych w tradycyjnej produkcji piwa jest słód browarniczy. Produkcja słodu o odpowiednich właściwościach jest procesem trwającym wiele tygodni: uwarunkowanym przede wszystkim posiadaniem jęczmienia browarniczego o ściśle określonych parametrach. Proces ten składa się kolejno z: 3 - 6 dniowego moczenia ziarna, kilku - kilkunastodniowego słodowania (kiełkowanie) ziaren jęczmienia, suszenia (~24 godz.), odkiełkowania i najbardziej czasochłonnego procesu „dojrzewania" słodu (4-6 tygodni). Podczas kiełkowania jęczmienia i jego dojrzewania zostają uaktywnione lub syntetyzowane są „de novo" enzymy proteolityczne, amylolityczne i celulolityczne, które zmieniają jego strukturę, skład chemiczny i są niezbędne przy produkcji piwa. Obecnie stosuje się różne modyfikacje piwowarstwa prowadzące do zmniejszenia zużycia słodu a tym samym do obniżenia kosztów produkcji. I tak np., obok tradycyjnie używanego słodu browarniczego często podczas produkcji brzeczki piwnej dodaje się słód proteolityczny - wzbogacony o kultury bakterii kwasu mlekowego (m.in. Bacterium delbrucki) w celu podniesienia wydajności procesu warzenia. Stwierdzono, że dodatek słodu proteolitycznego wpływa na lepszą klarowność, jaśniejszą barwę pełniejszy smak piwa. Dodatek ten przyczynia się przede wszystkim do obniżenia wskaźnika zużycia słodu, a tym samym do zmniejszenia kosztów wytwarzania piwa. Względy ekonomiczne skłaniają również browary do częściowego zastępowania drogiego słodu surowcami niesłodowymi, np. niesłodowanym jęczmieniem, kukurydzą, ryżem, prosem lub syropem glukozowym a nawet sacharozą. Wówczas wymagany jest dodatek brakujących w niesłodowanym jęczmieniu enzymów, przede wszystkim rozkładających substancje białkowe i skrobię. Z tego względu należy uzupełniać zacier, w procesie warzenia, w α-amylazę, β-glukanazę i proteinazę. Wykorzystuje się do tego celu kompleksowe preparaty bakteryjne i pleśniowe, które obok wymienionych zawierają inne enzymy cytolityczne, rozkładające składniki ścian komórkowych surowca. Ważne jest aby skład i proporcje preparatów były odpowiednie, gdyż wykazano współdziałanie enzymów amylolitycznych i proteolitycznych we wspomaganiu i przyspieszeniu procesów rozkładu składników zacieru słodowego. Często cząsteczki skrobi są połączone z białkami w taki sposób, iż uniemożliwia to całkowitą jej hydrolizę a co za tym dalej idzie hamuje ekstrakcję niskocząsteczkowych, rozpuszczalnych składników niezbędnych dla rozwoju drożdży i ich metabolizmu w trakcie fermentacji. I tak np., dodatek papainy o aktywności 800 jednostek w ilości 0,01 - 0,03 % w przeliczeniu na słód (10 - 30 g papainy na 100 kg słodu) zwiększa wydajność ekstrakcji o 2 - 4 % [4].
Jednakże enzymy proteolityczne są przydatne nie tylko we wstępnych długotrwałych procesach produkcji słodu w piwowarstwie czy w trudnym procesie maceracji tkanki owoców w winiarstwie. Również działają one aktywnie na właściwych etapach nagromadzenia alkoholu i uzyskiwania odpowiednich cech organoleptycznych przez finalny produkt, tzn. w trakcie fermentacji i leżakowania win czy piwa. Stwierdzono, że warunkiem prawidłowego przebiegu w/w procesów jest uzyskanie odpowiedniej ilości produktów proteolizy białek, tzn. a-aminokwasów oraz peptydów w brzeczce nastawnej (otrzymanej z zacieru, wody i chmielu). Mianowicie, ilość ich w przeliczeniu na azot a-aminowy powinna wynosić 200 mg /1 brzeczki.
Ponadto ważnym i trudnym problemem technologicznym przemysłu fermentacyjnego rozwiązywanym przez zastosowanie proteinaz jest stabilizacja wina i piwa. Polega ona na usuwaniu zmętnień oraz nie dopuszczaniu do ich powstawania. Zmętnienia mogą być dwojakiego rodzaju: zmętnienie „zimne" powstające podczas przechowywania w temp. 0°C i ustępujące po ogrzaniu oraz zmętnienie „trwałe" powstające po dłuższym przechowywaniu piwa lub win w temperaturze pokojowej. Substancje, które powodują zmętnienia to: białka, garbniki, węglowodany oraz metale ciężkie i ich połączenia. Najtrudniejsze do usunięcia zmętnienie koloidalne powstaje w wyniku tworzenia się kompleksów peptydylo-polifenolowych wypadających z roztworu w postaci osadu. Wśród sposobów stabilizacji napojów fermentowanych najbardziej ekonomiczny i pozwalający na zachowanie ich niezmienionych właściwości organoleptycznych jest dodatek odpowiedniego zestawu enzymów proteolitycznych (wśród nich często papainy).j Podwyższenie stabilności koloidalnej piwa lub wina pod wpływem proteinaz jest następstwem hydrolizy wielocząsteczkowych polipeptydów do fragmentów o mniejszej masie cząsteczkowej, biorących udział w reakcjach Maillarda. Proteolizy białek nie prowadzi się jednak do końca, gdyż pewna ilość oligo - i polipeptydów jest potrzebna w piwie do wytwarzania i stabilizacji piany. W winie proces ten jest nieco dalej prowadzony.
4.4. Przemysł piekarski i cukierniczy
Podstawowymi surowcami dla piekarnictwa są mąki pszenne i żytnie. Ich głównymi składnikami są: skrobia (50 - 60 %), substancje białkowe (5,4 - 9,8 %) w tym 80 % glutenu, woda (14 - 15 %), tłuszcze (1,5-2,8 %), witaminy i mikroelementy (0,5-1,4 %). Istotnym parametrem charakteryzującym jakość mąki i decydującym o jej użyteczności do wyrobu poszczególnych asortymentów pieczywa jest zawartość substancji białkowych, do których należą gliadyna (prolamina), glutelina (glutelina), edestyna (globulina), leukozyna (albumina). Największą jednak rolę odgrywają glutenina i gliadyna. Połączenie ich w stosunku 1:1 nosi nazwę glutenu. Po zwilżeniu mąki wodą białka ulegają uwodnieniu i pęcznieją. Mieszanie ciasta ułatwia wzajemny kontakt białek, które łączą się ze sobą poprzez boczne łańcuchy aminokwasów lub przez grupy cysteinowe - SH wiązaniem - S - S -. Mieszanie ciasta, zatem powoduje uporządkowanie długich łańcuchów białek, tworzących w cieście przestrzenną siatkę glutenową, zdolną do zatrzymywania w cieście CO2 powstającego z fermentacji cukrów [11]. Technolodzy, z punktu widzenia wartości piekarskiej, wyróżniają 3 rodzaje glutenu: mocny, normalny i słaby. Wskaźnikiem jakościowo -ilościowym glutenu jest liczba glutenowe (LG), która określa jakość mąki w odniesieniu do takich cech jak zdolność ciasta do zatrzymywania gazów i odporność do obróbkę mechaniczną. Cechą glutenu mocnego (LG > 60) jest powolne chłonięcie wody, zwięzłość i mała rozciągliwość. Ciasta z mąki zawierającej taki gluten są mało pulchne i twarde. Gluten słaby (LG, 40) szybko chłonie wodę a konsystencja jego jest luźna, rozpływające się i daje pieczywo płaskie, mało wyrośnięte.) Tradycyjne metody obróbki enzymatycznej w piekarstwie opierają się na działaniu enzymów endogennych, które katalizują zmiany podczas wzrostu, dojrzewania i przechowywania wypieków; nie zawsze jednak w sposób wystarczający, optymalny. Dlatego też często stosowany jest dodatek z zewnątrz enzymów proteolitycznych. Działanie ich powoduje modyfikacje glutenu w sposób kontrolowany, dzięki czemu osiąga się cechy właściwe dla danego wypieku. W zależności od rodzaju mąki i jej przeznaczenia do wypieku różnorodnych asortymentów pieczywa stosuje się dodatek różnych preparatów enzymatycznych, w różnej ilości w stosunku do substratu i różnym stopniu hydrolizując białka glutenu. Zbyt wysokie ilości proteinaz (np. papainy) powoduje rozpływanie się ciasta, zmniejszenie się zdolności do zatrzymywania gazów, a tym samym obniżenie objętości wyrobów. W latach 60-tych piekarstwo USA zaczęło stosować preparaty proteolityczne z Aspergillus oryzae oraz preparaty bromelainy (w mniejszym stopniu) do ciast wykonanych zarówno z „miękkiej" jak i „twardej" mąki. Podyktowane to było faktem uwalniania, przez proteinazy, z białek aminokwasów, które podtrzymują wzrost drożdży i polepszają zapach produktu finalnego. Obecnie ocenia się za przydatne także proteinazy Bacillus subtilis np., Endopeptydaza 16 firmy ABM, BPN firmy Novo (stosowana w Polsce od 1975 r.) i krajowy preparat Proteopol BN. Obróbka ciasta termostabilną proteinazą z B. subtilis stosowana jest m. in. w przemysłowym wypieku sucharów i powoduje otrzymanie wysokoelastycznego ciasta [4]. Parametr ten (wysoka elastyczność) jest bardzo ważny ze względu na technologiczną potrzebę tworzenia cienkich plastrów ciast. Stwierdzono, że enzymatyczna degradacja glutenu jest korzystniejsza od metody chemicznej (użycie disiarczynów).
Jak widać, dodatek preparatów proteolitycznych w przemyśle piekarskim i cukierniczym zdecydowanie poprawia jakość wyrobów, umożliwia rozszerzenie ich asortymentu, ułatwia i przyspiesza proces technologiczny. Ciasto staje się bardziej elastyczne i rozciągliwe, a dzięki temu bardziej podatne na obróbkę i formowanie. Dzięki wprowadzeniu preparatów proteinaz w piekarnictwie proces przygotowania ciasta uległ znacznemu skróceniu i ułatwieniu, zwiększono sprężystość ciast i objętość produktu oraz poprawiono jego strukturę. Ma to szczególne znaczenie w ciągłym procesie wyrabiania ciasta.
4.5. Modyfikacje białek żywności
W ostatnich latach zyskują na znaczeniu badania zmierzające do otrzymania produktów białkowych o pożądanych właściwościach funkcjonalnych. Cel taki próbuje się osiągnąć przede wszystkim przez modyfikacje białek, które prowadzi się trzema rodzajami technik: fizycznymi, chemicznymi i enzymatycznymi. Modyfikacja fizyczna jest konwencjonalnym procesem wykorzystującym zmiany właściwości białek, jakie zachodzą w wyniku przede wszystkim, ich obróbki termicznej. Modyfikacją chemiczna można nazwać zamierzony proces mający na celu poprawę właściwości białek, głównie przez kowalencyjne przyłączenie grupy funkcyjnej w wyniku reakcji chemicznej (acylowanie, alkilowanie, redukcja i utlenianie oraz podstawienie pierścienia aromatycznego). Trzecią grupę metod stanowią mody fikacie enzymatyczne. Są to, znajdujące największe zastosowanie, enzymatyczne reakcje typu hydrolitycznego bądź niehydrolitycznego powodujące korzystne zmiany właściwości białek w żywności. Mogą one zachodzić zarówno in vivo jak i in vitro.
W przemyśle spożywczym największą rolę odgrywają, katalizowane przez proteinazy, enzymatyczne reakcje hydrolityczne. Obejmują one reakcje in vitro, które od dawna są wykorzystywane i stosowane w przetwórstwie żywności, jak i te, które reprezentują potencjalne możliwości zmiany właściwości funkcjonalnych białek czy poprawy ich wartości żywieniowej [12]. W zależności od surowca wyjściowego modyfikacje te można rozpatrywać jako:
4.5.1. Modyfikacje białek spożywczych in situ.
Najlepiej poznanym sposobem proteolitycznej modyfikacji białek jest koagulacja kompleksu kazeinowego za pomocą renniny oraz dalsze funkcjonowanie pozostałej w skrzepie kazeinowym renniny, pozwalające na uzyskanie odpowiedniego aromatu i struktury sera. Ponadto, prowadzona jest ograniczona proteoliza mleka z zastosowaniem pepsyny, trypsyny, pankreatyny w celu poprawy stabilności oksydacyjnej mleka, zwiększenia lepkości mleka UHT i otrzymywania delikatnych żeli. Kolejnym przedstawionym wcześniej przykładem jest poprawa kruchości mięsa za pomocą proteaz roślinnych (papaina, ficyna, bromelaina) czy zwierzęcych (trypsyna, chymotrypsyna) poprzez częściową hydrolizę białek miofibrylarnych i tkanki łącznej. Enzymy mogą być wykorzystywane również do produkcji zamienników tradycyjnego sosu rybnego, oczyszczania kości z resztek mięsa, skrócenia czasu wytopu tłuszczu, jak również przy produkcji osłonek. Ponadto stosuje się je w piwowarstwie - rozpuszczanie białek (zmiana ich budowy, przez co stają się rozpuszczalne w niskich temperaturach) czyli zapobieganie zmętnieniu oraz w piekarnictwie - zmiana właściwości glutenu.
4.5.2. Modyfikacja białek izolowanych
Hydrolizaty białkowe - otrzymywane są tradycyjnie z soi, glutenu czy odpadów mięsnych przez hydrolizę kwasową, której wadą jest wysoka zawartość soli w produkcie i częściowe zniszczenie aminokwasów. Można temu zapobiec stosując hydrolizę enzymatyczną, jednak wówczas pojawia się problem powstawania gorzkich peptydów. Różne są opinie na temat przyczyny powstawania tych niepożądanych produktów (rodzaj surowca, enzymu itp.). Uważa się, że gorzki smak jest wynikiem dużej zawartości hydrofobowych aminokwasów, szczególnie jeśli reszta C-końcowa jest hydrofobowa. Wykazano ponadto, że gorzkość może być eliminowana za pomocą ultrafiltracji, węgla aktywnego, w wyniku działania egzopeptydaz, karboksypeptydazy czy aminopeptydazy albo poprzez reakcję plasteinową.
Preparaty białkowe to m.in. pianotwórcze preparaty białkowe, do wytwarzania których surowcem wyjściowym są izolaty białka lub wysokiej jakości koncentraty otrzymane w wyniku obróbki maki sojowej alkoholem. Najlepsze efekty uzyskuje się stosując kombinację ultrafiltracji izolatu sojowego i ograniczoną hydrolizę enzymatyczną. Preparaty te mogą zastąpić białko jaja kurzego w produkcji lodów, kremów i deserów. Prowadzone są także badania nad wykorzystaniem hydrolizy enzymatycznej do produkcji preparatów białkowych z ryb, czy z produktów odpadowych przemysłu mięsnego. Mają one na celu obniżenie strat białka. Obróbka enzymatyczna stosowana przy otrzymywaniu koncentratów białkowych z ryb ma również na celu poprawienie jakości sensorycznej i właściwości funkcjonalnych produktu.
4.5.3. Modyfikacje właściwości funkcjonalnych preparatów białkowych
W technologii spożywczych preparatów białkowych najszersze jak dotychczas zastosowanie znalazły enzymy proteolityczne do modyfikacji właściwości tych preparatów. Procesowi takiemu poddawane są wilgotne osady białkowe przed ich wysuszeniem bądź gotowe produkty otrzymane przez koncentrację czy izolację. Dzięki temu otrzymać można produkty o znacznie szerszej gamie zastosowań. Ograniczona proteoliza m.in. białek sojowych może wpłynąć na złagodzenie niepożądanego posmaku fasolowego a przede wszystkim na zwiększenie rozpuszczalności białek. W produkcji żywności zasadnicze znaczenie ma również zdolność białek do tworzenia i stabilizowania emulsji. Zdolność emulgowania enzymatycznie modyfikowanych preparatów białkowych wzrasta, jednakże maleje stabilność emulsji.
Obecnie dąży się do jak najszerszego wykorzystania modyfikowanych białek w celu przygotowania produktów o specyficznych zastosowaniach. Przykładem jest zhydrolizowany produkt oparty na mleku z dodatkiem dekstryn i kwasów tłuszczowych o krótkich łańcuchach. Otrzymany wysokolaryczny produkt jest przeznaczony dla osób wymagających specjalnego żywienia, zawiera on bowiem ok. 80 % białek niskocząsteczkowych. Jednak zbyt duża ilość białek niskocząsteczkowych wywołać może poważne zaburzenia trawienia.
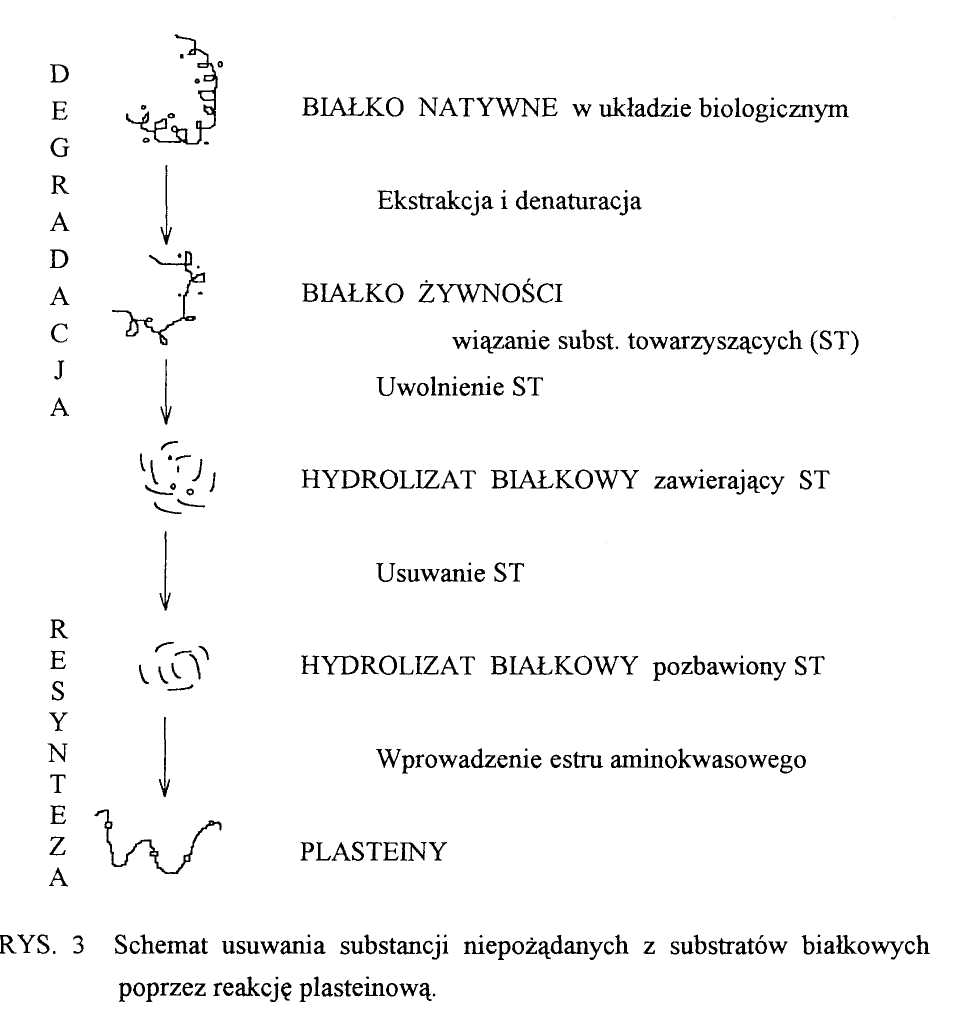
Przykładem wykorzystania proteaz do modyfikacji wysokobiałkowych układów żywnościowych jest również reakcja plasteinowa. Polega ona na tym, że w pierwszym etapie proteazy, takie jak papaina czy pepsyna rczęściowo hydrolizują białka i uzyskuje się fragmenty o ciężarze cząsteczkowym 10-20 kD. Następnie po zagęszczeniu hydrolizatu (do ok. 35 %) i zmianie pH te same lub inne enzymy są używane do resyntezy peptydów. Otrzymany produkt (tzw. plasteiny - RYS. 3) posiada odmienne właściwości w stosunku do surowca [12].
Podstawowymi zaletami w/w procesu jest: usuwanie gorzkich peptydów, zmiana właściwości fizycznych, zwiększenie rozpuszczalności, poprawa własności żywieniowych białek (przez włączenie limitujących aminokwasów), eliminowanie pożądanych aminokwasów, poprawa barwy, zapachu i usuwanie barwników.
4.6. Inne zastosowania
Preparaty endopeptydaz otrzymywanych z bakterii Bacillus znalazły szerokie zastosowanie. Używa się je obecnie na dużą skalę w wielu gałęziach przemysłu (zwłaszcza środków piorących, w garbarstwie i spożywczego) ale również w mniejszej skali w wielu procesach biotechnologicznych (np. w biotransformacji, biokonwersji czy też w biodegradacji). Ten drugi kierunek zastosowania proteinaz Bacillus zostanie wskazany w dalszej części tego rozdziału przy omawianiu wykorzystania komórek bakterii Bacillus. Często bowiem w tych procesach nie izoluje się enzymu lecz używa się całych komórek lub ich fragmentów jako źródła proteinaz.
4.6.1. Biotransformacja
Biotransformacja to jednoetapowe (rzadziej dwuetapowe) chemiczne przekształcenie egzogennych związków organicznych w strukturalnie im podobne produkty dokonywane przez żywą komórkę. Produkty tych przekształceń bardzo często nie mają żadnego znaczenia dla komórki, a niekiedy wręcz mogą okazać się dla niej toksyczne.
Biotransformacja nie jest celem działania komórki; zachodzi ona często jako proces niezależny od jej funkcji życiowych. Można uznać, że w wielu przypadkach „komórka nawet nie zdaje sobie sprawy z tego, że zostaje oszukana i wykorzystana do przekształcenia podsuniętego jej związku organicznego”. Biotechnolog wykorzystuje naturalny aparat enzymatyczny komórki, podstawia jej pewne związki organiczne i oczekuje, że zostaną one przekształcone zgodnie z jego przewidywaniami. Bakterie z rodzaju Bacillus znalazły zastosowanie w wielu takich bioprocesach.
Rys. VI-27. Regioselektywna hydroliza estrów katalizowana przez subtilizynę
Również endopeptydazy produkowane przez bakterie z rodzaju Bacillus mogą selektywnie hydrolizować estry. Na rys. VI-27 przedstawiono przykłady reakcji regioselektywnej hydrolizy estrów karboksylowych katalizowanych przez subtilizynę. Estry dibenzylowe kwasu asparaginowego i glutaminowego są hydrolizowane przy pierwszym atomie węgla. Natomiast estry etylowe kwasu cytrynowego i 1,2,3-trikarboksylopropanu są hydrolizowane przy środkowym atomie węgla. Okazało się, że inne możliwe regioizomeryczne estry nie były wykrywane wśród produktów hydrolizy.
Subtilizyny, obok właściwej sobie specyficzności charakterystycznej dla proteinaz, wykazują również zdolność do hydrolizy estrów wielu aminokwasów. Najefektywniej hydrolizują estry niepolarnych N-acetylo- lub N-benzoilo- podstawionych L-aminokwasów. Natomiast nie hydrolizują estrów D-aminokwasów i stąd znalazły zastosowanie do rozdziału racemicznych mieszanin DL-aminokwasów.
LIPAZY
EC 3.1. Hydrolazy działające na wiązanie estrowe
EC 3.1.1. Hydrolazy estrów karboksylowych
Lipazy (EC 3.1.1.3) rozszczepiają wiązanie estrowe w glicerydach z przyłączeniem wody i utworzeniem wolnych kwasów tłuszczowych. Działają one wybiórczo na określoną pozycje rozkładanego wiązania estrowego. Szybkość hydrolizy lipidów (lipoliza) rośnie wraz z liczbą występujących w nich reszt kwasów tłuszczowych oraz długością stopniem nienasycenia kwasów tłuszczowych. W żywności i produktach spożywczych występować mogą lipazy rodzime, jak również pochodzenia mikrobiologicznego.
W produktach zawierających tłuszcz działalność lipaz jest oceniana jako szkodliwa ze względu na hydrolizę tłuszczu, np. w maśle, margarynie, mleku, śmietanie, smalcu, majonezie, mące, kaszy. Są jednak wyjątki od tej reguły. I tak np. procesy hydrolizy tłuszczu zachodzą w czasie dojrzewania serów, np. w serach pleśniowych, i przyczyniają się do wytworzenia odpowiedniego smaku i zapachu tych serów. Preparaty zawierające lipazy są stosowane w mleczarstwie w celu przyśpieszenia dojrzewania serów, znajdują także zastosowanie odtwarzaniu zapachu mlecznego, mlecznego niektórych preparatach spożywczych. Jak mleko kakaowe lub w produktach o osnowie czekoladowej.
Lipazy są jednymi z najbardziej wszechstronnych enzymów. Znajdują zastosowanie w przemysłach: farmaceutycznym, mleczarskim, środków czyszczących, kosmetycznym, oleochemicznym i innych. Według aktualnych opinii przemysłu i naukowców, w nadchodzących latach nastąpi ogromny wzrost ich przemysłowego wykorzystania.
Preparaty enzymów lipolitycznych:
• Lipaza
Z Bacillus subtilis Optimum pH is 10. The activity decreases strongly above pH 10.5 or below pH 6.5. The enzyme is remarkably stable at alkaline pH, showing maximum stability at pH 12 and retaining more than 65% of its activity after 24 hours at pH 13;
Hydroliza triacylogliceroli (TAG) jest reakcją odwracalną ze względu na niewielką różnicę w zmianie energii swobodnej w kierunku hydroliza-synteza. Kierunek reakcji jest zdeterminowany jej środowiskiem, przy czym nadmiar wody wywołuje hydrolizę, natomiast niska zawartość wody reakcję odwrotną - estryfikację glicerolu. Podczas syntezy grupy acylowe są przenoszone z cząsteczek donora na nukleofilowy akceptor (inny niż woda) taki jak alkohole, aminy czy tioestry. W środowisku alkoholu (zamiast wody) zachodzi transestryfikacja. Katalizowanie reakcji przez lipazy w środowisku o kontrolowanej zawartości wody (współczynniku aktywności wodnej) możliwe jest w środowisku rozpuszczalników organicznych, płynów nadkrytycznych, cieczy jonowych, stałych buforów etc.
• Cholesteroloesteraza
• Fosfolipaza 2, 1
• Lizofosfolipaza
• Fosforanofosfataza
• Fosfolipaza 3
• Sfingomielinaza
• Fosfolipaza 4
• Ceramidaza
Zastosowanie enzymów lipolitycznych:
• Odtwarzania zapachu „mlecznego” w niektórych produktach spożywczych
• Poprawy cech organoleptycznych (smaku i zapachu) serów. istotne podczas dojrzewania serów.
• Produkcji koncentratów zapachowych z tłuszczu mlekowego, mających zastosowanie podczas produkcji sosów i przypraw do zup
• Skracanie czasu dojrzewania serów
• Do odtłuszczania skór i kości
• Polepszania smaku w wyrobach cukierniczych (cukierkach, czekoladzie), w których zmiany lipolityczne tłuszczu mlekowego okazały się korzystne dla aromatu i smaku gotowego produktu
• Produkcja pełnego mleka w proszku, przeznaczonego do produkcji pełnych czekolad
• Syntezy substancji powierzchniowo-czynnych
• Syntezy substancji smakowo-zapachowych
• Syntezy tłuszczów teksturyzowanych
Drobnoustroje syntetyzujące lipazy
• Humicola lanuginosa
• Rhizopus delemar
• Rhizopus arrhizus
• Aspergillus niger
• Rhizomucor miehei
• Candida rugosa
Wyszukiwarka
Podobne podstrony:
Immobilizacja - Zarys, Studia PŁ, Ochrona Środowiska, Biochemia, Biotechnologia
Semantyka pojęć biotechnologii, Studia PŁ, Ochrona Środowiska, Biochemia, Biotechnologia
enzymy - sprawozdanie, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr2, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Zadanie końcowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
tabEnzymy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki
sprEnzymyII, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
tabKinetykaEnzymów, Studia PŁ, Ochrona Środowiska, Biochemia, laborki
bialka spr(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprKwasy nukleinowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
LABORATORIUM 4(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
LABORATORIUM Z BIOCHEMII 3(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprAminokwasy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwieczenie nr8, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr5, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprOksydoreduktazy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
SPRAWOZDANIE 1 AMINOKWASY, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
kwasy nukleinowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
więcej podobnych podstron