OGÓLNE PODSUMOWANIE JAKOŚCI
Produktu leczniczego …………….. mg/g, krem
Spis treści
1.1 S SUBSTANCJA CZYNNA
1.1S.1 Informacje ogólne
1.1.S.1 Nomenklatura
1.1.S.2 Struktura
1.1.S.3 Właściwości ogólne
1.1.S.2 Wytwarzanie
1.1.S.3 Charakterystyka
1.1.S.1 Ustalenie struktury
1.1.S.2 Zanieczyszczenia
1.1.S.4 Kontrola substancji leczniczej
1.1.S.4.1 Specyfikacja
1.1.S.4.2 Metody analityczne
1.1.S.4.3 Walidacja metod analitycznych
1.1.S.4 4 Uzasadnienie specyfikacji
1.1.S 5 Opakowanie bezpośrednie i system jego zamknięcia
1.1.S.6 Trwałość
1.1 P PRODUKT LECZNICZNY
1.1.P.1 Opis i skład produktu leczniczego
1.1.P.2 Ogólne badania rozwojowe nad produktem leczniczym
1.1.P.3 Wytwarzanie
1.1.P.4 Kontrola substancji pomocniczych
1.1.P.5. Kontrola produktu leczniczego
1.1.P.6. Wzorce materiały odniesienia
1.1.P.7 Opakowanie bezpośrednie i system jego zamknięcia
1.1.P.8 Trwałość
1.1. SUBSTANCJA CZYNNA
1.1.S.1 Informacje ogólne
1.1.S. 1.1 Nomenklatura
Detreomycyna jest substancją farmakopealną, której monografie znajdują się w obowiązującym wydaniu Farmakopei Europejskiej i Farmakopei Polskiej
1) nazwa powszechnie stosowana (INN) Chloramfenikol
2) nazwa farmakopealna (Ph.Eur.): Chloramphenicol
3) nazwa łacińska: Chloramphenicolum
4) nazwa chemiczna: D-(−)-treo-2,2-dichloro-N-[β-hydroksy-α-(hydroksymetylo)-β-(4-nitrofenylo)etylo]acetamid
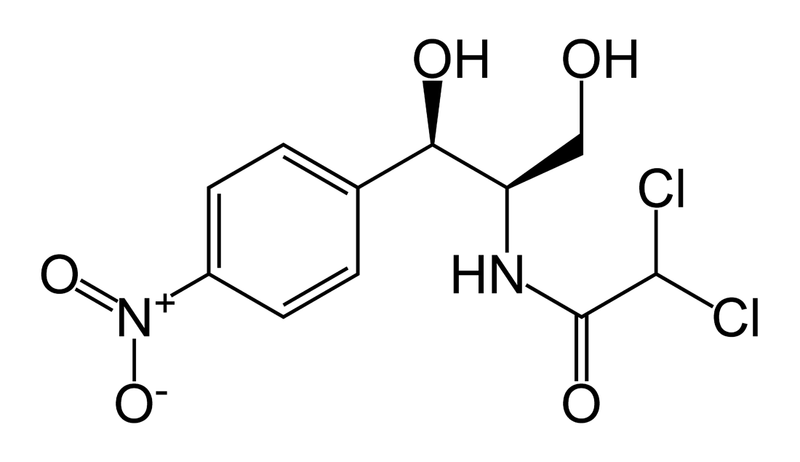
5) nazwa krajowa: Chloramfenikol
1.1.S.1.2 Struktura
1) wzór strukturalny
2) wzór sumaryczny C11H12Cl2N2O5
3) względna masa cząsteczkowa 323,13 g/mol
1.1.S.1.3 Właściwości ogólne
Biały, szarawobiały lub żółtawobiały,krystaliczny proszek, praktycznie nierozpuszczalny w wodzie rozpuszczalny w etanolu i glikolu propylenowym
1.1.S.2 Wytwarzanie
Wytwórcą substancji czynnej używanej do produkcji preparatu leczniczego ………………… …………mg/g, ………….. jest:…………………………………
1.1.S.3 Charakterystyka
1.1.S.3.1 Ustalenie struktury
Wytwórca …………………. wykonuje badania potwierdzające tożsamość oraz czystość ………………….. zgodnie z metodami analitycznymi zamieszczonymi w monografii szczegółowej „Chloramphenicolum” w PH.Eur. i USP. Wytwórca potwierdza strukturę Detreomycyny na podstawie spektroskopii IR, magnetycznego rezonansu jądrowego (H-NMR), spektrometrii masowej oraz analizy elementarnej.
Oceniane parametry są zgodne i jednoznacznie dokumentują strukturę chemiczną substancji leczniczej.
Chloramfenikol posiada dwa centra asymetrii i jest optycznie czynny.
1.1.S.3.2 Zanieczyszczenia
Wytwórca bada rutynowo zawartość 4 potencjalnych zanieczyszczeń; w tym 3 zanieczyszczeń farmakopealnych:
1)
2)
3)
4)
Ponadto wytwórca rutynowo bada pozostałości rozpuszczalników:
1)
2)
3)
1.1.S4 Kontrola substancji czynnej
1.1.S.4.1 Specyfikacja
Specyfikacja wytwórcy odpowiada wymaganiom monografii PH.Eu. Wytwórca wprowadził dodatkowe badania oznaczania zawartości substancji czynnej metodą HPLC oraz badanie pozostałości rozpuszczalników metodą chromatografii gazowej (HS-GC).
Specyfikacja podmiotu odpowiedzialnego zawiera wszystkie badania jakie znajdują się w certyfikacie analitycznym wytwórcy. Podmiot odpowiedzialny bada rutynowo: postać, rozpuszczalność, tożsamość, temperaturę topnienia, zawartość oraz czystość mikrobiologiczną. Pozostałe badania: wygląd roztworu, strata po suszeniu, popiół siarczanowy, metale ciężkie i pozostałość rozpuszczalników są wykonywane przez wytwórcę substancji czynnej.
Zaproponowana przez podmiot odpowiedzialny specyfikacja spełnia wymagania dla rutynowej kontroli substancji czynnej.
Poniżej została przedstawiona tabela zawierająca wyszczególnione badania, kryteria akceptacji oraz odpowiednie metody badawcze.
Lp. |
Badanie |
Kryterium akceptacji |
Metoda analityczna |
1 |
Postać |
Biały miałki krystaliczny proszek |
FP |
|
Rozpuszczalność |
Trudno w wodznie, łatwo e etanolu i glikolu |
PH.Eur |
|
Tożsamość |
, IR, HPLC, |
FP |
|
T.topnienia |
t.top 149-153oC |
PH Eur FP |
|
Zawartość(w przeliczeniu na suchą subst.) |
|
PH Eur FP |
|
Substancje pokrewne Imidazol itp |
|
HPLC |
|
Wygląd roztworu w etanolu |
|
własne |
|
Strata po suszeniu |
Nie więcej niż 0,5% |
|
|
Popiół siarczanowy |
Nie więcej niż 0,1% |
|
|
Met ciężkie |
|
|
|
Czystość mikrobiologiczna |
Jałowy |
|
1.1.S.4.2 Metody analityczne
Metody badawcze są wykonywane zgodnie z monografią Ph.Eur. FP, inne.
1.1.S.3 Walidacja metod analitycznych
1.1.S.4 Uzasadnienie specyfikacji
Zaproponowana specyfikacja Detreomycyny używanego do produkcji preparatu .............................
wytwarzanego przez ...................................... odpowiada wymaganiom zawartym w monografii Ph. Eur.
1.1.S.5 Opakowanie bezpośrednie i system jego zamknięcia
Wytwórca pakuje ………………………… bezpośrednio do……………………… i zamyka .
1.1.S.6 Trwałość
1.1.S.6.1 Podsumowanie trwałości
Wytwórca przedstawia wyniki badań stabilności w warunkach długoterminowych (250 C; ±20C 60%RH ±5%) i przyspieszonych (400 C±20C 75%RH=5%)
Dla 9 serii przedstawiono 60-o miesięczne wyniki badań w warunkach długoterminowych. Dla kolejnych serii badania są kontynuowane w warunkach długoterminowych. Dla 3 serii w warunkach przyspieszonych.
Wszystkie analizowane parametry były zgodne z wymaganiami specyfikacji producenta.
........................................................... wykazuje trwałość w ciągu 5 lat.
Substancja czynna zastosowana w preparacie…………………………………………………..
10mg/g 1(%)
Działanie:
Antybiotyk o działaniu bakteriostatycznym i bakteriobójczym
Wskazania:
Wewnętrznie ciężkie zakażenia OUN bakteriami wielolekoopornymi, rzadko stosowany z powodu wysokiej toksyczności. Stosowany również w riketsjozach
Zewnętrznie w zakażeniach bakteryjnych skóry, oka i ucha.
Dawkowanie:
1.1.P. PRODUKT LECZNICZY
1.1.P.1 opis produktu leczniczego sporządzonego na pracowni I
Produkt leczniczy maść z detreomycyną 10mg/g, 1 [%] ma postać emulsji (maści) typu zawiesiny o barwie żółtawej o jednolitej (niejednolitej) konsystencji . Zawartość substancji czynnej Chloramfenikolu w preparacie maść z detreomycyną 10mg/g 1[%] - 10.mg w 1 g maści.
.
Skład jakościowo ilościowy przedstawiony w poniższej tabeli:
Tabela 1
L.p. |
Nazwa |
Ilość skł g/100g |
il.% |
Funkcja |
Wymaga jakościowe |
Substancja czynna |
|||||
1 |
Chloramfenikol |
1 |
1 |
|
|
Substancje pomocnicze. |
|||||
2 |
Olbrot |
3 |
3 |
Emulgator, utwardzacz |
|
3 |
Alkohol cetylowy |
3 |
3 |
Emulgator |
|
4 |
Alkohol stearylowy |
2 |
2 |
Emulgator |
|
5 |
Span 20 |
2 |
2 |
Emulgator |
|
6 |
Span 80 |
8 |
8 |
Emulgator |
|
7 |
Mirystynian izopropylu |
6 |
6 |
Emulgator |
|
8 |
Wazelina biała |
76 |
76 |
Zapewnia postać leku |
|
Produkt leczniczy maść z detreomycyną jest pakowany po 5g lub10g do pudełek aptecznych .
1.1.P.1 opis produktu leczniczego o zmodyfikowanym składzie sporządzonego na pracowni IV
Produkt leczniczy maść z detreomycyną 10mg/g, 1 [%] ma postać emulsji (maści) typu zawiesiny o barwie żółtawej o jednolitej (niejednolitej) konsystencji . Zawartość substancji czynnej Chloramfenikolu w preparacie maść z detreomycyną 10mg/g 1[%] - 10.mg w 1 g maści.
.
Skład jakościowo ilościowy przedstawiony w poniższej tabeli:
Tabela 2
L.p. |
Nazwa |
Ilość skł g/100g |
il.% |
Funkcja |
Wymaga jakościowe |
|||
Substancja czynna |
||||||||
1 |
Chloramfenikol |
1 |
1 |
|
|
|||
Substancje pomocnicze. |
Substancje pomocnicze. |
|
Substancje pomocnicze. |
|||||
2 |
Olbrot |
3 |
3 |
Emulgator, utwardzacz |
|
|||
3 |
Alkohol cetylowy |
1 |
1 |
Emulgator |
|
|||
4 |
Alkohol stearylowy |
1 |
1 |
Emulgator |
|
|||
5 |
Span 20 |
2 |
2 |
Emulgator |
|
|||
6 |
Span 80 |
8 |
8 |
Emulgator |
|
|||
7 |
Mirystynian izopropylu |
6 |
6 |
Emulgator |
|
|||
8 |
Wazelina biała |
64 |
64 |
Zapewnia postać leku |
|
|||
9 |
Woda |
5 |
5 |
Upłynnia podłoże |
|
|||
Produkt leczniczy maść z detreomycyną jest pakowany po 5g lub10g do pudełek aptecznych .
1.1.P. PRODUKT LECZNICZY
1.1.P.1 opis produktu leczniczego - maści przemysłowej
Produkt leczniczy …………………………………10mg/g, 1[%] ma postać emulsji (maści) typu zawiesina o barwie białej o jednolitej konsystencji Zawartość substancji czynnejChloramfenikol w preparacie ..................................................... 10mg/g 1.[%] - 10mg w 1 g maści.
Skład jakościowo ilościowy przedstawiony w poniższej tabeli:
Tabela 3
L.p. |
Nazwa |
Ilość skł g/100g |
il.% |
Funkcja |
Wymaga jakościowe |
Substancja czynna |
|||||
1 |
|
|
|
|
|
Substancje pomocnicze. |
|||||
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
Produkt leczniczy ……………….. ……………. jest pakowany po ………….g do tub aluminiowych..
1.1.P.2 Ogólne badania rozwojowe nad produktem leczniczym dotyczy maści sporządzonych na pracowni
a. dotyczy maści sporządzonej na I pracowni
Przy opracowaniu składu maści zawiesiny zawierającej substancję czynną Chloramfenikol w stężeniu 10mg/g (1.%) wykorzystano powszechnie stosowane substancje pomocnicze .
W czasie badań rozwojowych modyfikowano skład ilościowy substancji pomocniczych., aby otrzymać stabilny preparat typu maść zawiesinowa o odpowiednich właściwościach reologicznych.
b. dotyczy maści o zmodyfikowanym składzie sporządzonej na IV pracowni
Przy opracowaniu składu maści zawiesiny zawierającej substancję czynną Chloramfenikol w stężeniu 10mg/g (1.%) wykorzystano powszechnie stosowane substancje pomocnicze .
W czasie badań rozwojowych modyfikowano skład ilościowy substancji pomocniczych., aby otrzymać stabilny preparat typu maść zawiesinowa o odpowiednich właściwościach reologicznych.
Podstawowe cechy reologiczne. świadczące o strukturze w to:
-konsystencja
-rozsmarowywalnośc
-lepkość
-przylepność
-tiksotropia
-tendencja do rozwarstwiania
Preparat powinien charakteryzować się trwałością chemiczną, a substancje pomocnicze nie powinny wykazywać działania drażniącego na skórę.
Miejsce działania maści z detreomycyna 1% to naskórek. Zasadniczo substancja nie ulega resorpcji do krążenia ogólnego.
Podczas badań rozwojowych wytwarzanego produktu leczniczego maść z detreomycyną
10mg/g ...1.[%] wyodrębniono następujące parametry krytyczne:
- naważanie surowców
- temperatura fazy wodnej i olejowej.
1.1.P.3 Wytwarzanie
Na proces wytwarzania produktu leczniczego składają się następujące typowe etapy:
a.
-naważanie surowców
-przygotowanie fazy olejowej w której rozpuszczono … Olbrot, Alkohol cetylowy, Alkohol stearylowy, Span 20, Span 80, Wazeline białą t =800C±30C
-przygotowanie fazy wodnej, w której rozpuszczono --------
t =800C±30C
- połączenie obu faz t = 800C±30C, następnie homogenizacja i chłodzenie do 250C±50C
b.
-napełnianie i sprawdzenie masy produktu leczniczego w pudełku aptecznym
- pakowanie pudełek aptecznych do koszyka
- badanie produktu końcowego.
Metoda sporządzania maści zawiesiny (wykonanej na I pracowni) z 1% zawartością Detreomycyną
Do wytarowanej parownicy odważono Olbrot, Alkohol cetylowy, Alkohol stearylowy, Span 20, Span 80, Wazeline białą i ogrzano na łaźni wodnej do rozpuszczenia. Jednocześnie ogrzewano mirystynian izopropylu. Po ogrzaniu wszystkich składników podłoża połączono je w parownicy i homogenizowano mieszadłem mechanicznym. Po ochłodzeniu podłoża odważono odpowiednią ilość chloramfenikolu który rozdrobniono za pomocą pistla w moździerzu, następnie porcjami dodawano podłoże, po każdej porcji dokładnie mieszając substancje z nową porcją podłoża.
Metoda sporządzania maści zawiesiny o zmodyfikowanym składzi (wykonanej na IV pracowni) z ……..% zawartością ………………………………
Do wytarowanej parownicy odważono Olbrot, Alkohol cetylowy, Alkohol stearylowy, Span 20, Span 80, Wazeline białą i ogrzano na łaźni wodnej do rozpuszczenia. Jednocześnie ogrzewano mirystynian izopropylu i wodę . Po ogrzaniu wszystkich składników podłoża połączono je w parownicy wymieszano za pomocą pistla. Po ochłodzeniu podłoża odważono odpowiednią ilość chloramfenikolu który rozdrobniono za pomocą pistla w moździerzu, następnie porcjami dodawano podłoże, po każdej porcji dokładnie mieszając substancje z nową porcją podłoża.
1.1.P.4. Wymagania ogólne
a. maść przemysłowa
Preparat detreomycyni jest emulsją typu ----- o jednolitej konsystencji i białej barwie. Preparat spełnia wymagania monografii „Ungquenta”(FPVII) .
b. maść zawiesina sporządzona na pracowni I
Preparat maść z detreomycyną jest emulsją typu zawiecina o jednolitej konsystencji i żółtawej barwie. Preparat spełnia wymagania monografii „Ungquenta”(FP IV .
c. maść zawiesina o zmodyfikowanym składzie sporządzona na pracowni IV
Preparat maść z detreomycyną jest emulsją typu zawiesina o jednolitej konsystencji i żółtawej barwie. Preparat spełnia wymagania monografii „Ungquenta”(FP IV .
Tabela 4
Badanie |
Kryterium akceptacji |
Metoda analityczna |
Postać
|
|
FP |
Zawartość …………………………… |
|
Ph.Eur. |
Zanieczyszczenia ………………………………. |
|
Opracowanie własne |
|
|
|
Czystość mikrobiol |
|
|
|
|
|
Wyniki badań wykonanych dla maści przemysłowej i maści sporządzonych na pracowni umieszczono w tabeli 5
Tabela 5
Badanie nazwa aparatu |
Kryterium akceptacji norma |
Wyniki badania dla maści: jednostka |
||
|
|
przemysłowa |
sporz. na I prac |
zmodyfikowana |
pH
|
|
5,56 |
5,70 |
|
homogenność
|
|
5x5 2x2 8x5 5x5 5x5 5x4 3x2 5x4 4x4 5x3 |
4x5 4x4 2x2 2x1 2x1 2x2 5x3 2x2 2x1 4x3 |
2x2 5x3 2x2 2x1 4x3 3x2 5x4 4x4 5x3 2x2 |
rozciągliwość (wiskoelastyczność) pola powierzchni rozciągniętej maści [cm^2] |
|
1 1,21 3,61 6,44 11,55
|
3,8 7,02 12,58 19,32 27,44
|
3,6 7,90 13,04 19,98 28,40
|
przylepność
|
|
18,45g |
50g |
45g |
Wyniki badań rozciągliwości maści przemysłowej przy obciążeniu [cm^2]:
50g -1,21
100g - 3,61
500g -6,44
1000g - 11,55
Wyniki badań rozciągliwości maści sporządzonej na pracowni I przy obciążeniu:
50g - 7,02
100g - 12,58
500g -19,32
1000g - 27,44
Wyniki badań rozciągliwości maści o zmodyfikowanym składzie sporządzonej na pracowni IV przy obciążeniu:
50g -7,90
100g - 13,04
500g -19,98
1000g - 28,40
Krzywe rozciągliwości (wiskoelastyczności) badanych maści.
1.1P.5 Opakowanie
Opakowanie bezpośrednie preparatu przemysłowego…………………………………. stanowi tuba aluminiowa, wewnętrznie lakierowana. Tuba zamknięta jest polietylenową nakrętką zaopatrzoną w przebijak. Preparat…………………………………………….pakowany jest nie mniej niż ……….g. Na tubie znajduje się napis.
Opakowanie bezpośrednie preparatu sporządzonego na pracowni …………………………………………… stanowią pudełka apteczne.
Preparat maść z detreomycyną Pakowany jest nie mniej niż 5g. Na pudełku aptecznym znajduje się napis.
1.1.P.5.1 Przechowywanie
Preparat maść z detreomycyną należy przechowywać w oryginalnym, szczelnie zamkniętym opakowaniu, w temperaturze nie wyższej niż 25C
Okres ważności ….. lata od daty produkcji
1.1.P.5.2 Opakowanie bezpośrednie i system jego zamknięcia (dotyczy preparatu przemysłowego)
Opakowaniem bezpośrednim preparatu Detreomycyni jest tuba aluminiowa z napisem. Opakowanie zawiera 10g kremu i jest przeznaczone do wielokrotnego używania. Tuba aluminiowa jest zamykana z jednej strony polietylenową nakrętką, a z drugiej strony, po uzupełnieniu tuby- poprzez spłaszczenie pobocznicy i kilkukrotne jej zagięcie.
Specyfikacja opakowania bezpośredniego przewiduje następujące wymagania:
- masa
-nadruk
-szczelność
-sprawność i trwałość gwintu
-wygląd zewnętrzny
-wymiary
-zapach tworzywa
1.1.P.6 Trwałość
Badania stabilności preparatu maść z detreomycyną sporządzonego na pracowni I prowadzi się zgodnie z zaleceniami Międzynarodowej Komisji ds. Harmonizacji
Warunki długoterminowe: badania w przemyśle farmaceutycznym
250C±20C 60%RH+5%
Czas: 0,1,2,3 miesiące
Warunki przyspieszone: badania w przemyśle farmaceutycznym
400C±20C 75%RH+5%
Czas: 0,1,3 miesiące
Warunki badań stabilności prowadzonych na pracowni :
200C±20C
Czas 0,1,2,3 tygodnie
400C±20C
Czas 0,1,2,3 tygodnie
Temperatury zmienne: 00C±20C i 400C±20C
Czas 0,1,2,3 tygodnie
Po czasie 0 i 3 tygodnie badamy pH preparatów sporządzonych na pracowni.
Pomiar pH maści
Pomiar pH przeprowadza się w następujący sposób: do 1g maści dodaje się 10ml wody destylowanej, dokładnie miesza i bada pH roztworu za pomocą pehametru
Wyniki badań trwałości maści zawiesin sporządzonych na pracowni umieszczono w tabeli 6.
Tabela 6
Preparat …………………. |
Czas badania tydzień
|
pH |
Stabilność 200C±20C
|
Stabilność 400C±20C
|
Stabilność 00C±20C i 400C±20C
|
Skład preparatu |
0 |
5,70 |
- |
- |
- |
|
1 |
- |
Brak zmian |
Brak zmian |
Brak zmian |
|
2 |
- |
Brak zmian |
Brak zmian |
Brak zmian |
|
3 |
|
Brak zmian |
Widoczne pęcherze gazu |
Widoczne pęcherze gazu |
Badania stabilności zarówno w warunkach długoterminowych jak i przyspieszonych prowadzone są zgodnie ze Specyfikacją Produktu Końcowego
Wnioski
Otrzymane wyniki badań stabilności potwierdzają, iż badany preparat maść z detreomycyną w w/w warunkach stanowi stabilną emulsję, spełnia również wszystkie stawiane mu wymagania.
proszę opisać właściwości substancji pomocniczych wchodzących w skład podłoża maściowego
proszę opisać właściwości substancji pomocniczych wchodzących w skład podłoża maściowego
12
cm2
[g]
Wyszukiwarka
Podobne podstrony:
raport podłoża masciowe 2013, materiały farmacja, Materiały 4 rok, tpl, maści protokoły
raport hydrożele 2113, materiały farmacja, Materiały 4 rok, tpl, maści protokoły
Maści pytania, materiały farmacja, Materiały 4 rok, TPL 2
1 maści ochronne, materiały farmacja, materiały V rok, TPL, do zaliczenia, na kolokwium
TPL otwarte, materiały farmacja, Materiały 4 rok, tpl, na zaliczenie
pytania tple, materiały farmacja, materiały V rok, TPL, do zaliczenia, na kolokwium
ZALICZENIE WYKŁADÓW I ĆW 5 ROKU, materiały farmacja, materiały V rok, TPL
tpl zal- moje dopiski, materiały farmacja, Materiały 4 rok, tpl, na zaliczenie
TPPL wykłady a.d. 2011-2012, materiały farmacja, Materiały 4 rok, tpl, na zaliczenie
FILE010, materiały farmacja, Materiały 4 rok, TPL 2
TPL otwarte, materiały farmacja, Materiały 4 rok, tpl, na zaliczenie
pytania egzamin I termin, Płyta farmacja Poznań, V rok, TPL - EGZAMIN, TPL pytania, TPL pytania
Zadanie z zaliczenia, Płyta farmacja Poznań, V rok, TPL, zaliczenie
Zagadnienia TPL 3 rok, Płyta farmacja Poznań, V rok, TPL - EGZAMIN
WYKAZ ZAGADNIEŃ NA KOLOKWIUM ZALICZENIOWE Z ĆWICZEŃ, Płyta farmacja Poznań, V rok, TPL, zaliczenie
3. TPL - wykłady z receptury jałowej, Płyta farmacja Poznań, V rok, TPL - EGZAMIN
tpl pytania 123, Płyta farmacja Poznań, V rok, TPL - EGZAMIN, TPL pytania, TPL pytania
rok3.WYKŁAD 1-15 tpl, Płyta farmacja Poznań, V rok, TPL - EGZAMIN
więcej podobnych podstron