|
INSTYTUT INŻYNIERII ŚRODOWISKA UNIWERSYTET ZIELONOGÓRSKI
|
|
|
CHEMIA FIZYCZNA LABORATORIUM
|
|
III ROK INŻYNIERII ŚRODOWISKA STUDIA DZIENNE GRUPA 36 C
|
12.05.2003 TYDZIEŃ V |
|
WSPÓŁCZYNNIK PODZIAŁU (NERSTA) KWASU BENZOESOWEGO POMIĘDZY FAZĄ WODNĄ, A FAZĄ ORGANICZNĄ
TEMAT IV
AUTOR OPRACOWANIA:
TOMASZ GACEK
|
||
CZĘŚĆ TEORETYCZNA
Fazą nazywamy jednolitą część układu, ograniczaną wyraźną powierzchnią od pozostałych części i posiadającą w każdym punkcie takie same właściwości. Powierzchnia odgraniczająca od siebie fazy nie jest powierzchnią w sensie matematycznym; jest to bardzo cienka warstwa, w której następuje przejście od właściwości jednej homogenicznej fazy do drugiej. Faza może być jedno lub wieloskładnikowa.
Składniki niezależne fazy to te składniki, których znajomość jest niezbędna dla termodynamicznego opisu układu. Liczbę składników niezależnych otrzymujemy odejmując od liczby wszystkich składników liczbę wiążących je równań.
Reguła faz Gibbsa to zależność wiążąca liczbę faz z liczbą stopni swobody w układzie wieloskładnikowym, w danych warunkach zewnętrznych. Regułę faz Gibbsa opisuje równanie, które podaje liczbę stopni swobody n układu złożonego z ![]()
składników i ![]()
faz:
n = ![]()
Stopień swobody jest to parametr (ciśnienie, temperatura, skład), który można zmieniać w sposób niezależny, nie zmieniając liczby składników i faz układu. Jeżeli ciśnienie zewnętrzne jest ustalone, to reguła faz Gibbsa przyjmuje postać:
n = ![]()
Prawo podziału Nernsta - kiedy do układów dwóch praktycznie nie mieszających się cieczy dodamy trzeci składnik rozpuszczający się w obu cieczach, wówczas stosunek stężeń tego składnika w dwóch fazach ciekłych będzie określony zależnością:
![]()
gdzie:
![]()
- stężenia w fazie (1) i (2)
K - współczynnik podziału Nernsta
Rozważmy układ izotermiczno-izobaryczny, złożony z dwóch praktycznie nie mieszających się cieczy A i B.
Faza 1 faza 1
faza 2
Oznaczmy wytworzone fazy przez 1 i 2. Faza 1 jest nasyconym roztworem B w A, faza 2 jest nasyconym roztworem A w B.
Wprowadzimy do jednej z tych faz ( do fazy 2) niewielka ilość substancji C rozpuszczalnej w obydwu fazach. Rozpocznie się proces przeniesienia substancji C przez powierzchnię międzyfazową z fazy 2 do fazy 1. Proces ten będzie trwał tak długo aż się ustali równowaga termodynamiczna. Zgodnie z II zasada termodynamiki dla układów wielofazowych, w stanie równowagi potencjały chemiczne danego składnika muszą być jednakowe we wszystkich fazach. Czyli potencjał chemiczny składnika C w fazie 1 ![]()
![]()
musi wyrównać się z potencjałem chemicznym tego składnika w fazie 2 ![]()
![]()
![]()
więc:
![]()
![]()
![]()
gdzie:
![]()
i ![]()
- standardowe potencjały chemiczne składnika C w fazach 1 i 2
![]()
i ![]()
- aktywności składnika C w fazach 1 i 2
Po przekształceniach:
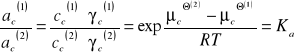
W równaniach tych stan standardowy został wybrany w ten sposób, że współczynniki aktywności ![]()
i ![]()
są równe jedności w roztworach nieskończenie rozcieńczonych.
Dla stężeń skończonych określa się współczynnik Nernsta, wyrażony za pomocą stężeń:
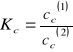
Tak zmodyfikowany współczynnik podziału zależy od stężenia. Przeprowadzając ekstrapolacją wartości Kc do stężenia substancji rozpuszczonej C równego zeru (rozcieńczenie nieskończenie wielkie) :
![]()
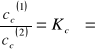
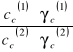
Otrzymujemy tzw. Ekstrapolowaną wartość współczynnika podziału Kc.
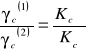
Współczynnik podziału Nernsta Kc zmienia się ze stężeniem dlatego, że roztwory nie są doskonałe. Przyczyną odstępstw od doskonałości są oddziaływania między cząsteczkowe.
Ekstrakcja- jest stosowana w laboratorium do rozdzielenia , koncentrowania i wykrywania wielu pierwiastków i związków. Ekstrakcja jest również jedną z ważnych metod technicznych m. in. spełnia podstawową rolę przy rafinacji i odsiarczaniu olejów smarowych, przy odzyskiwaniu metali z wód opadowych i przy rozdzielaniu izotopów powstających w czasie pracy reaktorów atomowych.( produkcja antybiotyków tez oparta na metodach ekstrakcji.
Ekstrakcja - jest to proces przejścia kwasów i związków metali z fazy wodnej do rozpuszczalników organicznych , nie mieszających się z wodą.
Ponieważ poddana ekstrakcji substancja ulega zwykłym procesom dysocjacji , asocjacji, solwatacji i innym reakcją chemicznym w praktyce zamiast stałej podziału oznacza się wielkość zwaną współczynnikiem podziału D.
D= Σ [A]0 / Σ [A]aq = C0 /Caq
Współczynnik podziału jest to zatem stosunek całkowitego stężenia danej substancji w fazie organicznej C0 do całkowitego jej stężenia w fazie wodnej Caq .
Jeżeli substancja nie ulega w czasie procesu ekstrakcji żadnym zmianom w obu fazach , wodnej i organicznej to współczynnik podziału jest równy stałej podziału.
Ekstrakcji z fazy wodnej do fazy organicznej mogą ulegać tylko cząstki pozbawione ładunku elektrycznego.
![]()
CZĘŚĆ OBLICZENIOWA
1. METODYKA
Wyznaczanie współczynnika podziału kwasu benzoesowego pomiędzy fazą wodną, a ksylenową sprowadza się do : wymieszania w rozdzielaczach odważonej masy kwasu z dwufazową mieszaniną woda - ksylen, przeprowadzania ekstrakcji, dokonania odpowiednich analiz i obliczeń.
2. MATERIAŁY
Aparatura : 4 rozdzielacze ( 100 cm3 ), 4 naczyńka wagowe, zestaw do miareczkowania, pipety ( 5 cm3 ), 2 erlenmeyerki ( 100 cm3 ), statyw do rozdzielaczy, cylinder miarowy ( 50 cm3 ), łaźnia wodna.
Odczynniki: ksylen ( cz. d. a . ), woda destylowana, 0,01 molowy roztwór NaOH do miareczkowania, wskaźnik
3. WYKONANIE ĆWICZENIA
Na wadze analitycznej odważyć w naczyńkach wagowych 4 próbki kwasu benzoesowego, od 0,03 do 0,3 g. Wsypać je do 4 rozdzielaczy i do każdego wlać ( cylinder 50 cm3 ) 25 cm3 ksylenu. Po rozpuszczeniu się kwasu benzoesowego, do każdego rozdzielacza wlać 35 cm3 wody. Wstrząsnąć przez ok. 5 min. Po sklarowaniu się faz rozdzielić fazę wodną od fazy ksylenowej i oznaczyć, w każdej z faz, całkowite stężenie kwasu benzoesowego.
W tym celu z każdej fazy ksylenowej należy pobrać dwukrotnie po 2 cm3 roztworu, dodać 20 cm3 wody, odparować na łaźni wodnej ksylen i miareczkować na gorąco 0,01 molowym NaOH wobec fenoloftaleiny.
Z faz wodnych pobrać dwukrotnie po 5 cm3, dodać 20 cm3 wody i po ogrzaniu na łaźni wodnej miareczkować jak wyżej
OBLICZENIA
Próbki z fazy ksylenowej:
Naważki kwasu [g] |
NaOH [cm3] |
0,3 |
17,7 |
0,03 |
2,5 |
Próbki z fazy wodnej:
Naważki kwasu [g] |
NaOH [cm3] |
0,3 |
5,7 |
0,03 |
2,5 |
Stężenia kwasu benzoesowego w wodzie - c(1)
![]()
![]()
0,01 - stężenie NaOH, [mol/dm3]
VNaOH - objętość NaOH zużyta do miareczkowania, [cm3]
V - objętość próbki wody pobranej z fazy wodnej, [cm3]
naważka=0,3g ,VNaOH= 5,7 [cm3] , V = 5 [cm3]
![]()
naważka=0,03g , VNaOH= 2,5 [cm3] , V = 5 [cm3]
![]()
Stężenia kwasu benzoesowego w ksylenie - c(2)
![]()
![]()
0,01 - stężenie NaOH, [mol/dm3]
VNaOH - objętość NaOH zużyta do miareczkowania, [cm3]
V - objętość próbki wody pobranej z fazy ksylenowej, [cm3]
naważka=0,3g ,VNaOH= 17,7 [cm3], V = 2 [cm3]
![]()
naważka=0,03g , VNaOH= 2,5 [cm3], V = 2 [cm3]
![]()
Oznaczając stężenie kwasu benzoesowego w wodzie przez c(1) oraz w ksylenie przez c(2) przedstawić wyniki pomiarów w tabeli 1. Zgodnie z równaniem [1]:
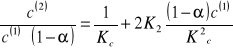
W tabeli obliczyć stosunek c(2)/ c(1); stosunek c(2)/ c(1)(1 - α) oraz c(1) (1 - α), przyjmując stałą dysocjacji kwasu benzoesowego Kt= 6,46 x 10-5.
![]()
Zakładając, że ![]()
jest niskie otrzymujemy:
![]()
stąd:
![]()
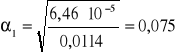
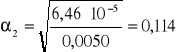
Wyniki pomiaru współczynnika podziału :
Lp. |
naważki kwasu [g] |
c(1) [mol/dm3] |
c(2) [mol/dm3] |
c(1) (1 - α) |
c(2)/ c(1) |
c(2)/ c(1)(1 - α) |
1 |
0,3 |
0,0114 |
0,0885 |
0,011 |
7,763 |
8,045 |
4 |
0,03 |
0,0050 |
0,0125 |
0,004 |
2,500 |
3,125 |
Wartość stałej asocjacji, otrzymana z nachylenia prostej równanie [1] wynosi :
K 2 = 495,8, zaś współczynnik podziału Kc = 0,869.
WNIOSKI:
Zgodnie z II Zasadą Termodynamiki dla układów wielofazowych, w stanie równowagi potencjały chemiczne danego składnika są jednakowe we wszystkich fazach. Podczas przeprowadzanego ćwiczenia można zauważyć, że potencjały chemiczne danych składników nieznacznie się różnią (są prawie takie same).Wraz ze spadkiem stężenia kwasu benzoesowego stopień dysocjacji rośnie.
Współczynnik podziału Nernsta zależy od stężeń (roztwory nie są doskonałe, przyczyną są oddziaływania międzycząsteczkowe).Wraz ze wzrostem stężenia ![]()
i stężenia ![]()
wartość tego współczynnika maleje
LITERATURA:
1. Sobczyk l.,Kisza A.,Gatner K.,Koll A., Eksperymentalna chemia fizyczna, PWN Warszawa
2. Praca zbiorowa, Chemia fizyczna, PWN Warszawa
3. Pigoń K., Ruziewicz Z., Chemia fizyczna, PWN Warszawa
8
- 8 -
C
![]()
Wyszukiwarka
Podobne podstrony:
Część teoretyczna
Cw 1 Drożdże częśc teoretyczna
Część teoretyczna
Sprawozdania Karol, Współczynnik podziału, Gr
lab 7 - współczynnik podziału słabego kwasu pomiędzy fazą wodną a organiczną, kiciaqq
Cześć teoretyczna
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
Współczynnik podziału Sprawozdanie
Melas – czesc teoretyczna
Część teoretyczna
Zajecia! 11 2007 r czesc teoretyczna
Egzamin końcowy-, CHIRURGIA PYT LIC. (1), Egzamin licencjacki dla kierunku: Pielęgniarstwo, STUDIA L
laborki od klocka, E2 - Badania zmian oporu elektrycznego elektrolitu, półprzew, CZĘŚĆ TEORETYCZNA
ts - zadania, Egzamin z Teorii Systemów (test otwarty) 7 II 2005, Egzamin pisemny z Teorii Systemów
laborki od klocka, E2 - Badania zmian oporu elektrycznego elektrolitu, półprzew, CZĘŚĆ TEORETYCZNA
ts - zadania, Egzamin z Teorii Systemów (test otwarty) 7 II 2005, Egzamin pisemny z Teorii Systemów
Dynamika Wykłady Część teoretyczna
110 Podzialy komorkowe czesc 2
więcej podobnych podstron