I. WODÓR
1. Położenie wodoru w układzie okresowym i jego ogólne właściwości
Struktura elektronowa atomu wodoru: 1s1
Stopnie utlenienia wodoru: +1 i -1:
*Podobieństwo do litowców
+ 1 stopień utlenienia (H+), np. HCl, H2O, H2SO4
*Podobieństwo do fluorowców
- 1 stopień utlenienia (H-) → wodorki metali (np. LiH),
- nietrwały w obecności wody :
H- + H2O = H2 + OH-
- elektroujemność (A-R):
H 2,20
Litowce 0,97 - 0,86
Fluorowce 4,10 - 2,21
Wodór jest niemetalem, ale w specjalnych warunkach może być metalem (wysokie ciśnienie).
- promień atomowy:
Wodór 37 pm
Litowce 90 - 194 pm
2. Metody otrzymywania wodoru
Rozkład wody
Niektóre metale roztwarzają się w wodzie:
Na + H2O = 1/2H2 + Na+ + OH-
W wodzie roztwarzają się także: Li, K, Rb, Cs, Ca, Sr, Ba
Elektroliza wody - wodnych roztworów elektrolitów, np. NaCl
katoda : 2H+ + 2e = H2
b) Z kwasów i zasad
metal nieszlachetny + kwas → wodór
Zn + 2H+ = Zn2+ + H2
Fe + 2H+ = Fe2+ + H2
amfoteryczny metal nieszlachetny + zasada → wodór
Zn + 2OH- + 2H2O = [Zn(OH)4]2- + H2
2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2
c) Z gazu ziemnego
CH4 + 2H2O = CO + 3H2 700 K
CO + H2O = CO2 + H2 katalizator Ni
d) Z koksu
C + H2O = CO + H2 1500 K
CO + H2O = CO2 + H2
Uwaga:
otrzymywanie wodoru przez elektrolizę wody, z gazu ziemnego i koksu to metody przemysłowe.
Pozostałe metody mają jedynie zastosowanie w laboratorium (metody laboratoryjne).
3. Izotopy wodoru
Znane są 3 izotopy wodoru:
H 99,98% prot |
D 0,016% deuter |
T ~10-16 % tryt |
D ≡ 12H, T ≡ 13H
Tryt (13H) jest promieniotwórczy; powstaje samorzutnie w atmosferze w wyniku reakcji jądrowej:
D2O - ciężka woda - otrzymywanie przez długotrwałą elektrolizę wody
4. Wodór atomowy i cząsteczkowy
H2 - cząsteczka bardzo trwała (w normalnych warunkach)
H2 ⇔ 2H ΔHθ- = +436 kJ/mol
reakcja endotermiczna → reakcji rozkładu sprzyjają wysokie temperatury:
1000 K α = 0,12 %
3000 K α = 9,0 %
4000 K α = 62 %
Wpływ ciśnienia - niskie ciśnienie sprzyja rozkładowi wodoru.
Wodór aktywny = wodór in statu nascendi (w chwili powstania)
np. redukuje KMnO4
Dwie odmiany wodoru cząsteczkowego
ortowodór i parawodór
para - przeciwne |
W temperaturze 25 0C wodór składa się z 75 % obj. ortowodoru i w 25 % obj. parawodoru.
W miarę oziębiania, zawartość parawodoru rośnie (odmiany uboższej
w energię) i w 20 K dochodzi do 99,7%.
Odmiany te różnią się m.in. ciepłem właściwym.
6. Właściwości chemiczne wodoru
W temperaturze pokojowej - niezbyt aktywny.
Łączy się z fluorem (HF) a podczas naświetlania też z chlorem (HCl).
W podwyższonych temperaturach reaguje :
- z niemetalami
- z metalami
Reakcja z tlenem :
- do 450 K brak reakcji
- 450 ÷ 720 K reakcja przebiega z bardzo niską szybkością
- > 720 K reakcja przebiega wybuchowo:
H2 + 1/2 O2 = H2O ΔHo - = -286 kJ/mol
Mieszanina H2 : O2 w stosunku objętościowym 2 : 1 to mieszanina
piorunująca.
Palnik Daniella - temp. do 3000 K
Palnik Daniella
Wodór jest silnym reduktorem w podwyższonych temperaturach
CuO + H2 Cu + H2O
3Fe2O3 + H2 2Fe3O4 + H2O
Fe2O3 + H2 2FeO + H2O
Fe2O3 + 3H2 2Fe + 3H2O
7. Wodorki
Są to połączenia wodoru z innymi pierwiastkami o ogólnym wzorze:
XmHn |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Na |
Mg |
|
|
|
|
|
|
|
|
|
|
Al |
Si |
P |
S |
Cl |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Cs |
Ba |
La-Lu |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Fr |
Ra |
Ac |
|
|
U, Pu |
|
|
|
|
|
|
|
|
|
|
|
jonowe metaliczne kowalencyjne*
*z pierwiastkami najbardziej elektroujemnymi (N, O, F, Cl) łączą się tworząc spolaryzowane wiązania kowalencyjne.
Wodorki metali I-szej i II grupy głównej rozkładają się w wodzie:
CaH2 - wodorek wapnia
CaH2 + 2H2O = Ca2+ + 2OH- + 2H2
Inne przykłady wodorków:
H2O, NH3, CH4, HCl - wodorki stechiometryczne
PdH0,6 TiH1,73 ZrH1,92 - wodorki niestechiometryczne
Zastosowanie wodorków - magazynowanie wodoru, np.
MgH2, LaNi5H6 → po podgrzaniu wydzielają wodór
wodorek metal + wodór
7.1. Woda
1) Budowa cząsteczki wody - patrz wykład Chemia Ogólna
Skutek: hydratacja jonów oraz rozpuszczalność elektrolitów w wodzie.
2) Woda w świetle teorii kwasowo-zasadowych - patrz wykład Podstawy Chemii Nieorganicznej
3) Wiązania wodorowe - skutki tego wiązania w przypadku wody
- patrz wykład Chemia Ogólna
Woda jest jedynym związkiem chemicznym występującym na Ziemi
we wszystkich trzech stanach skupienia (woda, lód, para wodna). Posiada niezwykłe właściwości fizykochemiczne.
Gęstość wody wraz z temperaturą zmienia się w sposób anormalny - maksymalną gęstość posiada woda w temperaturze +3,98 oC
temp. (oC) gęstość (kg/dm3)
0 (lód) 0,9159
0 (ciecz) 0,9998
3,98 1,000
5 0,9999
20 0,9982
40 0,9922
300 0,7100
Patrz - wykres fazowy wody - wykład z Chemii Ogólnej.
Inne właściwości wody (w 25oC):
Ciepło topnienia 6,01 kJ/mol
Ciepło parowania 44,0 kJ/mol
Pojemność cieplna 4,17 J/g ⋅K
Napięcie powierzchniowe 72,0 ⋅ 10-3 J/m2
Jedną z najbardziej anormalnych właściwości ciekłej wody jest jej wysoka pojemność cieplna - zapobiega gwałtownym zmianom klimatu.
Umożliwia to prądom oceanicznym zanieść ciepło znad równika w rejony podbiegunowe.
Właściwości różnych form wody:
|
H2O |
2H2O |
1H218O |
2H218O |
3H2O |
gęstość maks., kg/m3 Temp. maks. gęstości, oC |
999,972 3,984 |
1106,00 11,185 |
1112,49 4,211 |
1216,88 11,438 |
1215,01 13,403 |
2H2O ≡ D2O (woda ciężka)
Różne rodzaje wody
ciężka - królewska,
gruntowa, głębinowa, - wapienna,
morska, - chlorowa,
czysta, zanieczyszczona (ścieki), - siarkowodorowa,
destylowana, - krystalizacyjna,
demineralizowana, - konstytucyjna,
mineralna, - twarda, miękka.
utleniona,
7.2. Nadtlenek wodoru
Powstaje z nadtlenków metali; np. z nadtlenku baru
BaO2 + H2SO4 = BaSO4 + H2O2
Roztwory wodne nadtlenku wodoru:
30% - perhydrol, 3% - woda utleniona
Nadtlenek wodoru jest nietrwały:
2H2O2 = 2H2O + O2 ΔHo = +99 kJ/mol
Dodatek rozdrobnionej Pt, Ag, MnO2 oraz matowana powierzchnia przyspieszają rozkład H2O2.
Wykazuje słabe właściwości kwasowe:
H2O2 + H2O = H3O+ + HO2- Ka = 1,5 ⋅10-12
H2O2 jest silnym środkiem utleniającym:
H2O2 + 2H+ + 2e → 2H2O Eo = +1,77 V
np:
2[Cr(OH)4]- + 3H2O2 + 2OH- = 2CrO42- + 8H2O
H2O2 może również wykazywać właściwości redukujące:
H2O2 → 2H+ + O2 + 2e E0 = +0,695 V
np:
2MnO4- + 6H+ + 5H2O2 = 2Mn2+ + 8H2O + 5O2
8.Wodór jako paliwo przyszłości
Najbardziej perspektywicznym paliwem jest wodór, który spala się wg reakcji:
2H2 + O2 = 2H2O -142 MJ/kg
Podczas spalania 1kg wodoru wydziela się 142 MJ energii, a powstająca woda, jest w 100 % ekologiczna. Reakcja ta może być realizowana w tzw. ogniwie paliwowym.
Dla porównania ze spalenia 1 kg węgla i 1 kg metanu otrzymuje się odpowiednio 33 i 50 MJ energii (przy 100 % wydajności tych reakcji). Jednak nie rozwiązany jest, jak dotychczas, problem magazynowania tego paliwa gazowego. Można to realizować na następujące sposoby:
Sprężanie wodoru - ciśnienie 300 - 700 atm.,
Skraplanie wodoru - temperatura - 253 ºC,
Zamiana w wodorki, np. NaAlH4 oraz wodorki Sm i Co,
Absorbenty wodoru, np. nanorurki węglowe.
Status stosowalności tych sposobów magazynowania wodoru jest: - w przypadku dwóch pierwszych - dostępny,
- w trzecim w opracowaniu,
- a w czwartym na etapie wczesnych prac badawczych.
Koniec rozdz. I
Władysław Walkowiak Wykład - Chemia Nieorganiczna
1/17
ChN_Wykład 1_I. Wodór
spiny
}
} powstają wodorki
420 K
530 K
800 K
900 K
wysoka temp.
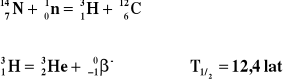
Budowa cząsteczki H2O2:
Wyszukiwarka
Podobne podstrony:
Wykład 8 Berylowce CHC13005w, VII BERYLOWCE
Wykład 3 Fluorowce CHC13005w, II. FLUOROWCE
Wykład 6 Weglowce CHC13005w, chemia, chemia ogólna ; nieorganiczna ; metale
Wykład Wprowadzenie CHC13005 w, CHEMIA NIEORGANICZNA II CHC 1040 s
Wykład 7 Borowce CHC13005w, VI. BOROWCE
Wykład 5 Azotowce CHC13005w, IV. AZOTOWCE - ChN II
Wodor, WAT chemia zaocznie, chemia nieorganiczna wyklady
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Wodór technologia2
SPRAWOZDANIE wodór
Geografia-super(PLIKI), geografia klimat, Atmosfera : azot (78%), tlen 21%, argon 0,9%, inne 0,1% (n
ZGAZOWAIE, WODÓR
Wodór i helowce
geografia klimat, Atmosfera : azot (78%), tlen 21%, argon 0,9%, inne 0,1% (neon, hel, krypton, wodór
Wodór
2 wodór
04-Wodór TECH, Materiały PG, Nieorgana
więcej podobnych podstron