WODÓR
Najbardziej rozpowszechniony pierwiastek we wszechświecie 89 %.
Na ziemi około 1 %, ale około 15 % wszystkich atomów. Występuje przede wszystkim w stanie związanym. Woda i minerały typu hydraty. W atmosferze tylko ślady wodoru w stanie wolnym.
Właściwości fizyczne.
Bezbarwny gaz bez smaku i zapachu, słabo rozpuszczalny we wodzie. W normalnych warunkach cząsteczki H2. Tw = 20.4 K, łatwo dyfunduje. Dobre przewodnictwo cieplne. Inne izotopy:
2H = D (deuter 0,016 %), ciężka woda D2O, deuterowane odczynniki.
3H = T, tryt, promieniotwórczy, znakowanie odczynników. t½ = 12.4 lata, emiter β (elektronów) 31T = 32He + -10β-
Otrzymywanie wodoru (metody laboratoryjne)
Reakcja metalu z kwasem Zn + 2HCl = ZnCl2 + H2
Reakcja niektórych metali mających właściwości amfoteryczne z zasadami 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
Napisz podobną reakcję Zn z NaOH.
Reakcja metalu z wodą 2Na + 2H2O = 2NaOH + H2
Ba + 2H2O = Ba(OH)2 + H2
Reakcje wodorków z wodą CaH2 + 2H2O = Ca(OH)2 + 2H2
jonowo H- + H2O = OH- + H2
Otrzymywanie wodoru (metody przemysłowe)
C + H2O = CO + H2 (1500 K) ΔH = 132 kJ · mol-1
i CO(g) + H2O(g) = CO2(g) + H2(g) ΔH = -42 kJ · mol-1 600K (konwersja gazu syntezowego, katalizator Fe-Cu), wymywanie CO2.
CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = 205 kJ · mol-1 (gaz syntezowy, katalizator niklowy)
Podczas krakingu węglowodorów w rafineriach
Elektroliza wody: a) z H2SO4 b) z NaOH
a) katoda 2H+(aq) + 2e = H2(g) anoda H2O(l) =½O2(g) + 2H+(aq) + 2e
b) H2O(l) + 2e = H2(g) + 2OH-(aq) 2OH-(aq) = ½O2(g) + H2O(l) + 2e
Właściwości chemiczne.
Trwałe cząsteczki H2. H2 → H + H ΔH = 436,0 kJ · mol-1 .
Jest to jedno z najsilniejszych wiązań pojedynczych. Dlatego w normalnych warunkach stosunkowo mało reaktywny. Podgrzany reaguje znacznie szybciej.
Reakcje H2
H2 → 2H+(aq) + 2e właściwości redukujące
a) mieszanina piorunująca 2H2 + O2 = 2H2O
b) redukcja tlenku miedzi (II) CuO + H2 = Cu + H2O
c) redukcja wodorem „in statu nascendi”- w chwili powstawania
KMnO4 w środowisku kwaśnym Mn(+7) + 5e = Mn(+2)
Zn + H2SO4 (rozcieńczony) = ZnSO4 + 2H (H2*)
2 KMnO4 + 3H2SO4 + 10H (5H2*) = K2SO4 + 2MnSO4 + 8H2O
KMnO4 w środowisku zasadowym Mn(+7) + e = Mn(+6)
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 6H (3H2*)
2 KMnO4 + 2KOH + 2H (H2*) = 2K2MnO4 + 2H2O
Napisz równanie tej reakcji w wersji jonowej.
Reakcje H2 + 2e = 2H- (-1) właściwości utleniające 2K + H2 = 2KH
H-. Bardzo silna zasada, bardzo silny reduktor.
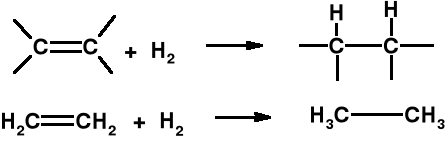
Reakcje H2 - tworzenie nowych wiązań kowalencyjnych.
Zastosowanie wodoru.
a) Synteza amoniaku N2(g) + 3H2(g) → 2NH3(g) (katalizator żelazny)
ΔH = -92.4 kJ · mol-1 (50% produkcji) (Fe3O4 + K2O + Al2O3) + H2
b) Produkcja metanolu CO(g) + 2H2(g) → CH3OH(c) (katalizator kobaltowy, proces „oxo”)
c) Uwodornianie tłuszczów (katalizator niklowy) - produkcja margaryny. H2(g) + ·····C==C····· (c) ·····CH—-CH····· (c)
d) Rafinerie
e) Hydrometalurgia np. Cu2+(H2O) + 2H2(g) = Cu(s) + 2H+( H2O)
f) Redukcja związków metali, tlenki Mo i W do metali w fazie stałej.
g) Synteza chlorowodoru Cl2(g) + H2(g) → 2HCl(g)
h) Paliwo rakietowe (ciekły wodór).
i) Spawanie - palniki tlenowodorowe.
Wodorki
Wodorki typu soli. Metale bloku s - wodorki typu soli, nielotne substancje, nie przewodzące prądu w stanie stałym. Mają charakter wodorkowy, czyli są donorem jonu H- (d = 154 pm). Kationy M+ (litowce) lub M2+ (berylowce oprócz Be i Mg). Wodorki BeH2, MgH2 i AlH3 nie mają typowego charakteru soli. Mają właściwości pośrednie między charakterem soli a charakterem wodorków cząsteczkowych (kowalencyjnych).
Synteza 2Li + H2 = 2LiH
Właściwości CaH2 + 2H2O = Ca(OH)2 + 2H2
Donor H- 4LiH + AlCl3 = Li[AlH4] + 3LiCl
Wodorki metaliczne. Przewodzą prąd elektryczny w stanie stałym. Zmienny skład stechiometryczny np. ZrHx (x = 1,30 - 1,75). łatwo oddają wodór przy nieco podniesionej temperaturze. Potrafią gromadzić wodór (szczególnie Pd, tworząc PdHx, x > 1). Oczyszczanie wodoru przez przepuszczanie przez folię Ag-Pd
Wodorki kowalencyjne. Wszystkie pozostałe. EH4 (gazy), EH3 (gazy), H2E (woda - ciecz, pozostałe gazy), HE (fluorowodór - ciecz, t.w. 19oC, pozostałe gazy). HE - wyraźne właściwości kwasowe we wodzie.
NH3 i H2O wyraźne właściwości zasadowe Lewisa.
H2S, H2Se, H2Te wzrost właściwości kwasowych.
Napisz reakcję NH3 z wodą. Napisz reakcję NH3 z HBr.
1
Wyszukiwarka
Podobne podstrony:
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
7-makroukłady TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
6-VSEPR TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
9-termochemiaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
15-azotowceTECHa, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
19-litowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
17-borowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Konspekt2, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Konspekt3, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Konspekt1, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
więcej podobnych podstron