AZOTOWCE
Azotowiec |
7N |
15P |
33As |
51Sb |
83Bi |
Konfiguracja elektronowa. s2p3 |
[He] 2s22p3 |
[Ne] 3s23p3 |
[Ar] 4s24p3 |
[Kr] 5s25p3 |
[Xe] 6s26p3 |
E.I. [kJ·mol-1] |
1402,3 |
1011,7 |
947,0 |
833,7 |
703,2 |
Promień at. vd Waals [pm] |
160 |
190 |
200 |
220 |
240 |
Temp. topn. [oC] |
-210,5 |
44,1 |
613,1 |
630,8 |
274,4 |
Rozpowszech. litos. [ppm] |
19 |
1200 |
5 |
0,2 |
0,17 |
Elekroujemność (Pauling) |
3,04 |
2,19 |
2,18 |
2,05 |
2,02 |
Główne stopnie utlenienia tych pierwiastków -3, +3 i +5.
AZOT
Azot jest niezbyt rozpowszechniony w litosferze. Jego minerały to KNO3, saletra indyjska i NaNO3 - saletra chilijska. Także guano - odchody ptasie.
N2 (tw = - 196 oC) główny składnik atmosfery. Uzyskuje się go przez rektyfikację ciekłego powietrza (1 dm3 ciekłego azotu 0,5 zł netto)
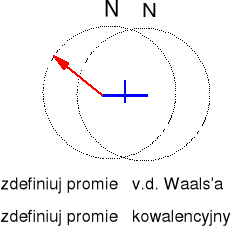
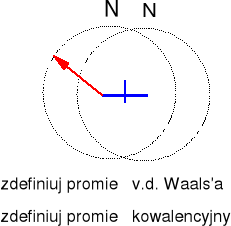
Odległość N-N w N2 109,7 pm.
Promień v.d. Waalsa 160 pm
.
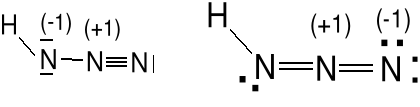
Podaj konfigurację elektr. N2 (LCAO i Lewis)
Pokazy właściwości N2(ciecz) - zjawisko Leidenfrosta, fontanna azotowa
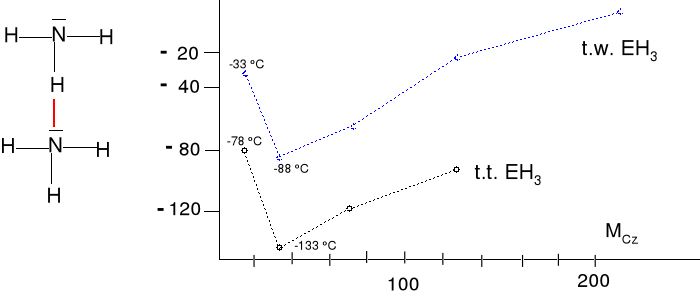
Hg (tt = ok. - 39 oC), C2H5OH (tt = ok. -114 oC), C2H5OC2H5 (tt = ok. - 116 oC)
Skroplenie O2 (tw = - 183 oC), Ar (tt = ok. - 189,5 oC, tw = - 186 oC).
Dimeryzacja NO2 O2N + NO2 O2N—NO2 (bezbarwny)
Kwiaty - kruche, łamliwe, guma krucha, ołów stosunkowo twardy, siarka bieleje.
Otrzymyw. (lab.): NH4Cl + NaNO2 → NaCl + NH4NO2 → 2H2O + N2
Jest to utlenianie kationu NH4+ przez anion NO2-.
Ba(N3)2 → Ba + 3N2
Bardzo silne wiązanie dlatego mała reaktywność.
N2(g) = N(g) + N(g) ΔHodys = + 944,7 kJ
![]()
Właściwości: bezbarwny gaz, nie podtrzymuje palenia.
6Li + N2 → 2Li3N 3Mg(s) + N2(s) → Mg3N2(s) (br-ziel)
są to jonowe substancje o jonie N3- (z małymi jonami metali o małej elektroujemności)
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3 podaj zapis jonowy tej reakcji
Procesy przemysłowe przetwarzające N2 z powietrza. Cel: synteza kwasu azotowego (V) i azotanów. Nawozy sztuczne, materiały wybuchowe
1895 - Proces Frank - Caro (poprzez cyjanamidek wapnia - azotniak)
![]()
![]()
CaO + 3C = CO + CaC2 CaC2 + N2 Ca(CN)2 CaCN2 + C
Reakcja azotowania karbidu jest procesem równowagowym i ważne jest powolne studzenie CaCN2 w strumieniu azotu. Ca2+ (NCN)2-. Podaj kształt jonu CN22-. Jest on izostrukturalny i izoelektronowy do CO2.
1901 - Katalityczne utlenianie NH3 do NO (Ostwald 1909 - Nobel)
1909 - Proces Haber - Bosch bezpośredniej syntezy amoniaku (Haber - 1918 i Bosch 1931, nagrody Nobla).
Właściwa synteza
![]()
N2 + 3H2 2 NH3 ΔHo = - 92,2 kJ
Reguła Le Chatelier - Braun: możliwie niska temperatura 400 oC, katalizator Fe (specialnie przygotowywany) i ciśnienie 200 atm. Obecnie katalizatory rutenowe wypierają katalizatory oparte o tlenek żelaza. Powstały amoniak jest wykraplany z mieszaniny poreakcyjnej.
Zużycie amoniaku: około 85 % nawozy azotowe, z tego:
27 % bezpośrednie użycie jako wody amoniakalnej.
19 % NH4NO3
14 % mocznik (H2N)2CO
9 % fosforany (V) amonu
16 % siarczan amonu i inne nawozy azotowe.
Pozostała ilość to 5 % na materiały wybuchowe i około 10 % na poliamidy i na poliuretany
Amoniak NH3 Laboratoryjnie
Działanie mocnymi zasadami na sole amonowe:
NH4NO3(aq) + KOH(aq ) → KNO3(aq) + NH3.H2O(aq) → H2O(c) + NH3(g)
Działanie silnie zasadowymi tlenkami na chlorek amonu (faza stała)
2NH4Cl(s) + CaO(s) = CaCl2(s) + 2NH3(g) + 2H2O(c)
Bezbarwny trujący gaz, o nieprzyjemnym zapachu, może spowodować natychmiastową utratę przytomności. Łatwo skroplić.
![]()
Skroplony ulega autodysocjacji. NH3 + NH3 NH4+ + NH2-
Co jest kwasem a co jest zasadą w ciekłym amoniaku. Napisz reakcję NH4Cl z NaNH2 w ciekłym amoniaku. Podaj wzór Lewisa dla NaNH2.
Napisz reakcję NH3 z K2O. Jednym z produktów jest KNH2. Zapisz tę reakcję także jonowo.
Doskonale rozpuszcza się we wodzie: w 16 oC 764 dm3/1dm3 wody, d = 0,910 g.cm-3. t.t = - 78 oC, t.w = - 33,5 oC, zasada Lewisa. Wiązanie wodorowe
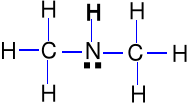
Odczyn roztworu alkaliczny. Podniesienie temperatury powoduje zmniejszenie stałej dysocjacji. W roztworze wodnym nie ma wodorotlenku amonu NH4OH JEST TYLKO HYDRATOWANY NH3(aq)
Słaba zasada. Kz = Kb = 1,7.10-5. Jeszcze raz reakcja i stała dysocjacji.
![]()
![]()
NH3(aq) NH4+(aq) + OH-(aq) NH3.H2O NH4+ + OH-
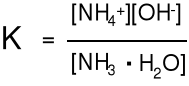
[NH3.H2O], [NH4+] i [OH-]
stężenia molowe w stanie
równowagi.
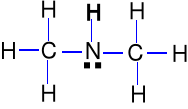
Dimetyloamina Kz = 6,0.10-4
![]()
(CH3)2NH.H2O (CH3)2NH2+ + OH-
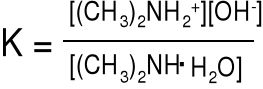
![]()
H
H3C—N—CH3
H
Anilina jest słabszą zasadą niż amoniak; Kz = 4,2.10-10
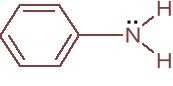
podaj wyrażenie na stałą dysocjacji aniliny we wodzie
Jaki jest odczyn wodnego roztworu chlorowodorku aniliny C6H5NH2∙HCl
![]()
Cl- C6H5NH3+ + H2O C6H5NH2 + H3O+ KA = ![]()
= 2,3∙10-3
Kation aniliniowy jest to prawie średnio silny kwas
![]()
Wykrywanie małych stężeń amoniaku, odczynnik Nesslera.
2K2[HgI4] + 3KOH + NH3 → [OHg2NH2]I + 7KI + 2H2O
Hg H + 2KI + HgCl2 → HgI2 + 2KCl
O N I—
Hg H HgI2 + 2KI → K2[HgI4]
Cu2+ + 4NH3 → [Cu(NH3)4]2+ ciemnoniebieska barwa jonu kompleksowego.
![]()
Reakcja amoniaku z HCl faza gazowa NH3(g) + HCl(g) → NH4Cl(s)
Zadanie. W 1 dm3 wody rozpuszczono 10 cm3 NH3 (w warunkach normalnych). Oblicz stężenie molowe, procentowe i w ppm tego roztworu. Przyjmij gęstość tego roztworu d = 1g ∙cm-3.
Hydrazyna
Produkcja hydrazyny (proces Raschig'a):
NH3 + NaOCl → NaOH + NH2Cl (chloramina)
NH2Cl + H-NH2 + NaOH → N2H4 + H2O + NaCl
Hydrazyna, tt = 2 oC, tw = 111,5 oC.
paliwo rakietowe, reduktor, odtleniacz do wody.
Wiązanie N-N w H2N—NH2 słabe ok. 160 kJ.mol-1. Jest związkiem termodynamicznie nietrwałym, ΔHotw = + 50 kJ.mol-1. Bezwodna ma skłonności do wybuchów. Słabsza zasada niż NH3. Daje dwa szeregi soli. Jest silnym reduktorem.
N2 + 4H2O + 4e = 4OH- + N2H4(aq) Eo = -1,16V
2Ag2O(s) + N2H4(aq) → 4Ag(s) + 2H2O(c) + N2(g)
Odróżnienie Ag2O od Ag: barwa raczej brunatna Ag czarna
Reakcja: Ag2O(s) + H2O(c) + 4NH3(aq) → 2[Ag(NH3)2]OH(aq)
Na jakie jony dysocjuje [Ag(NH3)2]OH(aq).
Napisz reakcję N2H4(aq) + KI3(aq) → ? + ? + ?
hydrazyna jest reduktorem, a I2 w KI (KI3) utleniaczem, zatem hydrazyna się utleni
i otrzymamy azot, KI3 się zredukuje i otrzymamy KI i HI.
Hydroksyloamina NH2OH tt = 33 oC.
Produkcja hydroksyloaminy:
2NO(g) + 3H2(g) + H2SO4(aq) → [NH3(OH)]2SO4(aq) (Pd/C, Pt/C)
Nietrwałe ciało stałe. Słabsza zasada niż NH3. Roztwory wodne soli są trwałe [NH3(OH)]+Cl-. Chlorowodorek hydroksyloaminy. Podaj wzór Lewisa tej soli.
Ma właściwości redukujące:
2Ag2O(s) + 2NH2OH(aq) → 4Ag(s) + 3H2O(c) + N2O(g)
Halogenki azotu.
NH3 + 3F2 → NF3 + 3HF (NF3 trwały gaz)
NCl3 wybuchowa oleista ciecz, typowy chlorek niemetalu.
NH3 + HOCl → NH2Cl + H2O
NH2Cl + HOCl → NHCl2 + H2O chlorowanie wody pitnej
NHCl2 + HOCl → NCl3 + H2O
Niezwykle wrażliwy i wybuchowy jest jodek azotu:
5NH3 + 3I2 → 3NH4I + NI3.NH3 2NI3 → N2 + 3I2
Kwas azotowodorowy HN3 i azydki.
Bardzo lotna ciecz (tw. 37 oC).
HN3 słaby kwas, silnie toksyczny i wybuchowy (ΔHotw = + 264 kJ).
Reakcja jonu hydrazyniowego z kwasem azotowym (III):
N2H5+ + HNO2 → HN3 + H3O+ + H2O
Sole jonowe np. NaN3 są termicznie dość trwałe. Liniowy jon N3-. Sole
z metalami ciężkimi np. Pb(N3)2 nietrwałe. Eksplodują przy ogrzaniu
lub uderzeniu. HN3 cząsteczka nieliniowa.
Wzory Lewisa kwasu azotowodorowego i jonu N3-.
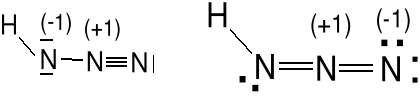
Pb2+ + 2N3- → Pb(N3)2 → Pb + 3N2 wybuch
Poduszki powietrzne NaN3 + KNO3
Tlenki azotu.
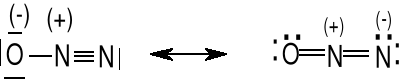
N2O tlenek diazotu,
tlenek azotu (I), podtlenek azotu, bezbarwny gaz o słodkawym zapachu. Jest gazem podtrzymującym palenie, powodującym oszołomienie. Liniowa cząsteczka NNO. Podaj możliwe wzory Lewisa dla N2O.
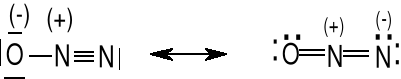
Struktury rezonansowe. Właściwości pewnych indywiduów chemicznych nie można przedstawić jednym wzorem. Struktury rezonansowe, są to struktury o tym samym ułożeniu atomów w cząsteczce, ale o różnym ułożeniu par elektronowych, czyli wiązań, wiązań wielokrotnych i wolnych par elektronowych. Struktura rzeczywista jest pośrednia między strukturami rezonansowymi. Nie jest to przejście jednej struktury w drugą.
Otrzymywanie: NH4NO3 → N2O + 2H2O (t = 170 oC).
W 500 oC rozkłada się 2N2O → 2N2 + O2
Dla teoretycznej reakcji N2(g) + ½O2(g) → N2O(g) ΔH = + 88,5 kJ
Spalanie np. Mg + N2O → MgO + N2
Podaj reakcję spalania P4 i S8 w N2O.
![]()
S8 + 2N2O → SO2 + 2N2
NO tlenek azotu, tlenek azotu (II).
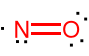
Jest to bezbarwny, trujący gaz, jest substancją fizjologiczną. Posiada niesparowany elektron.
Podaj strukturę elektronową NO posługując się metodą LCAO jak dla O2. Oblicz rząd wiązania w tym związku.
Jest termodynamicznie nietrwały.
Tendencję do dimeryzacji ma niewielką,
Otrzymywanie techniczne: bezpośrednia synteza bez
N2 + O2 → 2NO ΔH = + 180,5 kJ technicznego znaczenia
3000 stopni Celsiusza, reguła Le Chateliera Brauna Birkeland - Eyde
Jeżeli układ jest w stanie równowagi i działa na niego czynnik zewnętrzny to stan równowagi przesuwa się tak, aby
zminimalizować działanie tego czynnika zewnętrznego.
Laboratorium: 8 HNO3 + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
Także NaNO2 + NaI + H2SO4 = NO +....... Uzupełnij i zapisz jonowo.
Łuczywko gaśnie w NO.
Biały fosfor pali się w atmosferze NO.
CS2 pali się w atmosferze NO.
2NO + O2 → 2NO2 ΔHo = - 113,8 kJ
Ma właściwości zarówno redukujące wobec silnych utleniaczy:
NO + KMnO4 + H2SO4 = HNO3 + ....uzupełnij, napisz w formie jonowej.
Jak i utleniające wobec silnych reduktorów:
NO + CrCl2 + HCl = NH2OH.HCl + ......uzupełnij, napisz jonowo.
Tlenek siarki (IV) redukuje NO do N2O w środowisku kwaśnym. Napisz równanie tej reakcji.
Redukcje NO do N2O lub N2 stanowią ważne procesy prowadzone przez bakterie. Mają duże znaczenie w usuwaniu NO z atmosfery.
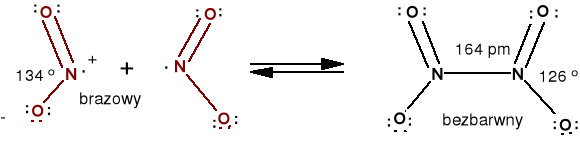
Ditlenek azotu NO2 (N2O4) t.w. = 21,2 oC, t.t. = -10 oC.
Brązowy paramagnetyczny gaz. Przy oziębianiu dimeryzuje do bezbarwnego diamagnetycznego dimeru. 2 NO2(g) N2O4(l,s)
W temp.wrzenia jest 0,1 % NO2, w 100 oC - 90 %. Jest związkiem o nieparzystej liczbie elektronów, stąd właściwości paramagnetyczne.
Wzór Lewisa i dimeryzacja NO2 (ΔHo = - 61,5 kJ.mol-1 N2O4(g) ).
Labor. Cu + HNO3(stężony) → NO2 + .........uzupełnij
Ogrzewanie: 2Pb(NO3)2(s) = 2 PbO(s) + NO2(g) + O2(g)
Jest bezwodnikiem dwóch kwasów:
2 NO2(g) + H2O(l) → HNO3(aq) + HNO2(aq)
Podgrzewany ulega rozkładowi termicznemu (600 oC - całkowicie).
2 NO2(g) 2NO(g) + O2(g)
NO2 traci łatwo swój nieparzysty elektron i przechodzi w jon nitrylowy
NO2+. Jon ten jest izoelektronowy z CO2 i ma podobny do niego kształt. Podaj wzór Lewisa jonu nitrylowego. Wilkinson - jon nitroniowy,
Cotton - jon nitrylowy
Cl2 + 2NO2 → 2NO2Cl chlorek nitrylu, związek kowalencyjny.
NO2 ma silne właściwości utleniające:
2Cu + NO2 → Cu2O + NO
CO + NO2 → CO2 + NO
SO2 + NO2 → SO3 + NO
Tritlenek diazotu, tlenek azotu (III) N2O3.
Jasno niebieski tlenek, trwały tylko w stanie stałym.
Otrzymywanie: 2NaNO2 + 2H2SO4 → 2NaHSO4 + 2HNO2
ogrzewanie
NO + NO2 NO + ˝N2O4 N2O3 + H2O
4HNO3 + 4 H2O + As4O6 → 4H3AsO4 + 2NO + 2NO2 = 2N2O3
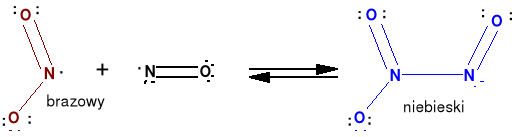
Bardzo łatwo rozpada się na NO i NO2. Długie słabe wiązanie N-N.
Kwas azotowy (III), kwas azotawy HNO2.
Kwas azotawy jest dość słabym kwasem (pKa = 3,3 → KHNO2 = 10-3,3), znanym tylko w roztworach wodnych i nietrwały z powodu:
rozpadu do N2O3 2HNO2 → N2O3 + H2O
dysproporcjonowania: 3HNO2 → HNO3 + H2O + 2NO ↑
Najlepiej rozcieńczone roztwory otrzymać:
Ba(NO2)2 + H2SO4 → BaSO4↓ + 2HNO2
t > 384 ºC
Otrzymywanie azotynów: 2NaNO3 2NaNO2 + O2
W tej temp. NaNO2 też się rozkłada → N2O, NO, NO2 i N2.
KNO3 + Pb → PbO + KNO2
Mieszanina NO + NO2 (1 : 1) zachowuje się w reakcjach z zasadami jak tlenek kwasowy N2O3.
NO + NO2 + Na2CO3 → CO2 + 2NaNO2
Wykrywanie azotynów:
utlenienie KI: skrobia
2KI + 2KNO2 + 2H2SO4 I2 + 2NO + 2K2SO4 + 2H2O
redukcja KMnO4: odbarwienie
KMnO4 + KNO2 + H2SO4 uzupełnij reakcję, zapisz jonowo.
Próba obrączkowa wobec r o z c i e ń c z o n e g o H2SO4:
2NaNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + 2H2O + Na2SO4
FeSO4 + NO → [Fe(NO)]SO4 na jakie jony dysocjuje ta sól
Dokładnie biorąc [Fe(H2O)6]2+ + NO → [Fe(NO)(H2O)5]2+ + H2O
Zapisz te reakcje jonowo.
Jako źródło jonów Fe2+ stosujemy trwałą, dość trudno utleniającą się na powietrzu sól Mohra Fe(NH4)2(SO4)2.6H2O. UWAGA, jest to sól podwójna. Na jakie jony dysocjuje ta sól.
Pięciotlenek diazotu, tlenek azotu (V), N2O5.
2HNO3 + ½P4O10 → ![]()
(HPO3)n + N2O5 (kryształy, t subl. 32,4 oC)
N2O5 + 3H2SO4 → 2NO2+ + 3HSO4- + H3O+ jon nitrylowy
W stanie gazu O2N—O—NO2, w stanie stałym [NO2]+[NO3]-.
Silny utleniacz, dość nietrwały, potrafi spontanicznie eksplodować.
Kwas azotowy (V) HNO3. Silny kwas, bezwodny jest cieczą powoli rozkładającą się z wydzielaniem NO2 i O2.
1) Utlenianie amoniaku i produkcja kwasu azotowego:
bez katalizatora otrzymujemy N2. reakcja bezużyteczna
4 NH3 + 3 O2 → 2N2 + 6 H2O
4 NH3 + 5 O2 → 4NO + 6 H2O (800 oC, katalizator Pt ew. Pt/Rh)
2NO + O2 → 2NO2
Co dalej?
6NO2 + 3H2O → 3HNO3 + 3HNO2
Zatężanie 3 HNO2 → HNO3 + 2NO + H2O
sumarycznie 6NO2 + 2H2O → 4HNO3 + 2NO
Proces prowadzi się zapewniając bardzo krótki czas zetknięcia (1ms) amoniaku 10 % objętościowo i powietrza (90 %) z katalizatorem. Jednokrotne przejście mieszaniny gazów przez katalizator i absorber daje 60 % HNO3. Azeotrop ma 68 % HNO3, tw. 122 oC.
100 % - dodatek H2SO4.
Stara metoda NaNO3 + H2SO4 → HNO3 + NaHSO4
Bezwodny kwas azotowy (V) niezbyt trwały.
4HNO3 → 4NO2 + O2 + 2H2O
Jest silnym kwasem, ale w bezwodnym H2SO4 lub HClO4 ulega protonowaniu.
HNO3 + H2SO4 HSO4- + H2NO3+ NO2+ + H2O + HSO4-
NO2+ jest to reaktywny składnik mieszaniny nitrującej.
Podobnie: N2O5 + HClO4 NO2+ClO4- + HNO3.
Dymiący kwas azotowy jest silnym utleniaczem. Reakcjom utleniania w dymiącym HNO3 towarzyszy wydzielanie się ditlenku azotu.
C + 4HNO3 → CO2 + 4NO2 + 2H2O
Napisz reakcje utleniania siarki do związków S (VI) w dymiącym HNO3.
Reakcja z metalami: roztwarza nawet niektóre metale położone na lewo od wodoru w szeregu napięciowym. Wydzielają się tlenki azotu, azot lub pochodne amonowe. Nie wydziela się wodór.
Napisz reakcję roztwarzania Ag w stężonym i rozcieńczonym HNO3.
Roztwarzanie Hg w stężonym HNO3 → Hg(NO3)2 i NO2. Podaj reakcję.
Roztwarzanie Hg w rozcieńczonym HNO3 z nadmiarem rtęci.
Hg + HNO3 → Hg2(NO3)2 + NO + H2O
- dobrać współczynniki i zapisać w formie jonowej.
Roztwarzanie Zn
10HNO3 + 4Zn → NH4NO3 + 4Zn(NO3)2 + 3H2O
Al, Fe, Cr, Ni nie roztwarzają się w stężonym HNO3 - pasywacja.
Roztwarzanie siarczków
Cu2S + 14HNO3 → 2Cu(NO3)2 + 10NO2 + H2SO4 + 6H2O
Złoto i platyna rozpuszcza się dopiero w wodzie królewskiej
(HNO3 : HCl = 1 : 3). 3HCl + HNO3 → NOCl + 2Cl + H2O
Uwaga Au + 3Cl + HCl → H[AuCl4] - tworzenie kompleksów!
Omówić
2Au + 11HCl + 3HNO3 → 2H[AuCl4] + 3NOCl + 6H2O
Azotany - działanie prochu dymnego (80 % KNO3, 10 % S, 10 % C)
2KNO3 + 3C + S → N2 + 3CO2 + K2S
Wykrywanie kwasu azotowego(V) i azotanów (V).
1. Próba obrączkowa ze stężonym H2SO4.
6FeSO4 + 2KNO3 + 4H2SO4 → 3Fe2(SO4)3 + 2NO + K2SO4 + 4H2O
Fe2+ + NO → [Fe(NO)]2+ lepiej [Fe(H2O)6]2+ + NO → [Fe(H2O)5(NO)]2+
2. Redukcja za pomocą Zn lub Al w środowisku zasadowym.
3NaNO3 + 8Al + 5NaOH + 18H2O → 8Na[Al(OH)4] + 3NH3 ↑
Tak samo reagują azotany (III) (azotyny) - podaj analogiczną reakcję.
Zużycie HNO3:
produkcja azotanu (V) amonu NH4NO3, preparat może być wybuchowy. NH4NO3 zmieszany z olejem napędowym jest materiałem wybuchowym
produkcja materiałów wybuchowych: estrów kwasu azotowego (nitroceluloza i nitrogliceryna) oraz związków nitrowych, jak np. TNT
produkcja nawozów azotowo-fosforowych przez działanie na apatyty kwasem azotowym
2 Ca5(PO4)3F + 14 HNO3 = 3 Ca(H2PO4)2 + 7 Ca(NO3)2 + 2HF
fluorowodór trzeba troskliwie usunąć z powodu toksyczności związków fluoru.produkcja KNO3, środki pirotechniczne, znakomity nawóz
azotowy, konserwacja (peklowanie) mięsa.
FOSFOR
Fosfor: Ca3(PO4)2 - fosforyt,
Ca5(PO4)3F, Ca5(PO4)3Cl i Ca5(PO4)3(OH) - apatyty
Afryka: Maroko, USA
Rozpuszczalność Ca3(PO4)2 > Ca5(PO4)3OH > Ca5(PO4)3F
Odkrycie: Henning Brandt 1669 - wydzielony z moczu
Około stu lat później 1779 wykryty w minerałach (fosforanie ołowiu)
Otrzymywanie fosforu (1400-1500ºC, piec elektryczny):
2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + 10CO + P4 +3060 kJ/mol
W przypadku obecności fluoroapatytów Ca5(PO4)3F powstaje SiF4 - toksyczny i korodujący gaz. Można go przetwarzać na Na2SiF6.
Roczna produkcja fosforu jest rzędu 1.5 mln ton
Odmiany alotropowe:
a) fosfor biały P4, tt = 44.1ºC, d=1,823g/cm3, bardzo toksyczny, dawka śmiertelna 50mg. Rozpuszcza się w benzenie i przede wszystkim w CS2. Bardzo łatwo się zapala. Temp. zapłonu jest 60 oC.
Powolne utlenianie - chemiluminescencja. Doświadczenie w parafinie.
Mimo termodynamicznej nietrwałości, ogrzewanie wszystkich innych odmian fosforu, powoduje generowanie białego fosforu, drogą kondensacji par.
b) fosfor czerwony, Pn polimer, praktycznie nietrujący, otrzymywany przez ogrzewanie P4 270-300 ºC w zatopionych ampułkach. Jest zasadniczo amorficzny. Temp. zapłonu ok. 400 oC. Zmieszany z utleniaczami, jak np. KClO3 tworzy niebezpieczne materiały wybuchowe.
10 KClO3 + ![]()
Pn → 10 KCl + 3P4O10
Ogrzewany pod normalnym ciśnieniem do około 300oC depolimeryzuje do P4.
![]()
Pn → P4 (zimny płomień Smithellsa w CO2)
c) czarny (najbardziej stabilny termodynamicznie, d=3,88 g/mol), istnieje w kilka odmianach. Ogrzewanie białego fosforu pod ciśnieniem.
Różnice N-P: Azot tworzy stabilne wiązania wielokrotne i nie ma możliwości rozszerzania oktetu. Fosfor ma możliwości rozszerzenia
oktetu, wiązania (p-p) typu π są nietrwałe.
Fosforowodór, fosforki
PH3; przedstawiciel rodziny PnHn+2 (n=1-9), silnie trujący gaz, bardzo reaktywny, nie posiada wyraźnych właściwości kwasowo-zasadowych:
Wiązanie P—H (322 kJ.mol-1) jest słabsze niż N—H w amoniaku (391kJ.mol-1), ale silniejsze niż w AsH3. Kąt H-P-H w PH3 wynosi 93,5 o.
Otrzymywanie PH3:
P4 + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
Dodatkowo powstaje samozapalny P2H4 (napisz odpowiednią reakcję).
Ca3P2 + 3H2O = 2PH3↑ + 3Ca(OH)2
Dość uniwersalną metodą otrzymywania wodorków niemetali jest reakcja PXn z LiAlH4, np.:
4PCl3 + 3LiAlH4 → 4PH3↑ + 3AlCl3 + 3LiCl
PH3 ma silne właściwości redukujące, z soli Ag+, Cu2+ wydziela metale.
Fosforki 3Na + ¼P4 → Na3P (jon P3-, łatwo hydrolizuje, napisz reakcję).
Kwas podfosforawy i jego sole. (Kwas fosfinowy).
NaH2PO2: niklowanie bezprądowe.
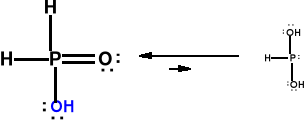
Jest silnym reduktorem i średniej mocy jednozasadowym kwasem (pKa=1,244).
Redukcja: 4Ag+ + H3PO2 + 6H2O → 4Ag + H3PO4 + 4H3O+
Napisz reakcję redukcji KI3 za pomocą H3PO2.
Napisz reakcję redukcji KMnO4 za pomocą H3PO2. Omówić
Tlenek fosforu (III) P4O6. Powstaje przy niecałkowitym spalaniu P4 w powietrzu.
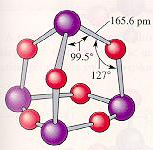
Kwas fosforowy (III), kwas fosforawy, kwas fosfonowy, H3PO3.
Otrzymywanie PCl3 + H2O lub P4O6 + H2O
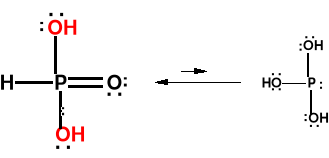
Jest to kwas dwuzasadowy o średniej mocy (pKa=1,8), wykazuje silne właściwości redukujące. reakcja z H2O2
Redukcja KMnO4 w środowisku kwaśnym, uzupełnij:
H3PO3+ KMnO4 + H2SO4 → omówić
Kwas fosforowy (III) ulega reakcji dysproporcjonowania (definicja)
H3PO3 → PH3 + H3PO4 dobierz współczynniki reakcji.
Na2HPO3 + 2AgNO3 → 2NaNO3 + Ag2HPO3↓
Czernieje Ag2HPO3 + H2O → 2Ag + ??? omówić
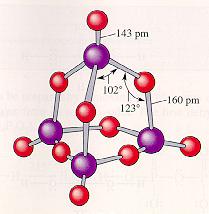
Tlenek fosforu (V) P4O10. Powstaje przy całkowitym spalaniu fosforu w powietrzu.
P4 + 5O2 → P4O10
Jest bardzo energicznym środkiem odwadniającym
Z HNO3 daje N2O5,
z H2SO4 daje SO3.
Kwas fosforowy (V), kwas fosforowy, kwas ortofosforowy (V), H3PO4
Temp. topnienia 42,4 ºC. Średniej mocy kwas. Dysocjacja jest trójstopniowa
H3PO4(aq) H2PO4-(aq) + H+(aq) (H3O+)
H2PO4- (aq) HPO42-(aq) + H+(aq)
HPO42-(aq) PO43-(aq) + H+(aq)
Utlenienie czerwonego fosforu i wykrycie kwasu fosforowego (V).
P + 5HNO3 → H3PO4 + 5NO2 + H2O
21HNO3 + H3PO4 + 12(NH4)2MoO4 → 21NH4NO3 + 12H2O
+ (NH4)3PO4.12MoO3
Inne metody wykrywania: 3Ag+ + PO43- → Ag3PO4 żółty
3Ca2+ + 2PO43- → Ca3(PO4)2 biały osad
Mieszanina magnezowa
Na2HPO4 + MgCl2 + NH3.H2O → NaCl + MgNH4PO4.6H2O
Poprzez odwodnienie kwasu ortofosforowego (V) otrzymuje się polikwasy, zawierające mostki -P-O-P- np. kwas pirofosforowy
Kwas pirofosforowy.
2H3PO4 → H2O + H4P2O7
2Na2HPO4 → H2O + Na4P2O7
Wykrywanie: 4Ag+ + P2O74- → Ag4P2O7 biały osad
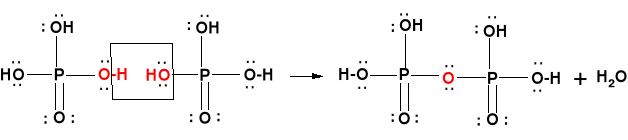
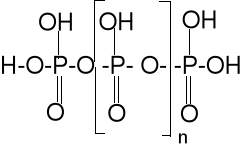
polikwasy: (HO)2PO-O[-PO(OH)]n-PO(OH)2, wyodrębniono do n <17
sole - składniki proszków do prania, Na5P3O10 używany coraz rzadziej (glony)
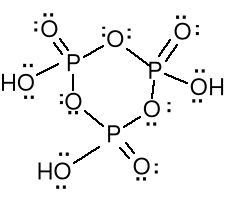
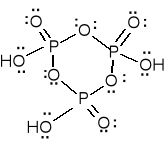
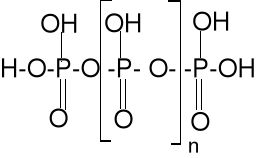
kwas metafosforowy (HPO3)n -
cykliczny trimer lub polimer
liniowy dobrze
rozpuszczalny w wodzie.
Techniczne otrzymywanie kwasu fosforowego
Produkcja w przemyśle w skali wielu mln ton/rok.
Czysty kwas, do „coca-coli” produkuje się metodą "termiczną" przez spalanie fosforu i reakcję otrzymanego tlenku z wodą:
P4 + 5O2 = P4O10; P4O10 + 6 H2O = 4H3PO4
Metoda "mokra" albo "gipsowa" daje mniej czysty kwas i polega na reakcji fosforytów (apatytów) z kwasem siarkowym. Jest ona około 3 razy tańsza od poprzedniej metody.
Ca5(PO4)3F + 5H2SO4 + 10H2O = 3H3PO4 + 5CaSO4·2H2O + HF
Fluor jest usuwany jako Na2SiF6.
Mimo obecności wielu zanieczyszczeń taki kwas nadaje się do produkcji nawozów lub w przemyśle metalurgicznym.
Zastosowania tlenowych związków fosforu - nawozy fosforowe
Przetwarzanie nierozpuszczalnego w wodzie Ca3(PO4)2 w rozpuszczalne diwodorofosforany datuje się od 1830 (J. Liebig, stosował kwasowy ekstrakt z kości jako nawóz). Diwodorofosforany - anion H2PO4- sól wapniowa rozpuszczalna we wodzie, przyswajalna dla roślin.
Produkcja superfosfatu:
2Ca5(PO4)3F + 7H2SO4 + H2O = 3Ca(H2PO4)2·H2O + 7CaSO4 + 2HF
Nawóz pozbawiony gipsu zwany jest superfosfatem podwójnym.
Ca5(PO4)3F + 7H3PO4 + H2O = 5Ca(H2PO4)2·H2O + HF
W drugim procesie gips wydziela się na etapie produkcji kwasu fosforowego i jest produktem odpadowym. Powoduje to powstawanie hałd
fosfogipsu w pobliżu zakładów produkujących nawozy fosforowe.
(NH4)2HPO4 i (NH4)H2PO4 do fermentacji (i jako impregnacja przeciwpożarowa do drewna)
wytwarzanie antykorozyjnych powłok fosforanowych na stali
składnik buforów fosforanowych.
Halogenki fosforu.
½ P4 + 3X2 → 2PX3 (X = Cl,Br i I) nadmiar fosforu
PF3 trujący gaz, PCl3 - łatwo wrząca, łatwo hydrolizująca ciecz.
PCl3 + 3ROH → P(OR)3 + 3HCl
PCl3 + 3RMgCl → PR3 + 3MgCl2
Z wodą kwas fosforowy (III) H3PO3 jeszcze raz wzór Lewisa
Przy nadmiarze halogenu PX5.
PF5 bardzo silny kwas Lewisa, trujący gaz.
Silny kwas Lewisa - podaj przykład PF5 + NO2F → NO2+ + [PF6]-
PCl5 w postaci gazowej i ciekłej ma strukturę BPT. W postaci stałej w temp. pokojowej jest to [PCl4+][PCl6-]
Halogenki fosforylu X3PO.
Utlenienie przez tlen 2PCl3 + O2 → 2Cl3PO
Podobne do halogenków fosforu. Są to typowe halogenki niemetalu, o budowie reguły kowalencyjnej. Łatwo hydrolizują.
Napisz reakcję hydrolizy PCl5, PBr3 i Cl3PO.
ARSEN
As2S3 - aurypigment, As4S4 - realgar, FeAsS - arsenopiryt. Rudy siarczkowe metali ciężkich (Cu, Sn, Ni) zawierają As.
Otrzymywanie: FeAsS → FeS + As - przy ogrzewaniu sublimuje
Redukcja arszeniku: As4O6 + 6C → 4As + 6CO
As4O6 + 6 Mg → 4As + 6MgO
Odmiany alotropowe:
Arsen metaliczny (szary). Budowa warstwowa. Kruchy, niskie przewodnictwo elektryczne.
Arsen żółty As4. Kondensacja par arsenu.
Małe zastosowanie: środki ochrony roślin, konserwacja futer, śrut.
Arsenowodór.
AsH3; bardzo silnie trujący gaz, nie mający ani wyraźnych zasadowych, ani kwasowych właściwości. ΔHotw = + 127,2 kJ.mol-1. Kąt H-As-H = 92o.
Otrzymywanie np. Ca3As2 + 6H2O → 3Ca(OH)2 + 2AsH3
H3AsO3 + 6H → 3H2O + AsH3
Ogrzewanie, próba Marsha: 2AsH3 → 2As + 3H2
Arsen utlenia się łatwo do H3AsO4 - lustro + NaClO
2As + 5NaClO + 3H2O → 2H3AsO4 + 5NaCl
Tlenek arsenu (III). Miernie rozpuszczalny we wodzie. Odczyn kwaśny.
As4O6 + 6H2O → 4H3AsO3 As4O6 + 12NaOH → 4Na3AsO3 + 6H2O
Słaby kwas trójzasadowy. Nie można go wydzielić w stanie wolnym.
NaOH + H3AsO3 → NaH2AsO3 + H2O itd. aż do Na3AsO3.
As4O6 + 12HCl 6H2O + 4AsCl3 Roztwarzanie As4O6
AsCl3 + HCl H+(aq) + AsCl4- w kwasie solnym.
Jest umiarkowanym reduktorem.
I2 + H3AsO3 + 5NaHCO3 → Na3AsO4 + 5CO2 + 2NaI + 4H2O
NaHCO3 (ale nie NaOH) usuwa H+(aq) i reakcja idzie w prawo.
Podaj reakcję KMnO4 z H3AsO3 w środowisku kwaśnym.
2Na3AsO3 + 3H2S + 6HCl → 6H2O + 6NaCl + As2S3 rozp. w K2S
Na3AsO3 + 3AgNO3 → Ag3AsO3 + 3NaNO3 żółty osad
Tlenek arsenu (V) (As2O5)n - polimer
Odwodnienie: 2H3AsO4 → 1/n(As2O5)n + 3H2O P4O10 lub temp.
(As2O5)n jest bezwodnikiem H3AsO4.
Kwas arsenowy (V) H3AsO4: kwas trójzasadowy, średniej mocy. Bardzo duże podobieństwo do kwasu fosforowego.
As4O6 + HNO3 + H2O → H3AsO4 + .......... uzupełnij.
Napisz reakcję As ze stężonym HNO3. Produktem jest także NO2.
Wykrywanie, reakcja z (NH4)2MoO4
21HNO3 + H3AsO4 + 12(NH4)2MoO4 → (NH4)3AsO4.12MoO3 + 21NH4NO3 + 12H2O jasno żółty
Inne metody wykrywania: 3Ag+ + AsO43- → Ag3AsO4 czekoladowy
Na2HAsO4 + MgCl2 + NH3.H2O → NaCl + MgNH4AsO4.6H2O
2H3AsO4 + 5H2S → As2S5 + 8H2O (dość silnie stężony HCl)
As2S5 i As2S3 roztwarzają się w KOH i K2S. Napisz odpowiednie reakcje.
Omówić
Kwas arsenowy ma właściwości utleniające.
H3AsO4 + 2KI → K2HAsO3 + H2O + I2 (reakcja w śr. kwaśnym)
Halogenki arsenu: AsF3 i AsCl3 - ciecze.
Otrzymywanie 2As + 3Cl2 → 2AsCl3 silnie trująca ciecz.
As4O6(s) + 12HCl(g) → 4AsCl3(g) + 6H2O(g)
4AsCl3(l) + 12H2O(l) As4O6(s) + 12HCl(aq)
Kwas solny cofa hydrolizę, AsCl3 w nadmiarze HCl się roztwarza
dając H[AsCl4].
4AsCl3(l) + HCl(aq) → H[AsCl4] (aq)
AsF5 - gaz, bardzo silny kwas Lewisa.
NOF(g) + AsF5(g) → NO+ + [AsF6]- (sole nitrozylowe)
ANTYMON i BIZMUT
Antymonit Sb2S3 walentynit Sb2O3, redukcja za pomocą Fe lub C
Sb2S3 + 3Fe → 2Sb + 3FeS Sb2O3 + 3C → 2Sb + 3CO
Bi2S3 - bizmutyn, Bi2O3 - ochra bizmutowa. Otrzymywanie jak Sb.
Antymon: do wyrobu stopów łożyskowych.
Bizmut: do produkcji łatwo topliwych stopów, Wood'a, Rose'go.
(Wood - 50 %Bi, 13,3 %Sn, 26,7 %Pb i 10 %Cd, tt 70°C)
Arsen, antymon i bizmut są izomorficzne i najbardziej trwała jest dla tych pierwiastków odmiana metaliczna. Antymon jest kruchy, bizmut nieco mniej. Przewodnictwo właściwe antymonu jest niewielkie. Istnieje jego odmiana żółta (Sb4?), a także antymon tzw. wybuchowy.
Bizmut: tylko odmiana metaliczna.
Antymon. Reaguje z chlorem już na zimno (SbCl3 napisz reakcję).
Silnie ogrzany spala się na powietrzu dając biały tlenek (III).
Rozcieńczony HNO3 + Sb → Sb2O3(aq) uzupełnij reakcję.
Stężony HNO3 + Sb → Sb2O5(aq) uzupełnij reakcję.
SbH3 - endotermiczny związek, meta trwały w normalnych warunkach. Otrzymywanie, analogicznie jak AsH3. Nie wykazuje właściwości zasadowych.
SbCl3 + 6H → 3HCl + SbH3
lustro antymonowe nie rozpuszcza się w NaClO.
Sb2O3 - biały proszek nierozpuszczalny w wodzie. Daje się łatwo redukować do Sb. Wykazuje właściwości amfoteryczne.
Sb2O3 + 2KOH + 3H2O → 2K[Sb(OH)4]
Roztwarza się także w stężonych kwasach:
Sb2O3 + 6HCl → 2SbCl3 + 3H2O
Chlorek antymonu (III) SbCl3, higroskopijne ciało stałe.
2SbCl3 + 3H2S → 6HCl + Sb2S3 ↓ rozpuszczalny w K2S i KOH.
SbCl3 + H2O 2HCl + SbOCl ↓ biały osad
SbCl3 + KCl → K[SbCl4]
2SbCl3 + 3Sn → 2Sb + 3SnCl2 czarny osad na blaszce cynowej.
Chemia związków Sb(III) nie jest chemią kationów Sb3+(aq).
Sb(III) tworzy chętnie jony kompleksowe z kwasami organicznymi.
[Sb(C2O4)3]3-.
Chlorek antymonu (V) SbCl5. Bezbarwna, dymiąca na powietrzu ciecz.
SbCl3 + Cl2 → SbCl5 (środek chlorujący, silny kwas Lewisa)
SbCl5 + KCl → K[SbCl6]
PCl5 + SbCl5 → [PCl4+][SbCl6-]
Tlenek antymonu (V) Sb2O5.
2SbCl5 + (5 +x)H2O → Sb2O5.xH2O + 10 HCl trudne odwadnianie.
Słabo rozpuszcza się we wodzie, odczyn kwaśny.
Sb2O5 + 7H2O → 2H[Sb(OH)6] moc kwasu octowego.
K[Sb(OH)6] odczynnik na jony Na+
Chemia bizmutu jest już chemią kationów. [Bi(OH2)6]3+ oktaedr
Bizmut nie roztwarza się w kwasach nieutleniających
Bi roztwarza się w stężonym H2SO4 oraz w HNO3. Powstają odpowiednie sole Bi(III). Napisz odpowiednie reakcje.
Bi(OH)3 lub poprawniej Bi2O3.xH2O ma charakter zasadowy. Roztwarza się w kwasach, można wykrystalizować sole z kationem [Bi(OH2)6]3+.
Reakcje charakterystyczne: Strącanie brunatnego Bi2S3
Bi(NO3)3 + 3KI → 3KNO3 + BiI3↓ czarny BiI3 + KI → K[BiI4] pomarańcz.
2Bi(OH)3 + 3Na2[Sn(OH)4] → 3Na2[Sn(OH)6] + 2Bi ↓ czarny
BiCl3 + H2O BiOCl ↓ + 2HCl hydroliza, biały osad
Związki Bi(V)
BiF3 + F2 → BiF5 BiF5 - silny środek fluorujący.
Na2O + Bi2O3 + O2 → 2NaBiO3 stapianie.
Bi(OH)3 + Cl2 + 3NaOH → NaBiO3 + 2NaCl + 3H2O
W roztworze wodnym NaBiO3 najprawdopodobniej występuje jako Na[Bi(OH)6].
W środowisku kwaśnym bardzo silny środek utleniający.
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5NaNO3 + 5Bi(NO3)3 + 7H2O
32
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
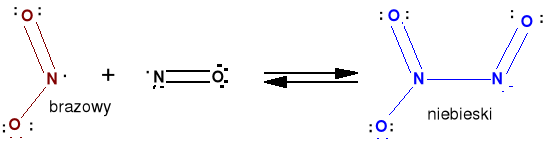
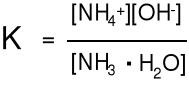
![]()
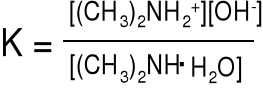
![]()
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
9-termochemiaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
7-makroukłady TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
19-litowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
6-VSEPR TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
17-borowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Konspekt2, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Konspekt3, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Konspekt1, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
więcej podobnych podstron