Konspekt
Pierwsza zasada termodynamiki mówi: suma ilości ciepła pobranej przez układ i pracy wykonanej nad układem jest równa przyrostowi jego energii wewnętrznej.
![]()
Gdzie:
U - przyrost energii wewnętrznej układu.
q - ciepło oddane lub pobrane do układu.
w - praca wykonana nad układem.
Entalpię (H) wyrażamy wzorem:
![]()
Gdzie:
U - energia wewnętrzna układu.
p - ciśnienie układu.
v - objętość układu.
W procesach izobarycznych ciepło równa się energii wewnętrznej U = q, a w przemianie izochorycznej entalpii układu H = q. W przemianach izotermicznych, jak sama nazwa wskazuje U i H są równe zero(powyższe zależności przyjmuje się tylko dla gazów doskonałych).
Entalpia i energia wewnętrzna są funkcjami stanu. O czym mówi prawo Hessa: W przemianach izochorycznych i izobarycznych, w których nie występuje praca nie objętościowa, efekty cieplne odpowiednio U i H, nie zależą od drogi przemian a tylko od stanu początkowego i końcowego.
Przez prace objętościowa rozumiemy pracę wykonaną przez układ podczas przemiany, która spowodowała zmianę objętości. 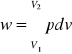
Pracą nie objętościową nazywamy np.: prace elektryczną ogniw galwanicznych, lub inne prace wykonane nad układem.
Ciepło molowe to ilość ciepła potrzebna do ogrzania jednego mola substancji o jedne stopień. Rozróżniamy ciepło molowe w stałej objętości Cv i w stałym ciśnieniu Cp. Termodynamika wykazuje:
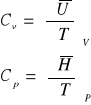
Dla gazów doskonałych jednoatomowych wynoszą one Cv = 3/2R i Cp = 5/2R.
Ciepło rozpuszczania (Qn) jest to ilość ciepła wydzielana lub pochłonięta podczas rozpuszczenia l mola substancji w n molach rozpuszczalnika. Ta ogólna definicja zawiera w sobie pojęcia pochodne.
Pełne ciepło rozpuszczania (Qnas) występuje wówczas, gdy do rozpuszczenia l mola substancji użyjemy takiej ilości rozpuszczalnika, że powstanie roztwór nasycony.
Pierwsze ciepło rozpuszczania (Qaq) towarzyszy rozpuszczeniu l mola substancji w nieskończonej ilości rozpuszczalnika (powstaje roztwór nieskończenie rozcieńczony).
Cząstkowe ciepło rozpuszczania towarzyszy rozpuszczeniu l mola substancji w tak dużej ilości roztworu o określonym stężeniu, że stężenie to nie ulegnie zmianie. Jeżeli ten roztwór był praktycznie nasycony to mówimy wówczas o ostatnim cieple rozpuszczania. Z trzech ostatnich definicji wynika, że mają one charakter pojęć granicznych.
Wyszukiwarka
Podobne podstrony:
Konspekt2, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Konspekt1, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
zagadnienia lab fiz, WIiTCh PK, Technologia Chemiczna, semestr 3, Chemia Fizyczna, laboratorium
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
9-termochemiaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
7-makroukłady TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
aminy i amidy, Technologia chemiczna pwr, Chemia organiczna
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
15-azotowceTECHa, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
19-litowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
więcej podobnych podstron