
1
RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
WODNYCH I NIEWODNYCH
Opracowanie: dr Jadwiga Zawada
CZĘŚĆ TEORETYCZNA
1. Dysocjacja elektrolityczna
Substancje, które podczas rozpuszczania w wodzie (lub innych rozpuszczalnikach) rozpadają się na jony
nazywamy elektrolitami. Substancje te mają zdolność przewodzenia prądu elektrycznego.
Proces rozpadu substancji na jony (pod wpływem rozpuszczalnika) nosi nazwę dysocjacji elektrolitycznej.
Elektrolitami są substancje o budowie jonowej (np. sole), a także liczne substancje o wiązaniach
kowalencyjnych, które tworzą jony dopiero wskutek oddziaływania ich cząstek z rozpuszczalnikiem (np. HCl,
H
2
S, HCN). Proces dysocjacji będzie zależał od rodzaju wiązań w cząsteczce rozpuszczonej jak i od rodzaju
rozpuszczalnika. Woda, ze wględu na dipolowy charakter cząsteczki jest dobrym rozpuszczalnikiem dla
substancji posiadających wiązanie jonowe lub atomowe spolaryzowane. Wodne roztwory kwasów, zasad i soli
nieorganicznych są elektrolitami.
1.1. Stopień dysocjacji
Ogólnie dysocjacja substancji AB lub AnBm w roztworze zachodzi według schematu:
AB
⇔
A
+
+ B
-
lub A
n
B
m
⇔
A
m+
+ mB
n-
( 1 )
na przykład:
HNO
3
⇔
H
+
+ NO
3
-
Ca(OH)
2
⇔
Ca
2+
+ 2OH
-
Al
2
(SO
4
)
3
⇔
2Al
3+
+ 3SO
4
2-
Stosunek liczby cząsteczek rozpadających się na jony do ogólnej liczby cząsteczek rozpuszczonych nosi
nazwę stopnia dysocjacji elektrolitycznej
α
αα
α
.
o
zd
n
n
=
α
( 2 )
α
- stopień dysocjacji
n
zd
- liczba cząsteczek rozpadających się na jony
n
o
- ogólna liczba cząsteczek rozpuszczonych.
Stopień dysocjacji może przyjmować wartości 0 <
α
< 1. W zależności od stopnia dysocjacji elektrolity
dzielimy na mocne, średniej mocy i słabe. Im więcej cząsteczek ulega rozpadowi na jony, tym mocniejszy jest
elektrolit. Stopień dysocjacji elektrolitów wzrasta wraz z rozcieńczeniem roztworu.
Mocne elektrolity to:
- sole
- część kwasów nieorganicznych (np. HCl, HNO
3
, H
2
SO
4
, HBr, HI)
- wodorotlenki litowców i berylowców z wyjątkiem Be(OH)
2
i Mg(OH)
2
- część kwasów nieorganicznych (H
2
S, HCN, H
2
CO
3
)
- część wodorotlenków nieorganicznych (NH
4
OH, większość wodorotlenków metali
dwu- i trójwartościowych)
- kwasy i zasady organiczne
Średniej mocy elektrolity to np. H
3
PO4, H
2
SO
3
, H
3
AsO
4
.
1.2. Stała dysocjacji
W
słabych elektrolitach cząsteczki niezdysocjowane znajdują się w stanie równowagi z produktami
dysocjacji (jonami). Reakcję dysocjacji dla słabego elektrolitu można zapisać jako reakcję odwracalną stosując
równania ( 1 ).
Na przykład:
CH
3
COOH
⇔
CH
3
COO
-
+ H
+

2
Mg(OH)
2
⇔
Mg
2+
+ 2OH
-
W stanie równowagi, tzn.gdy szybkości reakcji w obu kierunkach są jednakowe, możemy określić stałą
równowagi reakcji zgodnie z równaniami:
]
B
[A
]
B
[
]
[A
=
K
AB]
[
]
[B
]
[A
=
K
m
n
m
+n
n
+m
m
B
n
A
-
+
AB
( 3 )
Na przykład:
]
Mg(OH)
[
]
[OH
]
[Mg
=
K
COOH]
CH
[
]
[H
]
COO
[CH
=
K
2
2
-
2
2
Mg(OH)
3
+
-
3
COOH
3
CH
+
Nawiasy kwadratowe oznaczają stężenie wyrażone w mol/dm
3
.
Stałą K równowagi reakcji dysocjacji nazywamy stałą dysocjacji.
Stała dysocjacji jest to stosunek iloczynu stężeń jonów do stężenia cząsteczek nie
zdysocjowanych. Stałą dysocjacji wyznacza się tylko dla słabych lub średniej mocy elektrolitów. Dla
elektrolitów mocnych stężenie [AB] lub [AnBm] jest bliskie zeru. Stałych dysocjacji dla mocnych elektrolitów na
ogół nie definiuje się, gdyż wartości ich są bardzo duże i zwykle wyraźnie zmieniają się ze stężeniem.
Kwasy wieloprotonowe, zawierające w swojej cząsteczce kilka atomów wodoru, dysocjują stopniowo.
Dla każdego etapu dysocjacji możemy wyznaczyć stałą równowagi reakcji. Wartość stałej dysocjacji pierwszego
stadium jest zawsze większa od kolejnych stadiów stałych dysocjacji, np:
H
3
PO
4
⇔
H
+
+ H
2
PO
4
-
K
1
= 7,51 . 10
-3
H
2
PO
4
-
⇔
H
+
+ HPO
4
2-
K
2
= 6,23 . 10
-8
HPO
4
2-
⇔
H
+
+ PO
4
3-
K
3
= 2,2 . 10
-13
Również wodorotlenki posiadające kilka grup wodorotlenkowych dysocjują stopniowo. Dla każdego
etapu dysocjacji ustala się odpowiednia równowaga reakcji, którą można określić za pomocą stałej dysocjacji.
Stała dysocjacji, w odróżnieniu od stopnia dysocjacji, nie zależy od stężenia elektrolitu, lecz wyłącznie
od temperatury - ze wzrostem temperatury wartość stałej dysocjacji wzrasta.
1.3. Prawo rozcieńczeń Ostwalda
Zależność pomiędzy stopniem dysocjacji a stałą dysocjacji dla słabych elektrolitów określa prawo
rozcieńczeń Ostwalda wyrażone wzorem:
1
C
=
K
m
2
α
−
α
( 4 )
α
- stopień dysocjacji
K - stała dysocjacji
C
m
- stężenie molowe elektrolitu
Dla bardzo słabych elektrolitów stopień dysocjacji
α
jest tak mały, że 1-
α
≈
1. Wówczas prawo
rozcieńczeń Ostwalda można przedstawić wzorem przybliżonym:
K
=
α
2
C ( 5 )
lub po przekształceniu:
C
K
=
α
( 6 )
Ze wzoru tego wynika, że stopień dysocjacji słabego elektrolitu jest odwrotnie proporcjonalny do
pierwiastka kwadratowego z jego stężenia. W miarę rozcieńczania dowolnego słabego elektrolitu wzrasta
jego stopień dysocjacji.

3
2. Iloczyn jonowy wody, pH roztworów wodnych
Czysta woda jest bardzo słabym elektrolitem, którego część cząsteczek ulega rozpadowi na jony wg równania:
2H
2
O
⇔
H
3
O+ + OH-
W uproszczony sposób dysocjację elektrolityczną wody można zapisać:
H
2
O
⇔
H
+
+ OH
-
W stanie równowagi, zgodnie z równaniem [VI.4.] stała dysocjacji wody określona jest wzorem:
O]
H
[
]
[OH
]
[H
=
K
2
-
+
O
2
H
Stężenie cząsteczek nie zdysocjowanych jest stałe i wynosi [H2O] = 55,55 mol/dm3
Stała dysocjacji wody w temperaturze 25oC wynosi 1,8 10-16
A więc:
K · [H
2
O] = [H
+
] [OH
-
] = 1,8 10
-16
· 55,55 = 10
-14
Iloczyn K·[H
2
O] oznaczamy jako L i nazywamy iloczynem jonowym wody.
L = [H
+
] · [OH
-
] = 10
-14
( 7 )
W czystej wodzie stężenia jonów wodorowych i wodorotlenkowych są sobie równe: [H
+
] = [OH
-
] = 10
-7
Jeśli w roztworze :
[H+] = 10
-7
to roztwór jest obojętny
[H+]
>
10
-7
to roztwór jest kwaśny
[H+]
<
10
-7
to roztwór jest zasadowy.
W celu wyrażenia kwasowości lub zasadowości roztworu (czyli tzw. odczynu roztworu) używa się
pojęcia pH (tzw. współczynnik Sorensena), który został zdefiniowany jako ujemny logarytm ze stężenia
molowego jonów wodorowych.
pH = -log [H
+
] ( 8 )
Zatem, gdy pH = 7 roztwór jest obojętny
pH < 7 roztwór jest kwaśny
pH > 7 roztwór jest zasadowy
Znając kwasowość lub zasadowość roztworu określoną stężeniem jonów wodorowych bądź
wodorotlenkowych łatwo obliczyć pH roztworu.
Niewielkie zmiany pH wpływają na przebieg wielu procesów chemicznych, zarówno biologicznych jak i
przemysłowych.
Pomiary pH można wykonać przy pomocy wskaźników lub papierków wskaźnikowych, a dokładnie przy
pomocy pH - metru. Wskaźniki są to słabo zdysocjowane kwasy lub zasady organiczne, które zmieniają swoją
barwę w zależności od pH roztworu. Zmiana zabarwienia jest wynikiem zmiany stopnia dysocjacji własnej
wskaźnika. Każdy wskaźnik ma charakterystyczny dla siebie zakres pH, w którym następuje stopniowa zmiana
barwy. Zakres ten często nazywamy zakresem czułości danego wskaźnika.
2.1. Przykłady obliczeń pH
Przykład 1.
Obliczyć pH 0,001 m roztworu HCl, przyjmując, że jest on całkowicie zdysocjowany na jony (
α
= 1).
Rozwiązanie:
Rzeczywiste stężenie jakiegokolwiek z jonów elektrolitu wynosi:
C = C ·
α
·n ( 9 )
C - stężenia molowe elektrolitu
α
- stopień dysocjacji
n - liczba jonów danego rodzaju, która powstaje z 1 cząsteczki elektrolitu
HCl
⇔
H
+
+ Cl
-
zatem [H
+
] = 0,001· 1· 1 = 10
-3
mol/dm3
czyli pH = -log 10
-3
= 3
Odpowiedź:
pH roztworu wynosi 3.

4
Przykład 2.
Obliczyć pH 0,001 m roztworu Mg(OH)
2
, przyjmując, że jest on zdysocjowany w 50%
(
α
= 0,5).
Rozwiązanie:
Mg(OH)
2
⇔
Mg
+2
+ 2OH
-
Stężenie jonów wodorotlenowych [OH
-
] = 0,001· 0,5· 2 = 10
-3
Korzystając ze wzoru (7) na iloczyn jonowy wody obliczamy stężenie jonów wodorowych [H
+
]
11
-
3
-
-14
-
-14
+
10
=
10
10
=
]
[OH
10
=
]
[H
stąd pH = -log 10
-11
= 11
Odpowiedź:
pH roztworu roztworu wodorotlenku magnezu wynosi 11.
3. Reakcje jonowe
Elektrolity, jak już wcześniej wspomniano, w roztworach wodnych występują w postaci jonów. Jony w
roztworze wodnym bardzo łatwo ze sobą reagują, przy czym szybkość reakcji, w porównaniu z szybkością
reakcji między nieelektrolitami jest duża. Reakcje jonowe przebiegają niemal natychmiast. Jeżeli kwasy, zasady i
sole reagują ze sobą, to reakcja zachodzi pomiędzy jonami a nie cząsteczkami.
Reakcje między jonami zachodzą wówczas, gdy w wyniku reakcji powstanie:
- substancja trudno rozpuszczalna
- substancja słabo zdysocjowana
Rozpatrzmy pierwszy przypadek, tj. powstawania trudno rozpuszczalnej substancji, na przykład AgCl.
Charakterystyczne jest, że bez względu na rodzaj soli, kation daje z właściwym anionem ten sam produkt
reakcji:
AgNO
3
+ NaCl = AgCl
↓
+ NaNO
3
Ag
2
SO
4
+ 2KCl = 2AgCl
↓
+ K
2
SO
4
lub jonowo:
Ag
+
+ NO
3
-
+ Na
+
+ Cl
-
= AgCl
↓
+ Na
+
+ NO
3
-
2Ag
+
+ SO
4
2-
+ 2K
+
+ 2Cl
-
= 2AgCl
↓
+ 2K
+
+ SO
4
2-
Skreślając po obu stronach równania jony, które nie biorą udziału w reakcji, powyższe reakcje można zapisać w
formie skondensowanej:
Ag
+
+ Cl
-
= AgCl
↓
Przykładem drugiego typu reakcji jest powstawanie słabo zdysocjowanej substancji, na przykład:
CH
3
COONa + HCl = CH
3
COOH + NaCl
lub jonowo:
CH
3
COO
-
+ Na
+
+ H
+
+ Cl
-
= CH
3
COOH + Na
+
+ Cl
-
Jak widać z powyższych reakcji, jony Na
+
i Cl- nie biorą udziału w reakcji, a więc równanie tej reakcji można
zapisać w skróconej formie:
CH
3
COO
-
+ H
+
= CH
3
COOH
Pisząc reakcje jonowe, wzory mocnych elektrolitów przedstawiamy w formie jonowej, natomiast wzory
substancji trudno rozpuszczalnych i słabo zdysocjowanych w postaci cząsteczkowej. Jony, które nie wchodzą w
reakcję pomijamy.
4. Hydroliza soli
Hydroliza jest to reakcja jonów soli z wodą.
Po dodaniu niewielkiej ilości soli do wody otrzymamy roztwór, który zależnie od rodzaju rozpuszczonej soli
może mieć odczyn obojętny, kwaśny lub zasadowy. Przyczyną tego zjawiska są reakcje jonów soli z wodą, czyli
hydroliza.
Hydroliza jest reakcją odwrotną do reakcji zobojętniania:
zobojętnienie
kwas + zasada
⇐⇒
sól + woda
hydroliza

5
Hydrolizie
ulegają tylko sole, których jony mają zdolność przyjmowania lub oddawania protonów w
środowisku wodnym. Do soli tego typu należą z reguły:
- sole słabych kwasów i mocnych zasad,
- sole mocnych kwasów i słabych zasad
- sole słabych kwasów i słabych zasad.
Sole mocnych kwasów i mocnych zasad nie hydrolizują, ich jony w środowisku wodnym nie przyjmują i nie
oddają protonów.
.1. Hydroliza soli słabych kwasów i mocnych zasad
Tego rodzaju sole hydrolizują w roztworach wodnych powodując odczyn zasadowy. Na przykład cyjanek
potasu KCN jest solą pochodzącą od bardzo słabego kwasu cyjanowodorowego HCN i mocnej zasady
potasowej KOH. Po rozpuszczeniu tej soli w wodzie zachodzi reakcja :
K
+
+ CN
-
+ H
2
O
⇔
HCN + K
+
+ OH
-
lub: CN
-
+ H
2
O
⇔
HCN + OH
-
W
wyniku
łączenia się jonów soli z wodą tworzy się słaby kwas HCN (w małym stopniu zdysocjowany) i
mocna zasada KOH (całkowicie zdysocjowana na jony). Znajdujące się w roztworze jony OH
-
nadają roztworowi
odczyn zasadowy. (pH > 7).
4.2. Hydroliza soli słabych zasad i mocnych kwasów
W wyniku hydrolizy tego typu soli odczyn roztworu staje się kwaśny (pH < 7). Jako przykład podano się
hydrolizę chlorku amonu NH
4
Cl.
NH
4
+
+ Cl
-
+ H
2
O
⇔
NH
4
OH + H
+
+ Cl
-
lub: NH
4
+
+ H
2
O
⇔
NH
4
OH + H
+
Tworzący się w wyniku hydrolizy wodorotlenek amonu jest słabą zasadą, a więc słabo zdysocjowaną na
jony. Natomiast HCl jest silnie zdysocjowanym na jony kwasem i znajdujące się w roztworze jony H
+
nadają mu
odczyn kwaśny.
4.3. Hydroliza soli słabych kwasów i słabych zasad
Sole słabych kwasów i słabych zasad w roztworze wodnym ulegają hydrolizie, a odczyn wodnych
roztworów tych soli będzie słabo kwaśny lu słabo zasadowy zależnie od tego, który z utworzonych elektrolitów,
kwas czy zasada, jest mocniejszy (w większym stopniu zdysocjowany). Jako przykład omówiona zastanie
reakcja hydrolizy węglanu amonu.
2NH
4
+
+ CO
3
2-
+ H
2
O
⇔
2NH
4
OH + H
2
CO
3
Małe wartości stałych dysocjacji tworzącego się wodorotlenku amonu i kwasu węglowego powodują powstanie
znacznej ilości obu tych związków w roztworze ( są one w małym stopniu zdysocjowane na jony).
5
-
4
-
4
OH
4
NH
10
1,79
=
OH]
NH
[
]
[OH
]
[NH
K
×
=
+
7
-
3
2
3
+
3
CO
2
H
10
4,47
=
]
CO
H
[
]
[HCO
]
[H
K
×
=
−
Wartość stałej dysocjacji wodorotlenku amonu jest większa od stałej dysocjacji kwasu węglowego, a
więc reakcja hydrolizy węglanu amonu ma charakter słabo alkaliczny.

6
4.4. Sole mocnych kwasów i mocnych zasad
Sole tej grupy nie ulegają hydrolizie, a ich roztwory wykazują odczyn obojętny (pH = 7). Spróbujmy wg
poprzednich reguł podać równanie reakcji chlorku sodu z wodą:
Na
+
+ Cl
-
+ H
2
O
⇔
Na
+
+ Cl
-
+ H
2
O
Po prawej i po lewej stronie równania mamy takie same reagenty, stąd wniosek, że sole mocnych
kwasów i mocnych zasad nie hydrolizują.
Literatura: 1. Praca zbiorowa pod redakcją K. Moskwy : „Ćwiczenia laboratoryjne z chemii z elementami teorii i
obliczeń dla mechaników„ skrypt AHG , str. 100 – 111, Kraków 2000 r.
CZĘŚĆ DOŚWIADCZALNA
Ćwiczenie 1. - Określenie pH za pomocą papierków uniwersalnych.
Sprzęt: - Statyw z probówkami
Odczynniki:
- roztwory: NaNO
3
, NH
4
Cl, MgCl
2
, AlCl
3
, Na
2
CO
3
, Na
2
HPO
4
.
-
papierki
uniwersalne
Opis ćwiczenia.
W
ćwiczeniu tym należy określić pH poszczególnych roztworów za pomocą papierków uniwersalnych. W
tym celu należy nalać do próbówek po 1 cm
3
odpowiednich soli. Następnie roztworami tymi kolejno zwilżać
papierek uniwersalny i barwę jego porównać ze skalą barw wskaźnika uniwersalnego, podającego pH z
dokładnością do 1.
Ćwiczenie 2. - Pomiar pH za pomocą pH-metru.
Sprzęt: - pH-metr
- elektroda uniwersalna (szklano - kalomelowa)
- zlewki
Odczynniki:
- roztwory soli jak w ćw.1.
- wzorcowe roztwory buforowe
Opis ćwiczenia.
Celem
ćwiczenia jest pomiar pH soli metodą dokładniejszą, za pomocą potencjometru (pH-metru).
Metoda pomiaru potencjometrycznego polega na mierzeniu zmian potencjału elektrod zwanych wskażnikowymi,
w zależności od stężenia jonów wodorowych. Pomiar polega na zmierzeniu różnicy potencjałów pomiędzy
elektrodą wskażnikową (szklaną) a elektrodą odniesienia (kalomelową) o stałym niezmiennym potencjale.
Wartość potencjału elektrody wskaźnikowej jest miarą pH badanego roztworu.
Technika pomiarowa. pH-metr jest przystosowany do współpracy z elektrodą kombinowaną lub z zestawem
elektrod do pomiaru pH złożonego z elektrody szklanej i elektrody odniesienia. Przed pomiarem przyrząd wraz z
elektrodami wycechować cecho za pomocą roztworów wzorcowych wskazanych przez asystenta. Po
wycechowaniu pH-metru można przystąpić do pomiaru pH badanych roztworów. Każdorazowo przy zmianie
roztworu należy opłukiwać dokładnie elektrody wodą destylowaną i osuszyć bibułą. Pomiar pH pojedynczego
roztworu powinien trwać ok. 5 minut (ustalenie równowagi jonowej).
Wyniki pomiarów pH oraz reakcje hydrolizy badanych soli zamieścić w tabeli w arkuszu sprawozdania.
Ćwiczenie 3. Stała i stopień dysocjacji CH
3
COOH w roztworze wodnym.
Sprzęt: - statyw z probówkami
-
pH-metr
-
elektroda
uniwersalna
- zlewki
Odczynniki: -
1 M CH
3
COOH
- 0,01 M CH
3
COOH
-
papierki
uniwersalne

7
Opis ćwiczenia.
Określić pH 0,01M i 1M roztworu kwasu octowego orientacyjnie za pomocą papierka uniwersalnego. Zmierzyć
dokładnie pH tych roztworów za pomocą pH-metru. Obliczyć stężenie jonów wodorowych odpowiadające
wyznaczonym wartościom pH dla obu roztworów.
W opracowaniu wyników należy:
1. Obliczyć stopień dysocjacji dla 1M i 0,01M CH
3
COOH znając stężenia jonów wodorowych oraz stężenia
użytych roztworów kwasu octowego.
2. Obliczyć stałą dysocjacji dla obu roztworów kwasu octowego znając stężenia jonów wodorowych i pamiętając,
że stężenie jonów octanowych równe jest stężeniu jonów wodorowych - zastosować wzór (4).
Wyniki pomiarów i obliczenia należy zamieścić w arkuszu sprawozdania.
Ćwiczenie 4. Reakcje jonowe otrzymywania trudno rozpuszczalnych soli.
Sprzęt: - statyw z probówkami
Odczynniki: -
1M BaCl
2
- 1M Ba(NO
3
)
2
- 1M Na
2
SO
4
- 1M H
2
SO
4
Opis ćwiczenia.
Do dwóch probówek nalać po 1 cm
3
BaCl
2
, do dwóch następnych po 1cm
3
Ba(NO
3
)
2
. Wytrącić osad
BaSO
4
dodając kroplami H
2
SO
4
do probówki zawierającej BaCl
2
i następnie Ba(NO
3
)
2
. Podobnie, w pozostałych
probówkach wytrącić osad dodając kroplami Na
2
SO
4
.
Zapisać zachodzące reakcje w postaci jonowej i cząsteczkowej w odpowiedniej tabeli w arkuszu
sprawozdania.
Ćwiczenie 5. Reakcje jonowe w roztworach wodnych i niewodnych.
Cel ćwiczenia:
Celem ćwiczenia jest wykazanie wpływu rozpuszczalnika na dysocjację elektrolityczną związków
nieorganicznych. W rozpuszczalniku polarnym jakim jest woda, rozpuszczalne związki nieorganiczne występują
w formie jonowej, a reakcje pomiędzy jonami zachodzą bardzo szybko. W rozpuszczalniku niepolarnym np. w
N,N-dimetyloformamidzie (DMF) proces rozpadu na jony (dysocjacja elektrolityczna) nie zachodzi, a związki
nieorganiczne występują w formie cząsteczkowej. Dopiero dodanie wody do niewodnego roztworu substancji
reagujących powoduje ich dysocjację na jony i w efekcie końcowym reakcja zachodzi pomiędzy jonami.
Opis ćwiczenia
Sprzęt: - statyw z probówkami
Odczynniki: - Pb(CH
3
COO)
2
roztwór wodny, Pb(CH
3
COO)
2
roztwór w DMF
KJ roztwór wodny, KJ roztwór w DMF
FeCl
3
roztwór wodny, FeCl
3
roztwór w DMF
K
4
[Fe(CN)
6
] roztwór wodny, K
4
[Fe(CN)
6
] roztwór w DMF
Do probówki wlać 0,5 cm
3
wodnego roztworu Pb(CH
3
COO)
2
. Dodać kilka kropli wodnego roztworu KJ, aż do
wytrącenia żółtego osadu PbJ
2
. Powtórzyć reakcję stosując roztwory Pb(CH
3
COOH)
2
i KJ w N,N –
dimetyloformamidzie (DMF). Uwaga ! – reakcje w roztworach niewodnych prowadzić w suchych probówkach.
Zaobserwować, czy wydziela się osad. Następnie do mieszaniny roztworu Pb(CH
3
COO)
2
i KJ w DMF dodać
kilka kropli wody i opisać opowiednim równaniem zachodzącą reakcję. Te same czynności wykonać dla reakcji
FeCl
3
z K
4
[Fe(CN)
6
], w wyniku której w roztworze powstaje niebieski osad Fe
4
[Fe(CN)
6
]
3
(sześciocyjanożelazian(II)żelaza(III) ).
W sprawozdaniu zapisać zachodzące reakcje w postaci cząsteczkowej i jonowej.
PYTANIA KONTROLNE.
1. Zdefiniować pojęcia: dysocjacja elektrolityczna, stała dysocjacji, stopień dysocjacji.

8
2. Jaką zależność określa prawo rozcieńczeń Ostwalda?
3. Napisać reakcje powstawania trudno rozpuszczalnych substancji: KI, PbCl
2
,
Cu(OH)
2
i Ag
2
CrO
4
w postaci cząsteczkowej i jonowej.
4. Co to jest hydroliza soli?
5. Które sole ulegają hydrolizie?
6. Jak hydrolizują następujące sole: CrCl
3
, K
2
CO
3
, NaCN, NaNO
3
, K
2
SO
4
, CH
3
COONa. Przedstawić ich
hydrolizę za pomocą odpowiednich reakcji i określić odczyn tych roztworów.
7. Co to jest iloczyn jonowy wody?
8. Podać definicję pH.
9. Obliczyć pH następujących roztworów:
a)
0,1 m HCN (zakładając, że
α
= 0,01%)
b)
0,1 m NH
4
OH (zakładając, że
α
= 1%)
10. Obliczyć stężenie H+ i OH- w roztworach wodnych o pH równych:
a) pH = 7, b) pH = 4, c) pH = 9
11.Scharakteryzować właściwości wody i N,N – dimetyloformamidu jako rozpuszczalników.
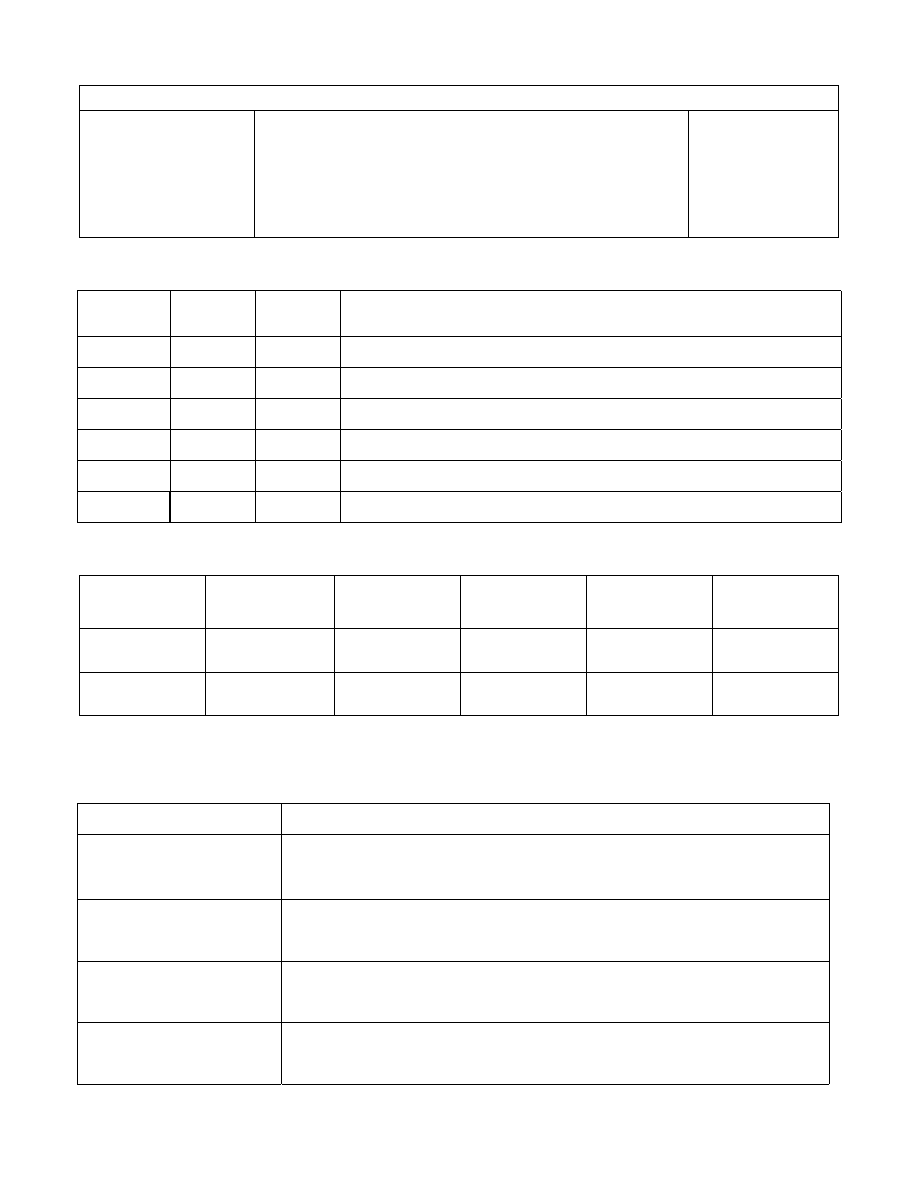
9
Równowagi w roztworach elektrolitów wodnych i niewodnych
WO rok I
Grupa:
Zespół:
Data :
Nazwisko, imię: Zaliczenie:
Ćwiczenie 1 i 2 – Określenie pH za pomocą papierków uniwersalnych i pH – metru.
Badana sól
Pomiar pH
(papierek
uniwersalny
)
Pomiar pH
(pH - metr)
Reakcje hydrolizy soli i ich odczyn
NaNO
3
NH
4
Cl
NH
4
Cl + H
2
O = NH
4
OH + H
+
+ Cl
-
pH < 7 (kwaśny)
MgCl
2
AlCl
3
Na
2
CO
3
Na
2
HPO
4
ćwiczenie 3 - Stała i sopień dysocjacji CH
3
COOH w roztworze wodnym.
Roztwór kwasu
octowego
Pomiar pH
(pap.uniwersalny)
Pomiar pH
( pH – metr )
Stężenie jonów
wodorowych [H
+
]
Stopień
dysocjacji
α
Stała dysocjacji
K
1M
0,01M
Uwaga: obliczenia [H
+
],
α
i K proszę podać na odwrocie arkusza.
Ćwiczenie 4 – Reakcje jonowe otrzymywania trudno rozpuszczalnych soli.
Substancjereagujące Zachodząca reakcja cząsteczkowa i jonowa
BaCl
2
+ H
2
SO
4
BaCl
2
+ H
2
SO
4
= BaSO
4
↓
+ 2HCl
Ba
2+
+ 2Cl
-
+ 2H
+
+ SO
4
2-
= BaSO
4
↓
+ 2H
+
+ 2Cl
-
Ba(NO
3
)
2
+ H
2
SO
4
BaCl
2
+ Na
2
SO
4
Ba(NO
3
)2 + Na
2
SO4

10
Ćwiczenie 5 – Reakcje jonowe w roztworach wodnych i niewodnych.
Substancje reagujące
Zachodząca reakcja cząsteczkowa i jonowa
Pb(NO
3
)
2
+ KJ (roztwory wodne)
Pb(NO
3
)
2
+ 2KJ = PbJ
2
↓
+ 2KNO
3
(żółty osad)
Pb
2+
+ 2NO
3
-
+ 2K
+
+ 2J
-
= PbJ
2
↓
+ 2K
+
+ 2NO
3
-
Pb(NO
3
)
2
(w DMF )
+ KJ
(w DMF )
reakcja nie zachodzi
Pb(NO
3
)
(w DMF)
+ KJ
(w DMF)
+ H
2
O Pb(NO
3
)
2
+ KJ =
FeCl
3
+ K
4
[Fe(CN)
6
] (roztwory wodne)
FeCl
3 (w DMF)
+ K
4
[Fe(CN)
6
]
(w DMF)
FeCl
3
(w DMF)
+ K
4
[Fe(CN)
6
]
(w DMF)
+ H
2
O
Wyszukiwarka
Podobne podstrony:
HYDROLOGIA 07 id 207788 Nieznany
Hydroliza soli id 207726 Nieznany
hydrologia wyklad 06 id 207845 Nieznany
hydrologia wyklad 05 id 207839 Nieznany
Hydrologia egzamin id 207800 Nieznany
hydrologia wyklad 3 id 207831 Nieznany
hydrologia wyklad 06 id 207844 Nieznany
HYDROLOGIA 03 id 207785 Nieznany
HYDROLOGIA 10 id 207791 Nieznany
HYDROLOGIA 09 id 207790 Nieznany
HYDROLOGIA 07 id 207788 Nieznany
Hydroliza soli id 207726 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
więcej podobnych podstron