
1
Materiały internetowe
• http://www.angelo.edu/faculty/kboudrea/index/Notes_C
hapter_08.pdf
• http://cwx.prenhall.com/petrucci/medialib/power_point/
Ch24.ppt
• http://web.mit.edu/2.813/www/Class%20Slides/Lecture
%207%20Mat.Prod.pdf
• http://www.google.pl/search?hl=pl&lr=&client=firefox-
a&channel=s&rls=org.mozilla:pl:official&q=uklad+okre
sowy+pierwiastkow%2BPower+Point&start=20&sa=N
•
http://www.its.caltech.edu/~chem1/Lecture%20Notes%
20pdfs/Series%204%20Periodic%20Trends.pdf
• http://zchoin.fct.put.poznan.pl
2
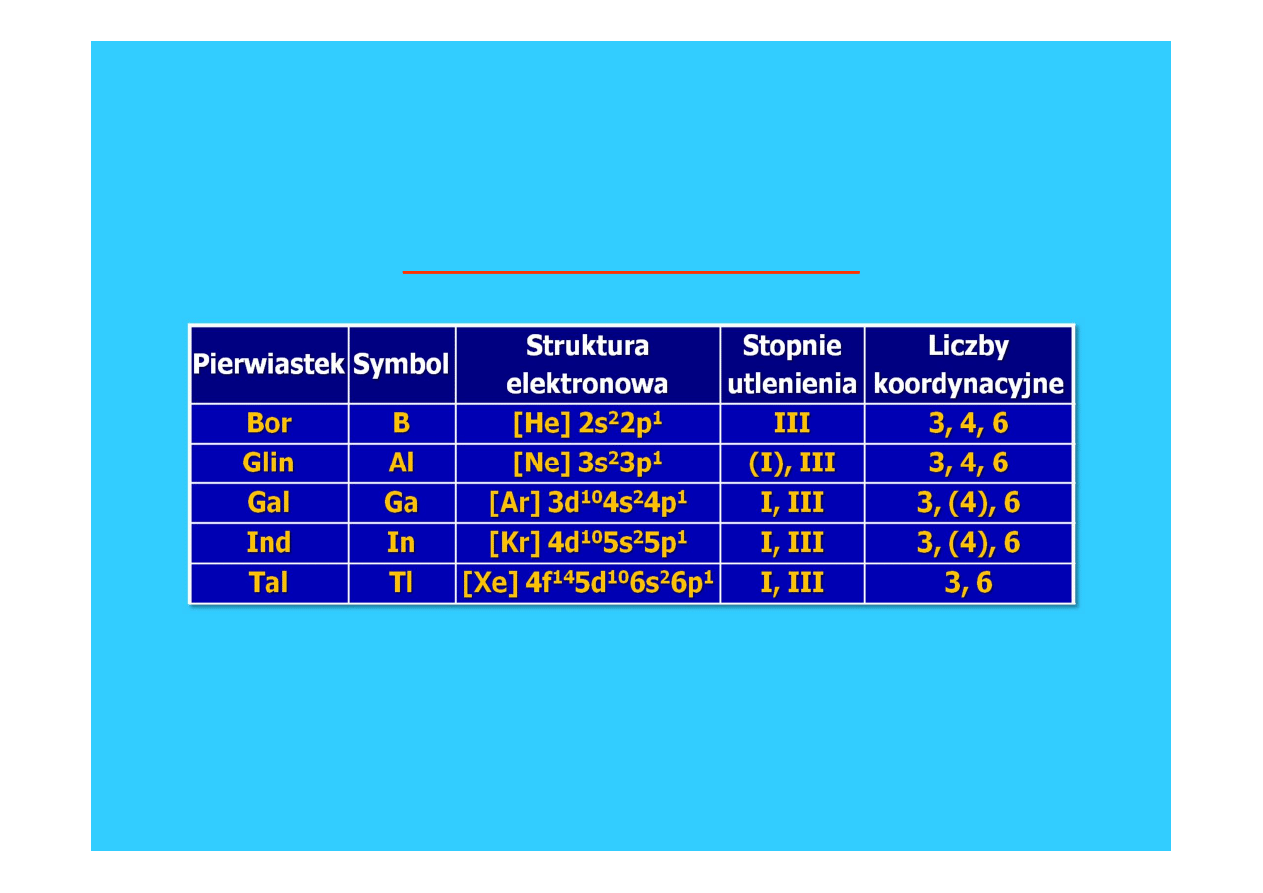
Struktura elektronowa borowców
Struktura elektronowa borowców
Borowce rozpoczynają tzw. „blok p” pierwiastków układu okresowego
(litowce i berylowce to pierwiastki tzw. „bloku s”).
Borowce rozpoczynają tzw. „blok p” pierwiastków układu okresowego
(litowce i berylowce to pierwiastki tzw. „bloku s”).

3
Właściwości fizykochemiczne borowców
Właściwości fizykochemiczne borowców
Pierwiaste
k
Promień
kowalencyjn
y
[Å]
Promie
ń
jonowy
[Å]
Gęstość
[g/cm
3
]
Energia
jonizacji
1
[kJ/mol]
Elektroujemnoś
ć
Temperatur
a topnienia
[
o
C]
Zawartość
w skorupie
ziemskiej
[ppm]
Bor
0.80
0.20
2.4
6764
2.0
2075
3
Glin
1.25
0.52
2.7
5114
1.5
660
83200
Gal
1.25
0.60
5.9
5500
1.6
29.7
15
Ind
1.50
0.81
7.3
5066
1.7
156
0.1
Tal
1.55
0.95
11.8
5413
1.8
304
~2
Porównawcze wartości dla litowców i berylowców
Litowce
1.23÷2.35
0.60÷
1.69
0.54÷
1.87
520÷
375
1.0÷0.7
181÷29
Berylowce 0.89÷1.98
0.31÷
1.50
1.8÷
5.0
2656÷
1488
1
1.5÷0.9
1277÷700
1 – sumaryczna energia jonizacji niezbędna do utworzenia jonów Me
2+
(berylowce) i Me
3+
(borowce)
1 – sumaryczna energia jonizacji niezbędna do utworzenia jonów Me
2+
(berylowce) i Me
3+
(borowce)

4
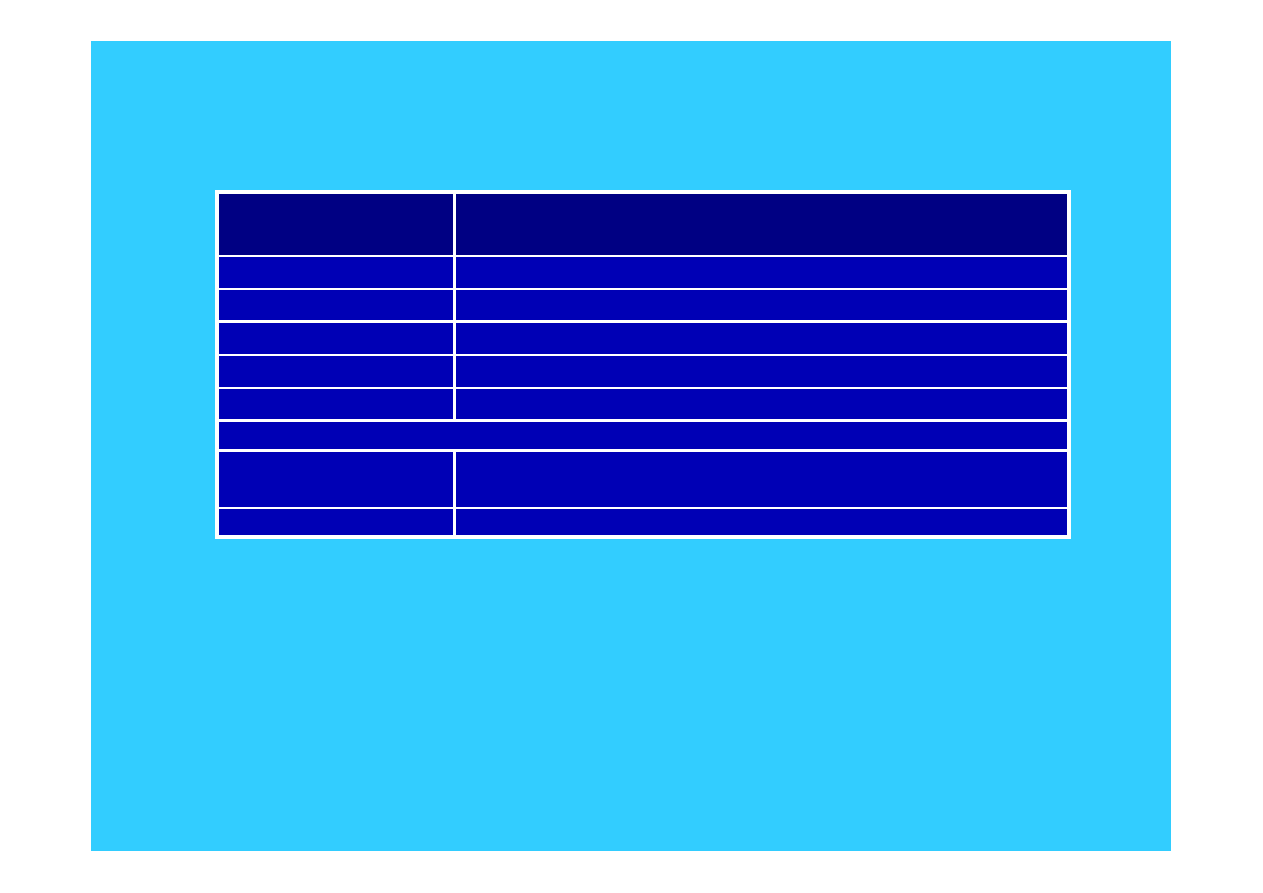
Standardowe potencjały elektrodowe borowców
Standardowe potencjały elektrodowe borowców
Pierwiastek
Potencjał standardowy
E
o
[V]
Bor
-0.89
1
Glin
-1.66
2
Gal
-0.53
2
Ind
-0.34
2
Tal
-0.34
3
Porównawcze wartości dla litowców i berylowców
Litowce
-2.71÷-2.93 (Na÷Cs)
dla Li -3.05 (efekt silnej hydratacji)
Berylowce
-1.85÷-2.90 (Be÷Ba)
Podane wartości charakteryzują zachowanie się borowców w środowisku kwaśnym.
Reakcje elektrodowe:
1) bor: H
3
BO
3aq
+3H
+
+3e → B
kryst
+ 3H
2
O
2) glin, gal, ind: Me
3+
+ 3e → Me
kryst
3) tal: Tl
+
+ e → Tl
kryst
Odstępstwo obserwowane dla boru (wyższy potencjał niż dla glinu) wynika ze
zmiany charakteru pierwiastka (bor – niemetal, nie ulegający hydratacji; glin –
kation o dużym ładunku, silnie hydratowany).
Podane wartości charakteryzują zachowanie się borowców w środowisku kwaśnym.
Reakcje elektrodowe:
1) bor: H
3
BO
3aq
+3H
+
+3e → B
kryst
+ 3H
2
O
2) glin, gal, ind: Me
3+
+ 3e → Me
kryst
3) tal: Tl
+
+ e → Tl
kryst
Odstępstwo obserwowane dla boru (wyższy potencjał niż dla glinu) wynika ze
zmiany charakteru pierwiastka (bor – niemetal, nie ulegający hydratacji; glin –
kation o dużym ładunku, silnie hydratowany).
5
Standardowe potencjały elektrodowe
borowców
Pierwiastek
Potencjał standardowy
E
o
[V]
Bor
-0.89
1
Glin
-1.66
2
Gal
-0.53
2
Ind
-0.34
2
Tal
-0.34
3
Porównawcze wartości dla litowców i berylowców
Litowce
-2.71÷-2.93 (Na÷Cs)
dla Li -3.05 (efekt silnej hydratacji)
Berylowce
-1.85÷-2.90 (Be÷Ba)
Podane wartości charakteryzują zachowanie się borowców w środowisku kwaśnym.
Reakcje elektrodowe:
1) bor: H
3
BO
3aq
+3H
+
+3e → B
kryst
+ 3H
2
O
2) glin, gal, ind: Me
3+
+ 3e → Me
kryst
3) tal: Tl
+
+ e → Tl
kryst
Odstępstwo obserwowane dla boru (wyższy potencjał niż dla glinu) wynika ze
zmiany charakteru pierwiastka (bor – niemetal, nie ulegający hydratacji; glin –
kation o dużym ładunku, silnie hydratowany).
Podane wartości charakteryzują zachowanie się borowców w środowisku kwaśnym.
Reakcje elektrodowe:
1) bor: H
3
BO
3aq
+3H
+
+3e → B
kryst
+ 3H
2
O
2) glin, gal, ind: Me
3+
+ 3e → Me
kryst
3) tal: Tl
+
+ e → Tl
kryst
Odstępstwo obserwowane dla boru (wyższy potencjał niż dla glinu) wynika ze
zmiany charakteru pierwiastka (bor – niemetal, nie ulegający hydratacji; glin –
kation o dużym ładunku, silnie hydratowany).

6
Rozpowszechnienie borowców w
skorupie ziemskiej
Bor – stanowi 1 10
-3
% skorupy ziemskiej. Występuje
jako - kwas oksoborowy - H
3
BO
3
(gorące źródła,
wulkany) oraz boraks - Na
2
B
4
O
7
10H
2
O
Glin - 7,4 % mas. w skorupie ziemskiej (3-ci pierwiastek)
Minerały :
korund - odmiana Al
2
O
3
ortoklas - KAl[Si
3
O
8
]
bemit - AlO OH gł. składnik boksytów
kriolit - Na
3
AlF
6
• Pozostałe metale tj. gal, ind i tal występują w
małych ilościach, tj. 10
-3
- 10
-5
% nie tworzą
własnych minerałów.

7
Ogólna charakterystyka borowców
• Bor jest jedynym niemetalem wśród borowców. Glin
i kolejne metale III grupy głównej mają charakter
amfoteryczny (cechy amfoteryczne maleją od glinu
do talu).
• Dla borowców podstawowym stopniem utlenienia
jest stopień +3 (tal tworzy trwalsze związki na
stopniu utlenienia +1). Występowanie borowców
(poza borem) na +1 stopniu utlenienia, jest
związane z „efektem nieczynnej pary
elektronowej”.
• Małe rozmiary i duży ładunek jonów oraz wysokie
energie jonizacji, powodują, że borowce tworzą
głównie związki o wiązaniach kowalencyjnych.
Związki boru są zawsze kowalencyjne. Inne związki
(np. AlCl
3
, GaCl
3
) są kowalencyjne w stanie
bezwodnym, ale dysocjują na jony w roztworze.
8
• Podobieństwo diagonalne (po przekątnej):
•
Li
Be
B
C
•
•
Mg
Al
Si
• Skutek: bor jest bardziej podobny do krzemu
niż do glinu
9
Otrzymywanie borowców
• Bor jest pierwiastkiem mniej
reaktywnym jak litowce i
berylowce. Można go otrzymać
z jego tlenku, przez redukcję
magnezem lub sodem:
B
2
O
3
+ 3Mg = 2B + 3MgO
H
o
= - 532 kJ/mol
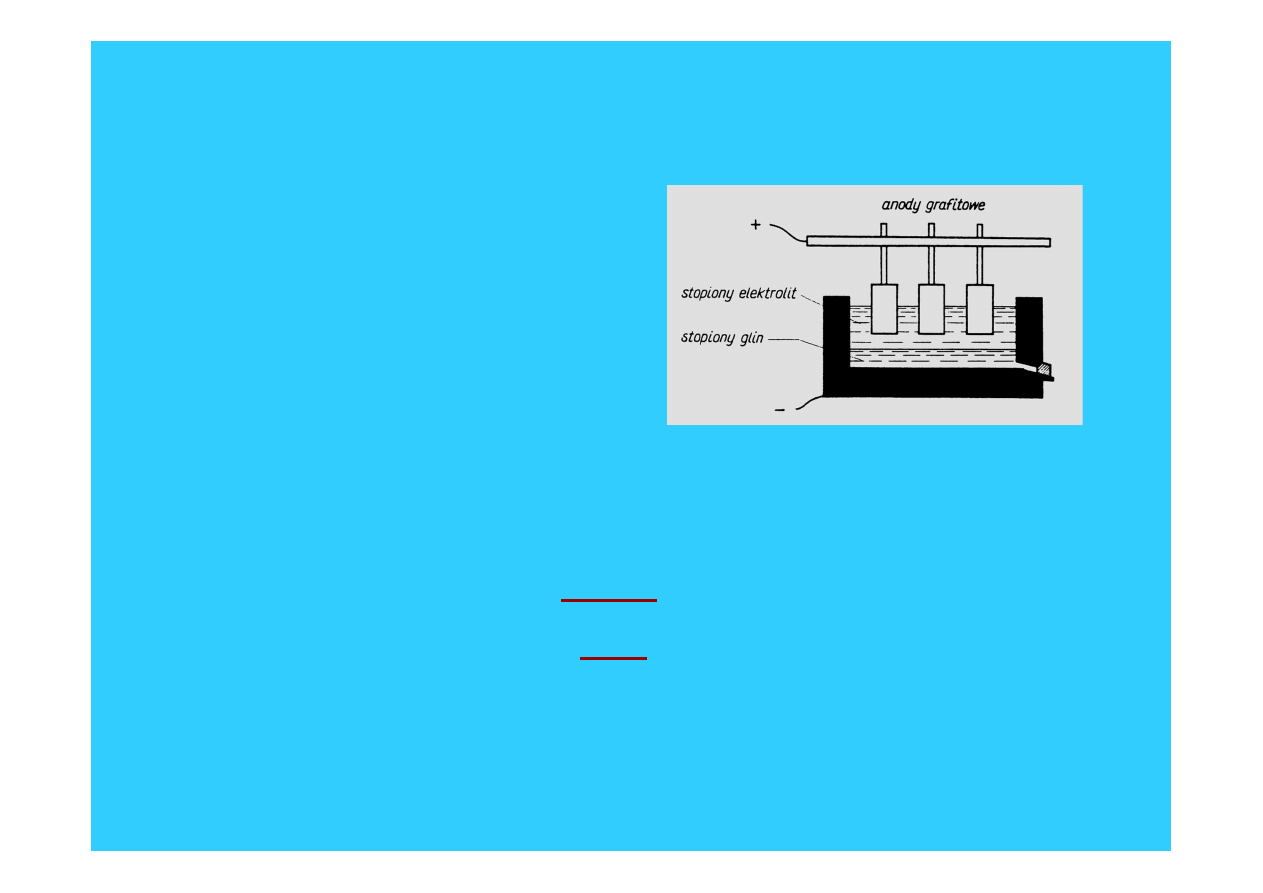
• Glin otrzymuje się z boksytów
(Al
2
O
3
▪H
2
O) – po etapach
przygotowawczych prowadzi się
elektrolizę stopionego Al
2
O
3
rozpuszczonego w kriolicie:
• Gal, ind i tal otrzymuje się
najczęściej przez elektrolizę
wodnych roztworów ich soli
elektroliza
Al
2
O
3
w stopionym
Na
3
AlF
6
w 1220 K
elektroliza
Al
2
O
3
w stopionym
Na
3
AlF
6
w 1220 K
Katoda : Al
3+
+ 3e = Al
Anoda : 2OH
-
= H
2
O + 1/2 O
2
+ 2e
Wysoki koszt
energii. W USA 5% energii
zużywana
jest na produkcję
aluminium
Katoda : Al
3+
+ 3e = Al
Anoda : 2OH
-
= H
2
O + 1/2 O
2
+ 2e
Wysoki koszt
energii. W USA 5% energii
zużywana
jest na produkcję
aluminium

10
Właściwości chemiczne
borowców
Glin roztwarza się w kwasach i zasadach :
2Al + 6H
+
= 2Al
3+
+ 3H
2
Al + 2OH
-
+ 6H
2
O = 2[Al(OH)
4
]
-
+ 3H
2
Gal też jest amfoteryczny
Ind, tal roztwarzają się tylko w kwasach
In + 3H
+
= In
3+
+
3
/
2
H
2
Tl + H
+
= Tl
+
+
1
/
2
H
2
Glin jako tworzywo konstrukcyjne pasywacja (Al
2
O
3
)
amfoteryczność

11
Właściwości chemiczne borowców
• azotki typu MeN: 2Me + N
2
→
2MeN (Me=B, Al)
Azotek galu powstaje w temp. 1200
o
C w reakcji z tlenem i
amoniakiem:
4Ga + 4NH
3
+ 3O
2
→
4GaN + 6H
2
O
• tlenki Me
2
O
3
: 4Me + 3O
2
→
2Me
2
O
3
(Me=B, Al, Ga, In, Tl)
(gal ogrzewany w powietrzu tworzy GaO, który jest mieszaniną
Ga i Ga
2
O
3
):
• Tlenki powstają też podczas termicznego rozkładu
węglanów,wodorotlenków, azotanów i siarczanów borowców
2Me(OH)
3
→
Me
2
O
3
+ 3H
2
O (Me=Al, Ga, In, Tl)
B
2
O
3
powstaje z kwasu ortoborowego w temperaturze
czerwonego żaru:
H
3
BO
3
→
HBO
2
+ H
2
O → B
2
O
3
+ H
2
O
• Borowce, w odróżnieniu od litowców i berylowców, nie tworzą
nadtlenków ani ponadtlenków.

12
Właściwości chemiczne borowców
• Borowce nie reagują z wodą.
• Produktem reakcji tlenku boru B
2
O
3
z wodą jest kwas ortoborowy:
B
2
O
3
+ 3H
2
O → 2H
3
BO
3
Tlenki metalicznych borowców są nierozpuszczalne w wodzie.
Tlenek boru ma właściwości kwasowe, tlenek glinu i galu są amfoteryczne, zaś
tlenek indu ma właściwości zasadowe.
• Azotki boru oraz glinu, galu i indu reagują z wodą i powstaje odpowiednio kwas
ortoborowy i amoniak oraz wodorotlenki i amoniak:
BN + 3H
2
O → H
3
BO
3
+ NH
3
MeN + 3H
2
O → Me(OH)
3
+ NH
3
(Me=Al, Ga, In)
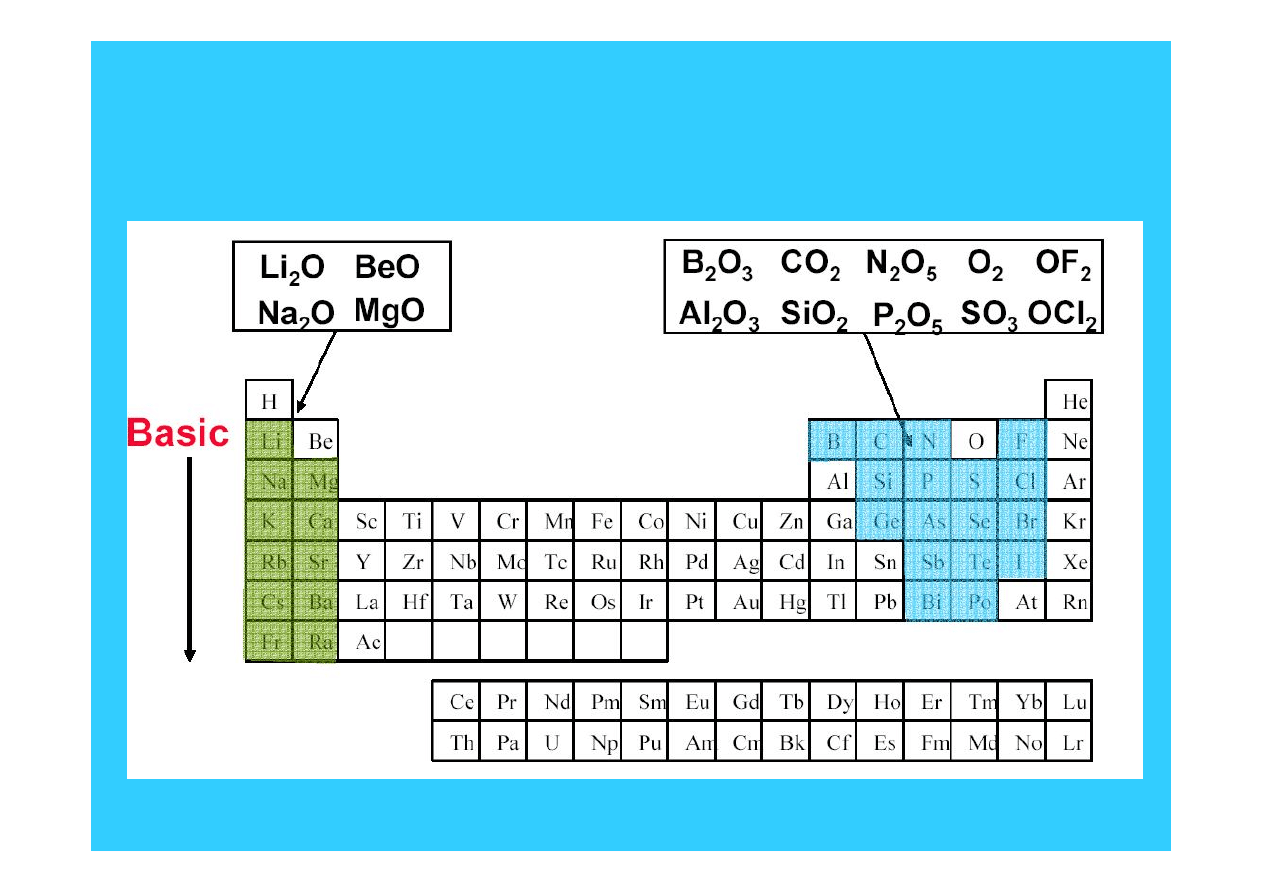
13
Kwasowo-zasadowe własności
tlenków
Kwasowość wzrasta w górę grupy i z lewa na prawo w okresie
Kwasowość wzrasta w górę grupy i z lewa na prawo w okresie
14
Tlenki i wodorotlenki glinowców
hydralgilit
Ponadto bezpostaciowy
Al(OH)
3
wodorotlenek glinu
bajeryt
diaspor
AlO(OH)
bemit
wzrost st. OH
-
wzrost st. H
+
prażenie
Wodorotlenek glinu
-Al
2
O
3
(korund)
1500 K
Ga
2
O
3
Ga(OH)
3
In
2
O
3
In(OH)
3
Tl
2
O
3
Tl(OH)
3
nie jest znany
Tl
2
O TlOH
mocna zasada
amfoteryczne
3
6
2
5
4
3
2
2
3
]
)
OH
(
Al
[
]
)
OH
(
Al
[
)
OH
(
Al
[
)
OH
(
Al
]
)
OH
(
Al
[
]
AlOH
[
Al
hydralgilit
Ponadto bezpostaciowy
Al(OH)
3
wodorotlenek glinu
bajeryt
diaspor
AlO(OH)
bemit
wzrost st. OH
-
wzrost st. H
+
prażenie
Wodorotlenek glinu
-Al
2
O
3
(korund)
1500 K
Ga
2
O
3
Ga(OH)
3
In
2
O
3
In(OH)
3
Tl
2
O
3
Tl(OH)
3
nie jest znany
Tl
2
O TlOH
mocna zasada
amfoteryczne
3
6
2
5
4
3
2
2
3
]
)
OH
(
Al
[
]
)
OH
(
Al
[
)
OH
(
Al
[
)
OH
(
Al
]
)
OH
(
Al
[
]
AlOH
[
Al

15
Tlenowe kwasy boru
pochodne
B
2
O
3
HBO
2
- kwas metaborowy
H
3
BO
3
- kwas ortoborowy
Kwas metaborowy powstaje:
400 K
H
3
BO
3
HBO
2
+ H
2
O
HBO
2
jest nietrwały w roztworze wodnym:
HBO
2
+ H
2
O = H
3
BO
3
Kwas H
3
BO
3
jest b. słabym kwasem jednoprotonowym:
H
3
BO
3
+ 2H
2
O = [B(OH)
4
]
-
+ H
3
O
+
Sole kwasów borowych to OKSOBORANY
Najważniejsza sól boru:
Na
2
B
4
O
7
10H
2
O - BORAKS

16
Połączenia boru z wodorem
• Żaden borowiec nie reaguje bezpośrednio z wodorem z
utworzeniem wodorków.
•
Brak BH
3
znany jest jedynie addukt BH
4
-
, tj. anion
tetrahydroboranu
• Podstawowy wodorek boru – diboran B
2
H
6
– można otrzymać
następująco:
Mg
3
B
2
+ H
3
PO
4
→ mieszanina boranów →B
2
H
6
2BCl
3
+ 6H
2
→ 2B
2
H
6
+ 6HCl
4BCl
3
+ 3Li[AlH
4
] → 2B
2
H
6
+ 3AlCl
3
+ 3LiCl
B
2
H
6
, B
5
H
9
, B
8
H
12
, B
16
H
20
B
n
H
n+4
B
4
H
10
, B
6
H
12
, B
10
H
16
B
n
H
n+6
B
8
H
16
, B
10
H
18
Inne
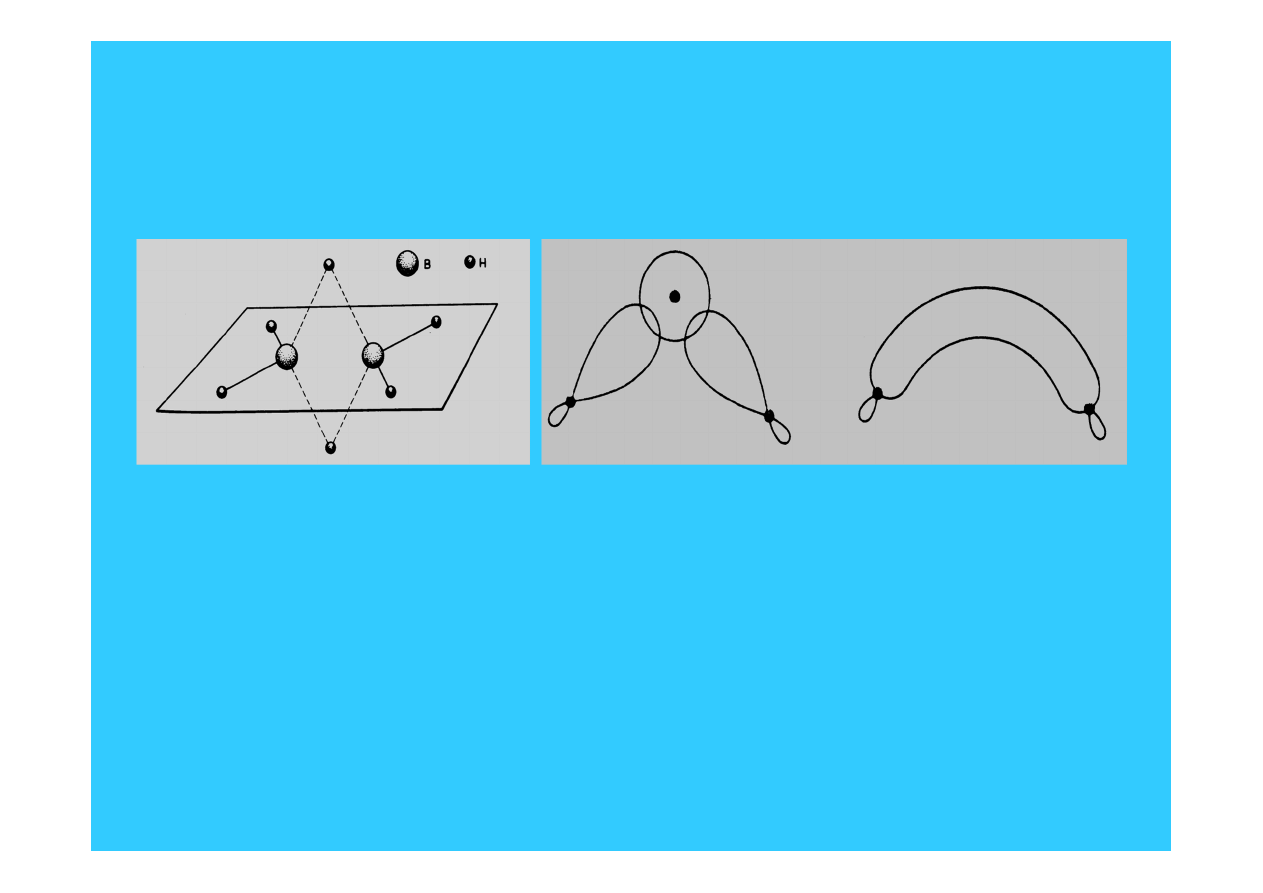
17
Połączenia boru z wodorem
Hybrydyzacja orbitali elektronowych obu atomów boru
jest typu sp
3
Hybrydyzacja orbitali elektronowych obu atomów boru
jest typu sp
3
Następuje nakładanie się zhybrydyzowanych orbitali obu atomów boru
na orbital 1s wodoru (położony pomiędzy atomami boru) – powstaje
zdelokalizowany orbital trójcentrowy, tzw. orbital bananowy.
Liczba elektronów walencyjnych:
2 x 3 + 6 x 1
= 12 el.
Gdyby były wyłącznie wiązania typu
to 8 x 2 = 16 el.
Borany są związkami elektronowo "deficytowymi"
Budowa cząsteczek C
2
H
6
i B
2
H
6
- porównanie !
Następuje nakładanie się zhybrydyzowanych orbitali obu atomów boru
na orbital 1s wodoru (położony pomiędzy atomami boru) – powstaje
zdelokalizowany orbital trójcentrowy, tzw. orbital bananowy.
Liczba elektronów walencyjnych:
2 x 3 + 6 x 1
= 12 el.
Gdyby były wyłącznie wiązania typu
to 8 x 2 = 16 el.
Borany są związkami elektronowo "deficytowymi"
Budowa cząsteczek C
2
H
6
i B
2
H
6
- porównanie !

18
Połączenia boru z wodorem
Znane są też trwalsze od zwykłych wodorków tetrahydroborany:
• 4NaH + B(OCH
3
)
3
→
Na[BH
4
] + 3CH
3
ONa
Ogólnie – Me[BH
4
]
n
, Me=litowce, Be, Al i metale przejściowe; „n”
zależy od wartościowości kationu.
• Inne borowce też tworzą wodorki z niedoborem elektronów:
AlCl
3
+ LiH → (AlH
3
)n → Li[AlH
4
]
Gal tworzy Li[GaH
4
], ind – polimeryczny wodorek (InH
3
)n,
natomiast nie jest pewne, czy tal tworzy wodorek.
• Wodorki boru są kowalencyjne, a innych borowców
(niekompleksowe) - polimeryczne. Wodorki kompleksowe
(zwłaszcza litowców) są jonowe.
• Wodorki są silnymi reduktorami – reagują z wodą z
wydzieleniem wodoru:
B
2
H
6
+ 6H
2
O → 2H
3
BO
3
+ 6H
2
Li[AlH
4
] + 4H
2
O → LiOH + Al(OH)
3
+ 4H
2
19
Halogenki borowców
• W podwyższonej temperaturze borowce reagują z fluorowcami
2Me + 3X
2
→
2MeX
3
(Me=B, Al, Ga, In, Tl; X=F, Cl, Br, I)
Wszystkie halogenki boru mają budowę kowalencyjną i są gazami. Flluorki
pozostałych borowców są jonowe, a ich inne halogenki – w stanie
bezwodnym – są kowalencyjne.
• Wszystkie halogenki hydrolizują pod wpływem wody – halogenki boru dają
inne produkty hydrolizy niż halogenki pozostałych borowców:
4BF
3
+ 3H
2
O → H
3
BO
3
+ 3H[BF
4
]
BX
3
+ 3H
2
O → H
3
BO
3
+ 3HX (X=Cl, Br, I)
MeX
3
+ 3H
2
O → Me(OH)
3
+ 3HX (Me=Al, Ga, In, Tl; X=F, Cl, Br, I)
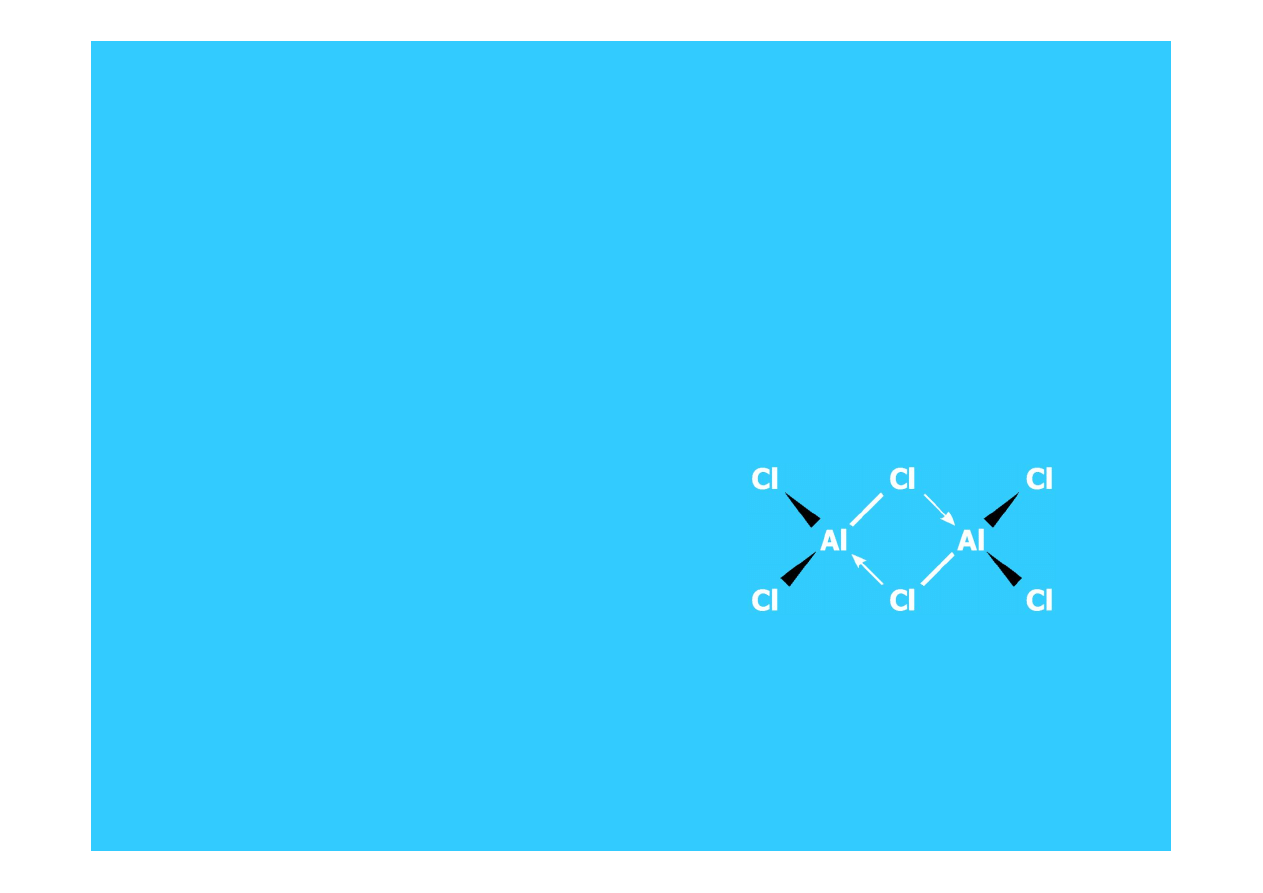
• AlCl
3
, AlBr
3
i GaCl
3
występują w środowiskach niepolarnych w postaci
dimerów (osiągają w ten sposób konfigurację oktetu elektronowego):

20
Halogenki borowców
• Wszystkie borowce dają halogenki MeX w fazie gazowej, w
wysokiej temperaturze. Poza Tl+F- wszystkie te związki są
kowalencyjne. Halogenki jednowartościowego talu są trwalsze od
tych na +III stopniu utlenienia:
MCl
3
+ 2M → 3MCl (M=borowiec)
• Bor tworzy dihalogenki o wzorze B
2
X
4
, w których występuje
wiązanie B-B:
2BCl
3
+ 2Hg → B
2
Cl
4
+ Hg
2
Cl
2
• Gal i ind tworzą dihalogenki MeX
2
, w których jednak nie są na
+II stopniu utlenienia (w rzeczywistości te związki mają budowę
kompleksową i zawierają gal i ind na stopniach utlenienia +I i
+III):
Me + MeCl
3
→
2MeCl
2
(Me[MeCl
4
]) (Me=Ga, In)

21
Związki boru z metalami
• Borki : Me
n
B
m
1) Odporne na czynniki chemiczne
2) Wysokie temperatury topnienia; > 2300 K
• Zastosowania:
1) dysze rakiet
2) elektrody pracujące w wysokich
temperaturach

22
rozpuszczalność związków borowców w
wodzie
• Te związki borowców, dla których energia hydratacji jest większa od
energii sieciowej, są dobrze rozpuszczalne w wodzie (m.in. azotany,
halogenki z wyjątkiem niektórych fluorków, siarczany, częściowo
siarczki).
• Kwas ortoborowy – H
3
BO
3
i tlenek boru – B
2
O
3
, są umiarkowanie
dobrze rozpuszczalne w wodzie.
• Wodorotlenki borowców Me(OH)
3
(Me=Al, Ga, In, Tl) są
trudnorozpuszczalne,a iloczyny rozpuszczalności maleją ze wzrostem
liczby atomowej borowca.
• Tlenki metalicznych borowców są nierozpuszczalne.
• Spośród siarczków borowców B
2
S
3
, Al
2
S
3
i Ga
2
S
3
są dobrze
rozpuszczalne w wodzie. Siarczki indu i talu na +III stopniu
utlenienia są nierozpuszczalne.
•
• Wszystkie ortofosforany – MePO
4
i ortoarseniany – MeAsO
4
borowców (Me=Al, Ga, In, Tl) należą do najtrudniej rozpuszczalnych
w wodzie związków tych metali.
•
• Związki talu na +I stopniu utlenienia są zazwyczaj trudniej
rozpuszczalne niż analogi na +III stopniu utlenienia

23
Związki borowców z węglem
• W wyniku ogrzewania boru z węglem powstaje przestrzenny
węglik (metanek)
o wzorze B
12
C
3
(struktura sieci podobna do NaCl):
12Be + 3C → Be
12
C
3
• Glin ogrzewany z węglem, tworzy typowy dla III grupy węglik
(metanek) Al
4
C
3
:
4Al + 3C → Al
4
C
3
• Ale – podobnie do berylowców – w reakcji z acetylenem glin
tworzy acetylenek:
2Al + 3C
2
H
2
→
Al
2
(C2)
3
+ 3H
2
• Acetylenki reagując z wodą wydzielają acetylen, zaś produktem
reakcji metanku z wodą jest metan:
Al
2
(C2)
3
+ 6H
2
O → 2Al(OH)
3
+ 3H
2
C
2
Al
4
C
3
+ 12H
2
O → 4Al(OH)
3
+ 3CH
4

24
Związki kompleksowe borowców
• Jony borowców są mniejsze od jonów litowców i
berylowców
i mają większy ładunek – dlatego chętniej tworzą
połączenia kompleksowe.
Znane są typowe kompleksy nieorganiczne borowców o
budowie tetraedrycznej: np. [BF
4
]
-
, [AlH
4
]
-
, [BH
4
]
-
,
[Al(OH)
4
]
-
, [InCl
4
]
-
, [GaCl
4
]
-
oraz oktaedrycznej:
[Me(H
2
O)
6
]
3+
(Me=Al, Ga, In, Tl) i
[MeCl
6
]
3-
(Me=Al,
Ga, In, Tl)
• Najważniejszymi kompleksami borowców są
oktaedryczne kompleksy chelatowe, m.in. z EDTA,
acetyloacetonem, szczawianami i 8-hydroksychinoliną
(oksyną):
25
Związki kompleksowe borowców
In group 3 the electronegativity of the metals is getting a bit
higher, and the heavier metals Ga, In, and Tl are actually
post-transition elements (they are close to Au), so have
much higher electronegativity and a very different chemistry
from B and Al. They form trivalent cations that form very
strong complexes:
Metal ion:
Al(III)
Ga(III) In(III)
Tl(III)
ionic radius (Å):
0.58
0.62
0.80
0.89
log K
1
(OH)
-
9.0
11.4
10.6
13.4
log K
1
(EDTA):
16.4
20.4
25.0
35.3
increasing electronegativity
26
The Tl(III) ion is stabilized by complexation with ligands, and is
an extremely powerful Lewis acid. Because of its high
electronegativity, Tl(III) is classified as soft in HSAB, as
reflected by its log K
1
values with halide ions:
Metal ion:
Al
3+
Ga
3+
In
3+
Tl
3+
log K
1
(F
-
):
6.42
4.47
3.74
2.6
log K
1
(Cl
-
): -1.0
0.01
2.32
6.72
HARD
←
→
SOFT
Związki kompleksowe
borowców

27
Najważniejsze zastosowania związków borowców
Bor
(B),
glin
(Al), w mniejszym stopniu
gal
(Ga) i
ind
(In): dodatki stopowe do stali.
Glin jest składnikiem podstawowym ważnych stopów lekkich konstrukcyjnych.
Glin stosowany jest też w aluminotermii i do odtleniania stali.
Korund
(
elektrokorund
, stopiony Al
2
O
3
): podstawowy materiał ścierny
(twardość 9.3 w 10-stopniowej skali Mohsa).
Naturalne glinokrzemiany
: do produkcji materiałów wiążących dla budownictwa
(cement portlandzki – do 7% Al
2
O
3
, cement glinowy – do 45% Al
2
O
3
).
Kaoliny
,
gliny
i
skalenie
(materiały o dużej zawartości Al
2
O
3
): wyroby ceramiczne
i szklarskie (jeden z podstawowych tlenków szkłotwórczych, obok SiO
2
).
B
2
O
3
(zazwyczaj w postaci
boraksu
lub
H
3
BO
3
): jeden z najważniejszych składników
szkłotwórczych dla szkieł gatunkowych wysokiej jakości (Silvit, Termisil, szkło
na włókna szklane, na ekrany kineskopowe).
H
3
BO
3
: łagodne działanie antyseptyczne.
Ałuny
(np. KAl(SO
4
)
2
∙12H
2
O): składniki sztyftów poprawiających krzepliwość krwi.
Boraks
(Na
2
B
4
O
7
∙4H
2
O): wyrób sztucznych materiałów ozdobnych (tzw. „perła
boraksowa”
B
2
O
3
+ CoO → Co(BO
2
)
2
, produktem są metaoksoborany).
Peroksoboran sodu
(NaBO
3
): dodatek wybielający w proszkach do prania.
Najważniejsze zastosowania związków borowców
Bor
(B),
glin
(Al), w mniejszym stopniu
gal
(Ga) i
ind
(In): dodatki stopowe do stali.
Glin jest składnikiem podstawowym ważnych stopów lekkich konstrukcyjnych.
Glin stosowany jest też w aluminotermii i do odtleniania stali.
Korund
(
elektrokorund
, stopiony Al
2
O
3
): podstawowy materiał ścierny
(twardość 9.3 w 10-stopniowej skali Mohsa).
Naturalne glinokrzemiany
: do produkcji materiałów wiążących dla budownictwa
(cement portlandzki – do 7% Al
2
O
3
, cement glinowy – do 45% Al
2
O
3
).
Kaoliny
,
gliny
i
skalenie
(materiały o dużej zawartości Al
2
O
3
): wyroby ceramiczne
i szklarskie (jeden z podstawowych tlenków szkłotwórczych, obok SiO
2
).
B
2
O
3
(zazwyczaj w postaci
boraksu
lub
H
3
BO
3
): jeden z najważniejszych składników
szkłotwórczych dla szkieł gatunkowych wysokiej jakości (Silvit, Termisil, szkło
na włókna szklane, na ekrany kineskopowe).
H
3
BO
3
: łagodne działanie antyseptyczne.
Ałuny
(np. KAl(SO
4
)
2
∙12H
2
O): składniki sztyftów poprawiających krzepliwość krwi.
Boraks
(Na
2
B
4
O
7
∙4H
2
O): wyrób sztucznych materiałów ozdobnych (tzw. „perła
boraksowa”
B
2
O
3
+ CoO → Co(BO
2
)
2
, produktem są metaoksoborany).
Peroksoboran sodu
(NaBO
3
): dodatek wybielający w proszkach do prania.
Borowce
27
Wyszukiwarka
Podobne podstrony:
Borowce, chemia
Borowce
BOROWCE
Związki borowców
powtórka 3 borowce, Chemia zadania
BOROWCE, chemia kosmetyczna
Borowce
Borowce id 92046 Nieznany (2)
BOROWCE
litowceberylowce borowce
zagadnienia do egz z chemii nieorg, BOROWCE
23 wykad 13 gr[1] borowce[F]2006
Wykład 7 Borowce CHC13005w, VI. BOROWCE
Nalewka borowczana z czarnych jagod, ■ WSZYSTKO ▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀, ■ KUCHNI
Nalewka borowczana, gotowanie- kuchie swiata, domowy wyrob wodek
Gdzie jest broń borowców Lecha Kaczyńskiego
17-borowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
borowce
więcej podobnych podstron