
CHEMIA NIEORGANICZNA
CZ. II CHEMIA PIERWIASTKÓW
WYKŁAD 9

CYNKOWCE – 12 GRUPA
Zn – cynk
(znany od dawna, nazwę nadał Paracelsus z niem. Zinke – zębaty,
poszczerbiony – od kształtu kryształów metalicznego cynku)
Cd - kadm
1817 r., F. Stromeyer – odkryty jako zanieczyszczenie ZnCO
3
(kalamina); gr. Kadmos – założyciel Teb)
Hg - rtęć
(znany od dawna – odnaleziony w grobowcach egipskich sprzed 1500
BC; łac. Hydrargyrum – płynne srebro)
Cn - copernicium
1996 r., S. Hoffman, V. Ninor, P. Hessburger; w 2010 r zatwierdzono
nazwę na cześć M. Kopernika

CYNKOWCE - WYSTĘPOWANIE
Cynk
ZnS
sfaleryt
Zn
4
Si
2
O
7
hemimorfit, wilemit
(Zn, Fe)Swurcyt
ZnCO
3
smitsonit
sfaleryt
smitsonit
hemimorfit
wurcyt

CYNKOWCE - WYSTĘPOWANIE
Kadm
Zawartość w skorupie ziemskiej 0,1 ppm (Zn – 65 ppm)
CdS – grenokit – towarzyszy złożom Zn
Rtęć
Zawartość w skorupie ziemskiej 0,08 ppm
HgS - cynober
grenokit
cynober

CYNKOWCE - OTRZYMYWANIE
Cynk
Czwarty, najbardziej rozpowszechniony metal po Fe, Al i Cu
Produkcja światowa 12 mln ton
70% produkcji cynku pochodzi z kopalni, a 30% z recyklingu
95% cynku produkuje się z rud siarczkowych, głównie sfalerytu
Najwięksi producenci cynku w 2010 r. (w
tonach)
Chiny
Peru
Australia
Indie
USA
Kanada
3 500 000
1 520 000
1 450 000
750 000
720 000
670 000

CYNKOWCE - OTRZYMYWANIE
Cynk
1.- wzbogacanie rud poprzez flotację pianową (uzyskuje się 50% koncentrat)
- prażenie – przekształcone ZnS w tlenek cynku
2ZnS + 3O
2
→ 2ZnO + 2SO
2
- pirometalurgiczna redukcja (za pomocą C lub CO) w temp. 950
o
C
i oddestylowanie cynku
2ZnO + C → 2Zn + CO
2
ZnO + CO → Zn + CO
2
2. Elektrolitycznie: - wymywanie (ługowanie) za pomocą H
2
SO
4
ZnO + H
2
SO
4
→ ZnSO
4
+ H
2
O
- elektroliza
2ZnSO
4
+ 2H
2
O → 2Zn + 2H
2
SO
4
+ O
2
cynk

CYNKOWCE - OTRZYMYWANIE
208
Pb +
70
Zn
278
Cn +
277
Cn +
1
n
82
30
112
0
112
Kadm
-Otrzymywany w analogiczny sposób jak cynk, a następnie rozdestylowywanie
od cynku
-Rugowanie z rudy poprzez dodatek cynku
Rtęć
-Flotacja pianowa i dalsze prażenie i destylacja par rtęci
HgS + O
2
→ Hg + SO
2
Copernicum
Najtrwalszym izotopem jest
285
Cn (29s)
kadm
rtęć

CYNKOWCE - ZASTOSOWANIE
Cynk
-galwanizacja blach stalowych – 55% (ochrona antykorozyjna)
-ochrona katodowa
-materiał anodowy w bateriach
-Mosiądze i brązy 16%
mosiądze – 3-45% Zn + Cu
brązy – 85-88% Zn; 4-10% Cu; 2-8% Al
-monety 1 centowe (USA)
-specjalne stopy 21%: (Zamak – Zn, Cu, Mg, Al; niskotopliwy i o niskiej lepkości)
(Prestal – Zn + Al; wytrzymałe jak stal, ale topliwe jak plastik)
tlenek cynkowo-kadmowy – stop półprzewodnikowy
-związki cynku – 8%: tlenek cynku ZnO – jako biały pigment; jako katalizator przy
produkcji gumy; jako półprzewodnik
chlorek cynku ZnCl
2
– do ochrony ogniowej, do ochrony lasów
dimetylocynk Zn(CH
3
)
2
– w syntezie organicznej
siarczek cynku ZnS – luminofor (np. do zegarków)
siarczan cynku – do produkcji farb i lakierów
pirytionian cynku – szampony przeciwłupieżowe
ochrona katodowa
moneta 1 centowa z cynku
pokryta miedzią

CYNKOWCE - ZASTOSOWANIE
Kadm
(jest toksyczny)
-Akumulatory Cd/Ni – ogniwa alkaliczne – 86%
-Powłoki ochronne – 6% - pokrycia stali, które dodatkowo są chromowane
-Jako bariera kontrolna neutronów w rozszczepieniu jądrowym
-Związki:
tlenek kadmu – CdO – produkcja ekranów TV
siarczek kadmu – CdS – do fotoprzewodzących powłok w fotokopiarkach
jako pigment
selenek kadmu – CdSe – czerwony pigment
telurek kadmu – CdTe – ogniwa słoneczne
-Lasery helowo-kadmowe – w mikroskopach fluorescencyjnych
CdS
akumulatory Cd/Ni

CYNKOWCE - ZASTOSOWANIE
Rtęć
-produkcja chemikaliów
* proces Castnera-Kellera – sód/chlor i NaOH
* katalizator przy produkcji aldehydu octowego i chlorku winylu
* oksyrtęciowanie HgCl
2
-medycyna
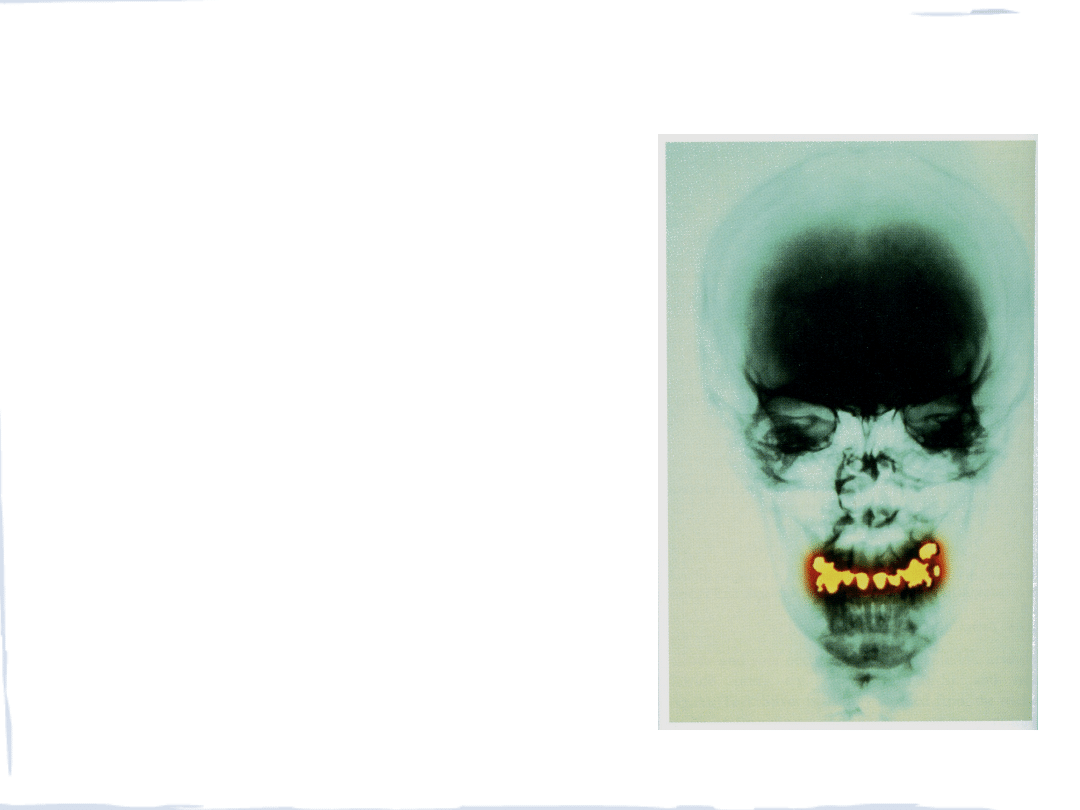
* wypełnienia dentystyczne
* konserwowanie szczepionek
* środek antyseptyczny – Merbromin
* termometry
* leki dermatologiczne (dawniej w chorobach wenerycznych)
-analityka
* elektrody kalomelowe – w elektrochemii
* monometry próżniowe
-urządzenia elektryczne i elektroniczne
* lampy rtęciowe
* lampy fluorescencyjne
* przełączniki rtęciowe
termometr rtęciowy
plomby amalgamatowe
lampa rtęciowa

Właściwości
• reaktywność cynkowców maleje
Zn
Cd
Hg
•
Hg
rozpuszcza się w kwasach utleniających
•
Zn
i
Cd
reagują z rozcieńczonymi kwasami z wydzieleniem H
2
•
Zn
rozpuszcza się w alkaliach – cynkany
•
Zn
i
Cd
– metale elektrododatnie, a
Hg
– metal szlachetny
• ZnCl
2
i CdCl
2
są jonowe, a HgCl
2
– kowalencyjny
• liczby koordynacyjne dla
Zn
i
Cd
4, 5 i 6, a dla
Hg
– 2
•
cynk
odgrywa rolę w procesach biologicznych, a
Cd
i
Hg
silnie trujące
CYNKOWCE Zn, Cd, Hg
(n-1)d
10
ns
2

Właściwości
• związki na +II stopniu utlenienia, dla
rtęci
są także na +I (dimery
[Hg-Hg]
+2
)
• energie jonizacji są wyższe niż dla berylowców (mniejsze atomy i zapełnione
orbitale d), ale wysoka energia solwatacji więc
cynk
owce tworzą jony M
+2
• rtęć
wykazuje tendencję do tworzenia związków kowalencyjnych
• niepodobne do metali przejściowych (zapełnione orbitale d)
- nie wykazują zmiennej wartościowości
- nie dają widm d-d (związki w większości białe)
- są miękkie (
rtęć
, jedyny metal ciekły)
- niskie temperatury topnienia i wrzenia
- są bardziej reaktywne od miedziowców
- minimalne podobieństwo do berylowców, ale szlachetniejsze są
cynk
owce
-
Zn
i
Cd
są bardzo podobne i różnią się od
Hg
(w przeciwieństwie do ogólnej
tendencji TM)
CYNKOWCE Zn, Cd, Hg
(n-1)d
10
ns
2

DLACZEGO RTĘĆ JEST CIEKŁA?
- temperatury krzepnięcia Zn, Cd i Hg wynoszą odpowiednio 419,5
o
C; 321,1
o
C oraz -38,8
o
C
- cynk i kadm ma całkowicie wypełnione orbitale s i d, a rtęć także f
- tworzenie wiązań metalicznych i krzepnięcie metalu zależą od stopnia zapełnienia orbitali
- w większości metali część elektronów tworzy gaz, zdelokalizowanych elektronów
- w atomach rtęci elektrony na powłoce f otaczają jądro (silnie ekranowane) i trudniej
powstaje wiązanie metaliczne (rtęć 16 razy słabiej przewodzi prąd niż cynk i 13 razy
słabiej niż Cd oraz 60 razy słabiej niż Ag)
AMALGAMATY RTĘCI
• Cd/Hg
jest składnikiem ogniwa Westona
• Na/Hg
łatwe źródło Na jako czynnik
redukujący
• Hg (50%)/Ag (35%)/Sn (13%)/Cu (12%)
wypełnienie w dentystyce
ZWIĄZKI CYNKOWCÓW
Tlenki
ZnO amfoteryczny, CdO i HgO zasadowe
ZnO i CdO sublimują (kowalencyjne)
HgO w wyniku ogrzewania (500
o
C) rozkłada się
w niskich temp. białe, a w wyższych barwne (defekty sieci krystalicznej)
Halogenki
sole
cynku
są uwodnione, a halogenki higroskopijne
fluorki MF
2
są białymi substancjami stałymi o silniejszym charakterze jonowym i lepszej
rozpuszczalności w wodzie (w porównaniu do innych halogenków)

ZWIĄZKI RTĘCI (+I)
Halogenki
[Hg
2
]F
2
ulega hydrolizie [Hg
2
]F
2
+ H
2
O
2HF + [Hg
2
](OH)
2
pozostałe halogenki nierozpuszczalne w wodzie
[Hg
2
](NO
3
)
2
x
2H
2
O i [Hg
2
](ClO
4
)
2
x
4H
2
O – rozpuszczalne w wodzie
brak wodorotlenków i siarczków
Hg(+I)
- dysproporcjonacja i wytrącanie
Hg(+II)
Otrzymywanie
HgCl
2
+ Hg
[Hg
2
]Cl
2
wykrywanie: reakcja z NH
4
OH – czarny osad
jony
Hg(+I)
tworzą niewiele kompleksów (duży rozmiar jonu i dysproporcjonacja)
jon
rtęci(I)
ma strukturę
[Hg-Hg]
+2

ZWIĄZKI CYNKOWCÓW
Kompleksy
łatwo tworzą kompleksy z amoniakiem, aminami, jonami halogenkowymi i CN
-
kompleksy Hg(II) są znacznie trwalsze i najczęściej LK=2, np. [Hg(NH
3
)
2
]Cl
2
nietypowy K
2
[HgI
4
] – odczynnik Nesslera do oznaczania amoniaku
dla Zn i Cd LK=4 [Zn(py)
2
Cl
2
], [Cd(py)
2
Cl
2
]
LK=5 [CdCl
5
]
-3
LK=6 [M(H
2
O)
6
]
+2
, [M(NH
3
)
6
]
+2
, itp

ZWIĄZKI METALOORGANICZNE
Związki R
2
Zn i R
2
Cd można otrzymać stosując odczynniki Grignarda,
litoorganiczne lub rtęcioorganiczne
R
2
Zn i R
2
Cd są mniej reaktywne od związku Grignarda – alkilowanie selektywne
Związki R
2
Hg i RHgX są znacznie odporniejsze na działanie wody i powietrza niż
związki cynku;
stosuje się je do otrzymywania związków metaloorganicznych litowców i
berylowców;
są silnie toksyczne – fungicydy i pestycydy

ZWIĄZKI CYNKOWCÓW
CdCl
2
+ 2RMgCl
CdR
2
+ 2MgCl
2
ZnCl
2
+ 2RLi
ZnR
2
+ 2LiCl
Zn + HgR
2
ZnR
2
+ Hg
CdR
2
+ CdI
2
2RCdI
R
2
Zn + EtOH
RZnOEt + RH
EtI + Zn
N
2
EtZnI
atmosf era oboj ęt na
Et
2
Zn + ZnI
2
Zn Zn
X
X
R
R

ZWIĄZKI CYNKOWCÓW
HgCl
2
+ RMgBr
RHgCl +½MgCl
2
+ ½MgBr
2
RHgCl + RMgBr
R
2
Hg + ½MgCl
2
+ ½MgBr
2
HgX
2
+ RH
RHgX + HX
C
6
H
6
+ (CH
3
COO)
2
Hg
C
6
H
5
x
HgOOCCH
3
octan fenylortęci
R
2
Hg + 2Na
2RNa + Hg
R
2
Cd + 2CH
3
COOCl
2
+ CdCl
2
CO
R
CH
3
H gCl
2
+
C=C
C
C H gCl
Cl

BIOLOGICZNE ZNACZENIE CYNKOWCÓW
Zn
bardzo ważny i niezbędny mikroelement
Cd
bardzo silnie toksyczny pierwiastek; 10 razy
silniejszy niż As
Hg
bardzo silnie toksyczny pierwiastek

TOKSYCZNOŚĆ KADMU
Źródła narażenia na kadm
- pożywienie
(10-20 μg/dobę)
- woda < 1 μg/l
- papierosy
1 papieros = 1 μg Cd (10% dostaje się do płuc podczas palenia)
Główne źródła narażenia
- żywność:
mięso, ryby, owoce
5-15 μg/kg
zboża, rośliny korzenne
> 25 μg/kg
podroby
~ 100 μg/kg
skorupiaki
~ 100 μg/kg
- narażenie zawodowe:
- produkcja chlorku winylu
- produkcja barwników do tworzyw sztucznych
- produkcja stopów metali
- produkcja akumulatorów Ni/Cd
- produkcja powłok antykorozyjnych
- narażenie środowiskowe

TOKSYCZNOŚĆ RTĘCI
Główne źródła narażenia na rtęć
- narażenie środowiskowe : elektrownie węglowe
spalanie odpadów (głównie medycznych)
odpady przy produkcji materiałów wybuchowych,
farb
okrętowych, lamp rtęciowych
- żywność:
woda (dimetylortęć)
ryby (halibut, makrela, szczupak, okoń), o niskiej zawartości (sardynka,
łosoś dziki, tilapia)
- wypełnienie zębów:
plomby amalgamatowe (dorośli, którzy mają 4 wypełnienia są
narażeni na zatrucie)
- szczepionki:
rtęć jako konserwator – szczepionki przeciw grypie zawierają 25 μg Hg,
a dopuszczalna dawka to 0,1 μg/kg ciała
- konserwanty do ziarna

CHEMIA BIONIEORGANICZNA
- ok. 25 pierwiastków ma kluczowe znaczenie dla życia; 11 z nich to pierwiastki główne,
a pozostałe to śladowe
- pierwiastki główne wchodzą w skład cząsteczek biologicznych (C, N, O, P, S), jonów
– w roztworach lub w kompleksach z biocząsteczkami (Na, Mg, Ca, Cl) – i ciał stałych,
takich, jak , np. kości (Ca(PO
4
)
2
)
- niezbędne do życia pierwiastki bloku d (np. Fe, Zn, Cu) są składnikami metaloenzymów,
zaangażowanych w transport i metabolizm O
2
oraz pełniących szereg funkcji
katalitycznych w procesach redox i reakcjach kwas - zasada
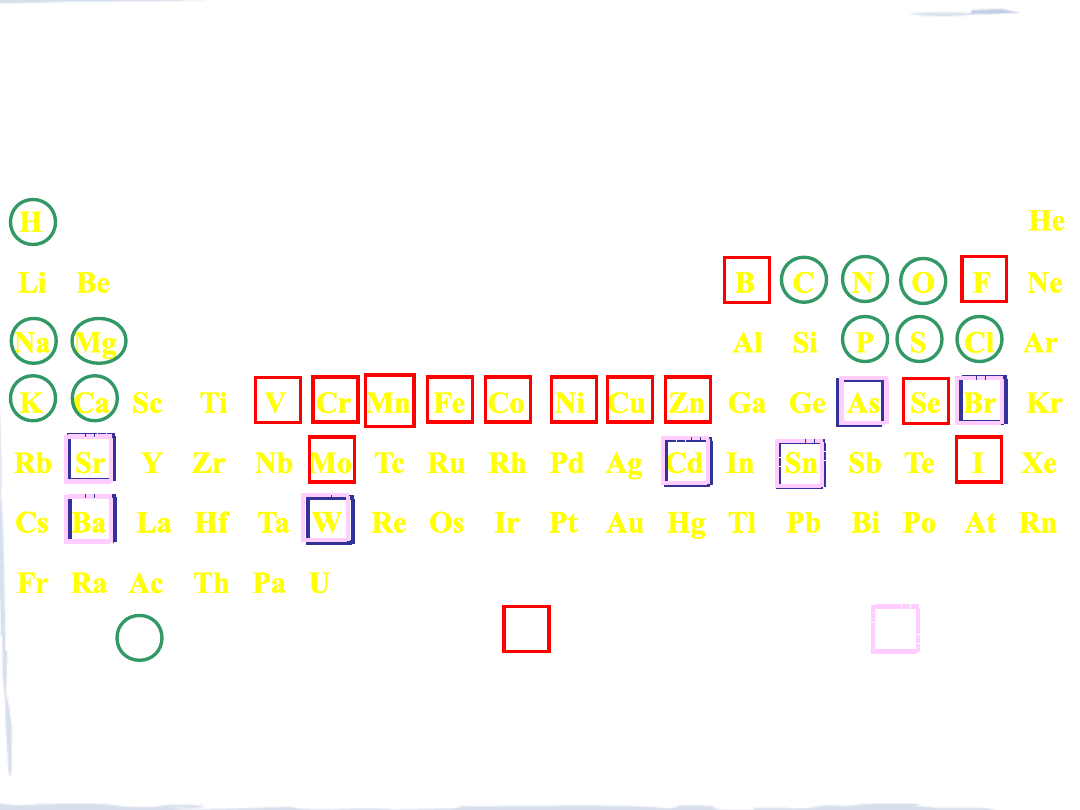
makroelementy
pierwiastki śladowe
uważane za niezbędne dla
bakterii, roślin i zwierząt
pierwiastki śladowe
prawdopodobnie niezbędne
dla niektórych organizmów
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
PIERWIASTKI NIEZBĘDNE DO ŻYCIA
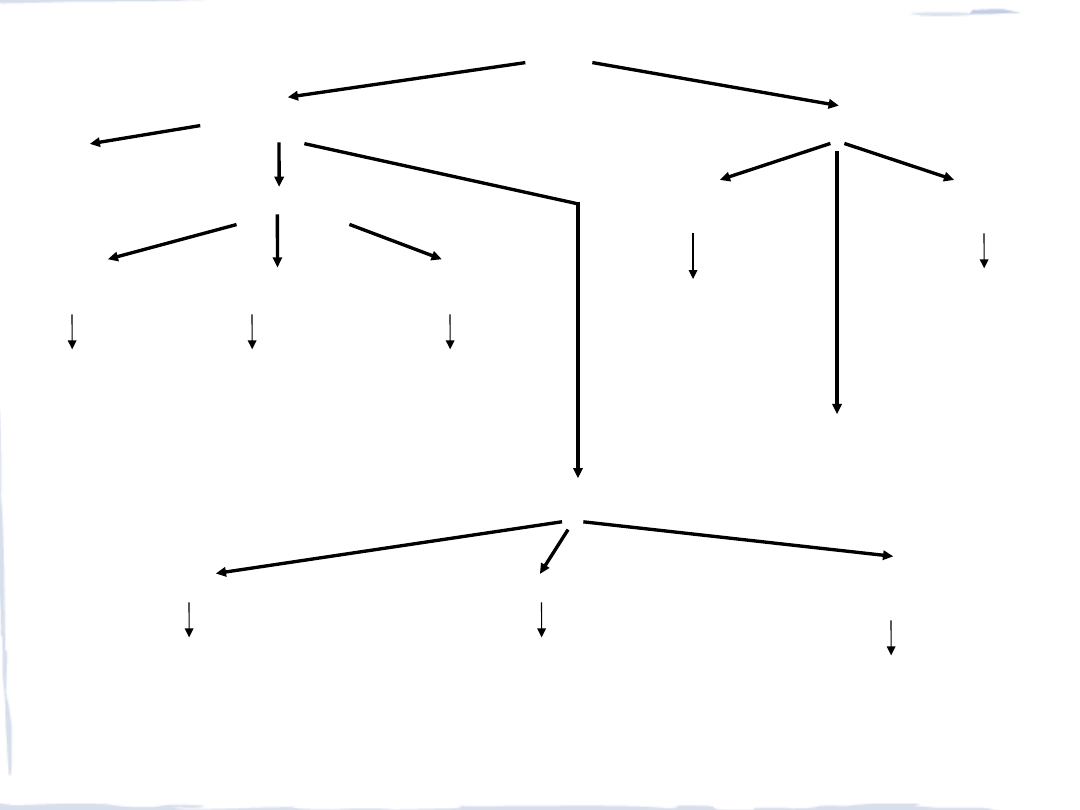
- Cytochromy, Fe
- Białka żelazo-siarkowe
,
- Niebieskie miedzio-
proteiny, Cu
- Chlorofil, Mg
- Fotosystem II, Mn
Przenośniki
elektronów
METALOBIOCZĄSTECZKI
Białka
Inne ligandy
Transport i magazynowanie
Gospodarka
metalami
Gospodarka
tlenem
- Ferrytyna, Fe
- Transferyna, Fe
- Ceruloplazmina, Cu
- Mioglobina, Fe
- Hemoglobina, Fe
- Hemoerytryna, Fe
- Hemocyjanina, Cu
Transport
i magazynowanie
metalu
Fotoredoks
Enzymy
Hydrolazy
Oksydoreduktazy
Izomerazy i
syntetazy
- Fosfatazy, Mg, Zn, Cu
- Aminopeptydazy, Mg, Zn,
- Karboksypeptydazy, Zn
- Oksydazy, Fe, Cu
- Reduktazy, Fe, Cu, Mo
- Nitrogenazy, Fe, Mo, V
- Hydroksylazy, Fe, Cu, Mo
- Hydrogenazy, Fe, Ni
- Dysmutaza ponadtlenkowa Fe, Cu, Mn
- Witamina B
12
, koenzym, Co
- Syderofory, Fe
-
Szkielet Ca, Si
- Na, K, transfer
Inne funkcje
Inne funkcje
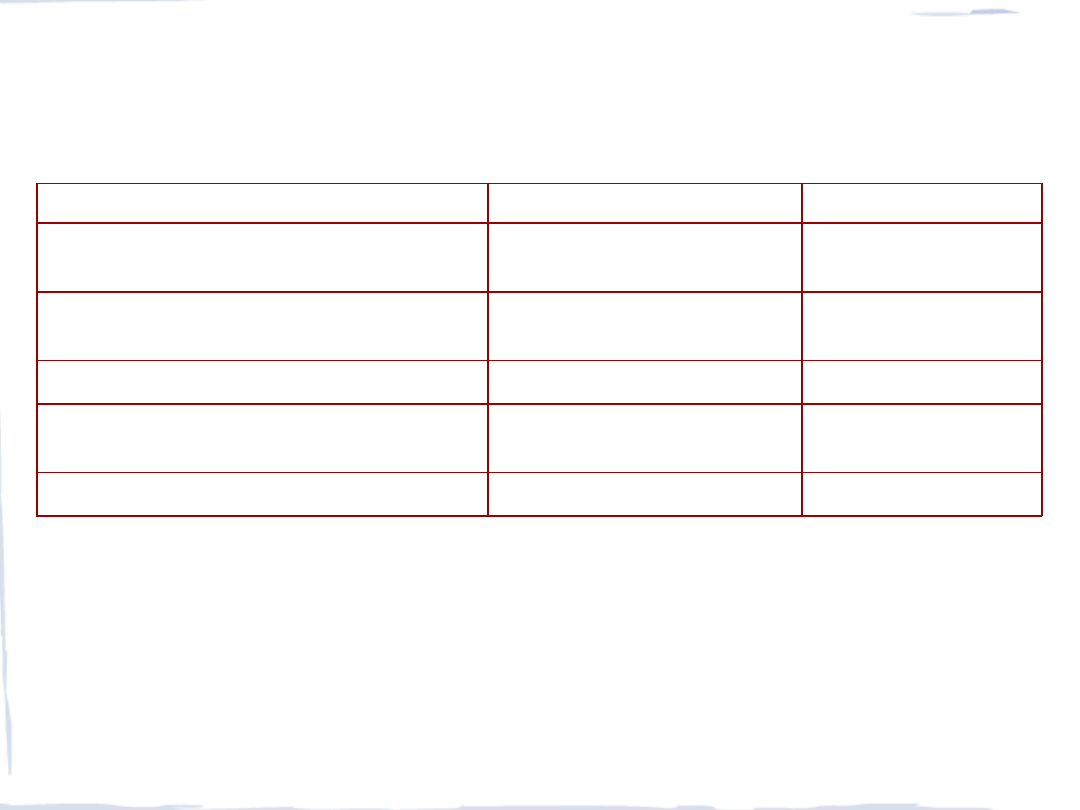
NIEZBĘDNE DO ŻYCIA I TOKSYCZNE PIERWIASTKI
Postać chemiczna i funkcja
Pierwiastki główne
Pierwiastki śladowe
kowalencyjnie związane atomy w
biocząsteczkach i polimerach
H, C, N, O, P, S
B
1
, As
1
, Si
1
, Se, I
jony w roztworze wodnym, czasami
skomplekoswane z biocząsteczkami
H
+
, Na
+
, Mg
2+
, Cl
-
, K
+
, Ca
2+
-
składniki nieorganicznych ciał stałych
C, O, P, Ca
F, Si, Fe
składniki metaloprotein lub innych
wyspecjalizowanych cząsteczek
-
V, Cr, Mn, Fe, Co,
Ni, Cu, Zn, Mo, W1
metale o działaniu toksycznym
-
Be, Cd, Hg, Tl, Pb

BIOLOGICZNE ZNACZENIE PIERWIASTKÓW
PRZEJŚCIOWYCH
Pierwiastek
Znaczenie biologiczne
Niektóre skutki niedoboru
Fe
Składnik enzymów
oddechowych (cytochromów, peroksydaz,
katalazy). Składnik hemoglobiny, mioglobiny oraz
koenzymów uczestniczących w tworzeniu ATP.
Zaburzenia oddychania
komórkowego. Niedokrwistość (anemia), słaby wzrost,
ospałość, osłabiona odporność na infekcje, bóle głowy,
zaburzenia wchłaniania witamin z grupy B, arytmia serca,
upośledzenie funkcji poznawczych.
Zn
Uczestniczy w różnych etapach syntezy białek,
składnik enzymów oddechowych. Składnik
wielu enzymów odpowiedzialnych m.in.
za metabolizm białek (składnik wielu
proteinaz), węglowodanów i tłuszczów.
Składnik insuliny (odgrywa także ważną rolę w jej
magazynowaniu w trzustce), reguluje
stężenie witaminy A. Jest wykorzystywany w
formowaniu tkanki kostnej, jest potrzebny
do wzrostu i naprawy tkanek (przyspiesza gojenie
ran). Reguluje równowagę kwasowo-zasadową
organizmu (składnik anhydrazy węglanowej). Jest
niezbędny do prawidłowego
funkcjonowania układu odpornościowego.
Odpowiada za ostrość smaku i słuchu.
Niedokrwistość (anemia), powolne gojenie ran,
choroby skóry, włosów (np. łysienie, łamliwość włosów)
i paznokci (łamliwość paznokci). Nowotwory, zanik mięśni,
zahamowanie wzrostu i rozwoju, opóźnienie dojrzałości
płciowej (zaburzenia rozwoju i
czynności gonad), niepłodność u samców, upośledzenie
funkcji poznawczych.
V
Aktywator enzymów uczestniczących w
syntezie ATP, wpływa na działanie pompy sodowo-
potasowej, uczestniczy w metabolizmie glukozy,
pobudza produkcję glutationu.
Osłabiony wzrost
Co
Składnik witaminy B
12
(kobalaminy), biorącej
udział w procesie tworzenia erytrocytów (jest
niezbędna w biosyntezie hemoglobiny). Aktywator
niektórych enzymów
Niedokrwistość (anemia), zaburzenia krzepnięcia krwi,
zaburzenia syntezy białek i kwasów nukleinowych

Pierwiastek
Znaczenie biologiczne
Niektóre skutki niedoboru
Cu
Wchodzi w skład enzymów
oddechowych (np. oksydaza
cytochromowa i oksydaza askorbinowa). Wraz
z żelazem uczestniczy w syntezie hemu (składnik
hemoglobiny) i melaniny. Występuje
w ceruloplazminie (białko osocza krwi). U
niektórych bezkręgowców (np. mięczaków) jest
składnikiem błękitnej hemocyjaniny (odpowiednik
hemoglobiny).
Zaburzenia oddychania
komórkowego. Niedokrwistość (anemia), brak apetytu,
ospałość, biegunka, zaburzenia ruchu (niedowłady).
Niedobór występuje rzadko.
Mn
Aktywator i składnik grup
prostetycznych niektórych enzymów, np. enzymów
oddechowych
(dehydrogenaza
izocytrynianowa, karboksylaza pirogronianowa) .
Aktywator arginazy(enzym cyklu mocznikowego).
Jest konieczny do prawidłowego
rozwoju tkanek (zwłaszcza kostnej) oraz do
funkcjonowania ośrodkowego układu nerwowego.
Współdziała z witaminami B (B
1
,B
6
)
oraz cytochromami, zwiększa asymilację miedzi.
Jest potrzebny do rozmnażania i laktacji
Zaburzenia oddychania
komórkowego. Osłabienie wzrostu i płodności,
wychudzenie, deformacje odnóży, osłabienie tkanki
łącznej.
Cr
Wzmaga działanie insuliny, składnik czynnika
tolerancji glukozy. Obniża poziom
cholesterolu we krwi
Wzrost stężenia cholesterolu
we krwi, niewłaściwa asymilacja glukozy.
Co
Niezbędny do prawidłowego działania
wielu enzymów (np. oksydazy aldehydowej,
dehydrogenazy ksantynowej).
Osłabiony wzrost
Ni
Składnik ureazy – enzymu rozkładającego mocznik
na amoniak
i dwutlenek węgla
Osłabiony metabolizm azotu i
żelaza.
BIOLOGICZNE ZNACZENIE PIERWIASTKÓW
PRZEJŚCIOWYCH, CD

ZAPOTRZEBOWANIE I WYSTĘPOWANIE
ŻELAZO
Dzienne zapotrzebowanie na ten pierwiastek zależy od płci i wieku i leży w przedziale 8-18 mg
.
Najlepszym źródłem żelaza są:
chuda wołowina, mięso indyka, wątróbka, sardynki z puszki, płatki
śniadaniowe, gotowana fasola, suszone figi, ziarno sezamu, świeże zielone warzywa
.
Przyswajalność żelaza z jedzenia można zwiększyć poprzez jednoczesne spożywanie witaminy C z
owoców cytrusowych, jagód, kiwi, papryki, ziemniaków. Do codziennych posiłków warto też
wprowadzić natkę pietruszki, koperek czy dziką różę.
Żeby wzrosło przyswajanie żelaza, potrzeba minimum 500 mg witaminy C.
CYNK
Wchodzi w skład aż 59 proc. enzymów, jest niezbędny do syntezy białek oraz kwasów
nukleinowych. Przyspiesza gojenie się ran. Niedobór powoduje zaburzenia smaku i węchu. Ma
istotne znaczenie przy profilaktyce przerostu gruczołu krokowego.
Dziennie człowiek potrzebuje około 12 mg cynku
. Znaczącym źródłem cynku są
mięso zwierząt,
ryby, ostrygi, jaja, drożdże piwne, warzywa i ziarna zbóż
.
CHROM
Wpływa – poprzez pobudzanie aktywności komórek trzustki – na produkcję insuliny, a więc
aktywnie uczestniczy w przemianach węglowodanów i stąd jego znaczenie w profilaktyce i leczeniu
cukrzycy.
Dzienne zapotrzebowanie na ten pierwiastek wynosi dla dorosłych (w zależności od
źródeł) 50 do 200 μg
. Pokarmy pozwalające uzupełnić niedobory chromu to
drożdże piwne,
brokuły, sok winogronowy, mięso indycze i owoce morza
.

KOBALT
Jest potrzebny do tworzenia witaminy B
12
. W przyrodzie występuje dość powszechnie,
rzadko więc mamy do czynienia z przypadkami jego niedoboru.
Najwięcej kobaltu zawierają
wątróbka, cynaderki i buraki
.
MANGAN
Wchodzi w skład wielu enzymów, inne zaś uaktywnia. Wpływa na przemiany tłuszczów i
cholesterolu oraz hormonów płciowych, reguluje pracę układu nerwowego.
Dzienne zapotrzebowanie mieści się między 2,5 a 5 mg
.
Mangan znajduje się w
ziarnach zbóż, orzechach, warzywach liściastych oraz w
herbacie
.
MIEDŹ
Jest niezbędna do wytwarzania krwinek czerwonych, bierze udział w tworzeniu kości.
Dzienne zapotrzebowanie na ten pierwiastek to 1,5 do 3 mg
.
Powszechnie występuje w większości produktów spożywczych, najwięcej miedzi
zawierają
warzywa i owoce
ZAPOTRZEBOWANIE I WYSTĘPOWANIE

Mnóstwa prezentów pod zieloną choinką,
pyszności na wigilijnym stole,
wspaniałej rodzinnej atmosfery,
wypełnionej melodią staropolskich kolęd,
a także wystrzałowego, bąbelkowego Sylwestra
i spełnienia marzeń w Nowym Roku 2014
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
CN II 6 2013
CN II 4 2013
CN II 10 2013
francuski pr ii 2013
hiszpanski pr ii 2013
Prawo UE Demokratyczne podstawy (II 2013)
Enzymy II 2013
pytania treningowe, pytania treningowe wyklad II 2013, I zjazd - termodynamika
Prawo UE Wprowadzenie (II 2013)
Prawo UE Wartości, cele i zasady (II 2013)
TI II 2013 14 ramowy plan zajęć Informatyka w Historii sztuki
Giełda stoma Głowa II 2013
III rok harmonogram strona wydział lekarski 2013 2014 II i III Kopia
3 NOWY Aminokwasy II 2012 2013(1)
list intencyjny1, Prywatne, Technik administracji, II semestr 2013-zima, Technika Pracy Biurowej, do
Lepkość-sciaga, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
geo 1-2, Szkoła, Technikum Elektroniczne, szkoła II TA 2012;2013, Geografia
więcej podobnych podstron