
CHEMIA NIEORGANICZNA
CZ. II CHEMIA PIERWIASTKÓW
WYKŁAD 4

ZWIĄZKI TYTANU
Azotek tytanu TiN
nanoszony na narzędzia tnące, formujące i ślizgowe – bardzo
wysoka twardość
Tetrachlorek tytanu TiCl
4
-
do produkcji TiO
2
-
jako czynnik redukujący
-
do produkcji estrów – świece dymne
Węglik tytanu TiC
wysoka twardość, niski współczynnik tarcia
wysoka temperatura topnienia, wysoka odporność korozyjna
i cieplna – w przemyśle narzędziowym, kosmicznym i energetyce
jądrowej
Tytaniany
wysoka przenikalność elektryczna
BaTiO
3
– właściwości piezoelektryczne i ferroelektryczne –
w urządzeniach ultradźwiękowych, mikrofonach, zapalarkach
SrTiO
3
– wysoki współczynnik załamania światła – do produkcji
soczewek, pryzmatów i biżuterii
Na
2
TiO
3
– masa do pokrywania prętów spawalniczych
TiN

ZWIĄZKI TYTANU NA +III STOPNIU UTLENIENIA
Związki Ti
+3
z alkaliami tworzą nierozpuszczalny, purpurowy Ti
2
O
3
x
(H
2
O)
n
Halogenki TiX
3
powstają w wyniku redukcji TiX
4
TiCl
4
TiCl
3
[Ti(H
2
O)
6
]
+3
Cl
3
-
TiCl
4
Ti
[Ti(H
2
O)
5
Cl]
+2
Cl
2
-
TiCl
2
650
o
C
H
2
O
f i ol et owy
z i el ony
f i ol et owy
H Cl
gorący
dy sproporcjonuj e
p o og rz ani u

ZWIĄZKI METALOORGANICZNE
Katalizator Zieglera-Natty (TiCl
4
+ AlEt
3
) – polimeryzacja etylenu
Polimeryzacja wolnorodnikowa
Polietylen o niskiej gęstości
(wysokociśnieniowy)
Miękki, rozbudowany łańcuch boczny
Produkcja T=190-210
o
C; p = 1 500 atm.
Polimeryzacja Zieglera-Natty
Polietylen o wysokiej gęstości
(niskociśnieniowy)
Twardy, proste łańcuchy nierozgałęzione
Produkcja T=25-93
o
C; p = do 100 atm.

GRUPA 5
WANADOWCE
V – wanad (Vanadis – Germańska bogini piękna i plodności
1801 r. – A. M. del Rio; 1831 r. – N. G. Sefström
Nb – niob (Niobe, corka Tantala – mitologia grecka)
1801 r. – Ch. Hatchett
Ta – tantal (Tantal, syn Zeusa –mitologia grecka)
1802 r. – A. Ekeberg
Db – dubn (dubnium)
1970 r. – G. Flerow (Instytut w Dubnej)

WANADOWCE V, Nb, Ta, Db (grupa 5)
(n-1)d
3
, ns
2
Pierwiastki stosunkowo rzadkie (nieparzyste liczby atomowe)
Wanad
towarzyszy rudom ołowiu PbCl
2
x
3Pb
3
(VO
4
)
2
Otrzymywanie
analogicznie jak dla tytanowców (metoda Krolla, ICI, van Arkela, elektroliza)
249
98
Cf +
15
N
260
105
Db + 4n

WANADOWCE V, Nb, Ta, Db (grupa 5)
(n-1)d
3
, ns
2
Zastosowanie
V
dodatek stopowy do stali, katalizator utlenienia naftalen-kwas ftalowy oraz toluen-
aldehyd benzoesowy
V
2
O
5
– katalizator utlenienia SO
2
-SO
3
stop żelazowanad (86% V, 12% C, 2% Fe) sprężyny, resory samochodowe, noże do
obrabiarek, stal wanadowa
Nb
dodatek stopowy do stali chromoniklowej
Ta
kondensatory w elektronice, implanty oraz wstawki do kości
narzędzia wykonane ze stali wanadowej

WANADOWCE V, Nb, Ta, Db
Wanad
owce są odporne na korozję, nie reagują z powietrzem, wodą i kwasami (za
wyjątkiem HF), rozpuszczają się w alkaliach
Zasadowe własności M
2
O
5
rosną w dół grupy
V
2
O
5
– amfoteryczny, z przewagą właściwości kwasowych
Nb
2
O
5
i Ta
2
O
5
– niereaktywne, o słabym charakterze kwasowym (niobany,
tantalany)
Barwa związków
dla związków
wanad
owców na stopniu utlenienia poniżej +5 - barwa – przejścia d-d
dla +5 – d
o
– bezbarwne, ale
V
2
O
5
– czerwony, ze względu na defekty sieci krystalicznej
NbCl
5
– żółty
NbBr
5
– pomarańczowy
ponieważ występuje przeniesienie ładunku (charge transfer)
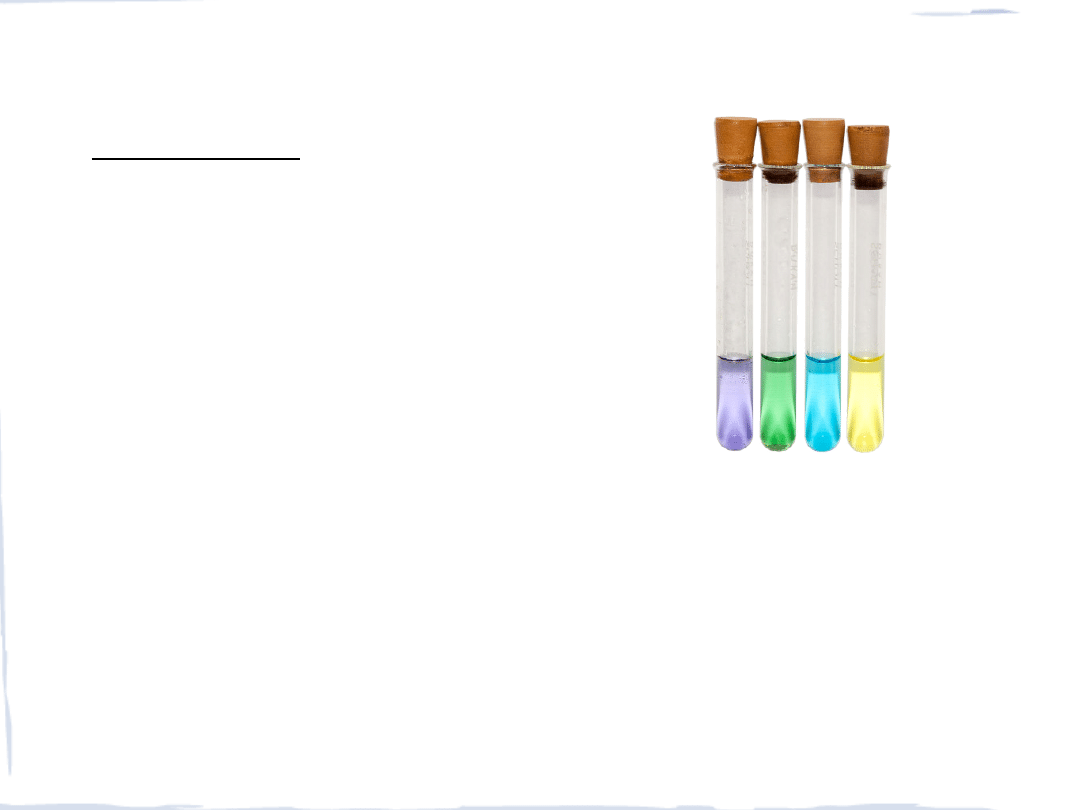
WANADOWCE V, Nb, Ta
Stopnie utlenienia
+II, +III – właściwości redukujące
+IV – trwałe połączenia
+V – właściwości utleniające
V
(-I), (0), (I), II,
III
,
IV
,
V
Nb
(-I), II, III,
IV
,
V
Ta
(-I), II, III,
IV
,
V
w reakcji z cynkiem
V
(+5)
V
(+2)
Nb
(+5)
Nb
(+3)
Ta
(+5)
nie reaguje
czyli w dół grupy wzrasta trwałość połączeń na najwyższym stopniu utlenienia
(przeciwnie do metali grup głównych)
Związki wanadu na różnych stopniach utlenienia,
odpowiednio: +2, +3, +4 i +5
ZWIĄZKI WANADOWCÓW Z AZOTEM, WĘGLEM I
WODOREM
MC – międzywęzłowe, ogniotrwałe i bardzo twarde
TaC – t.top. 3 800
o
C
MC
2
– jonowe, reagują z wodą
VC
2
+ H
2
O
C
2
H
2
+
wanad
any
w reakcji z wodorem tworzą niestechiometryczne wodorki
M + H
2
VH
0,71
NbH
0,86
TaH
0,76
2M + N
2
2MN
azotki
N bN
2M + 3C
MC + MC
2
N bC, TaC
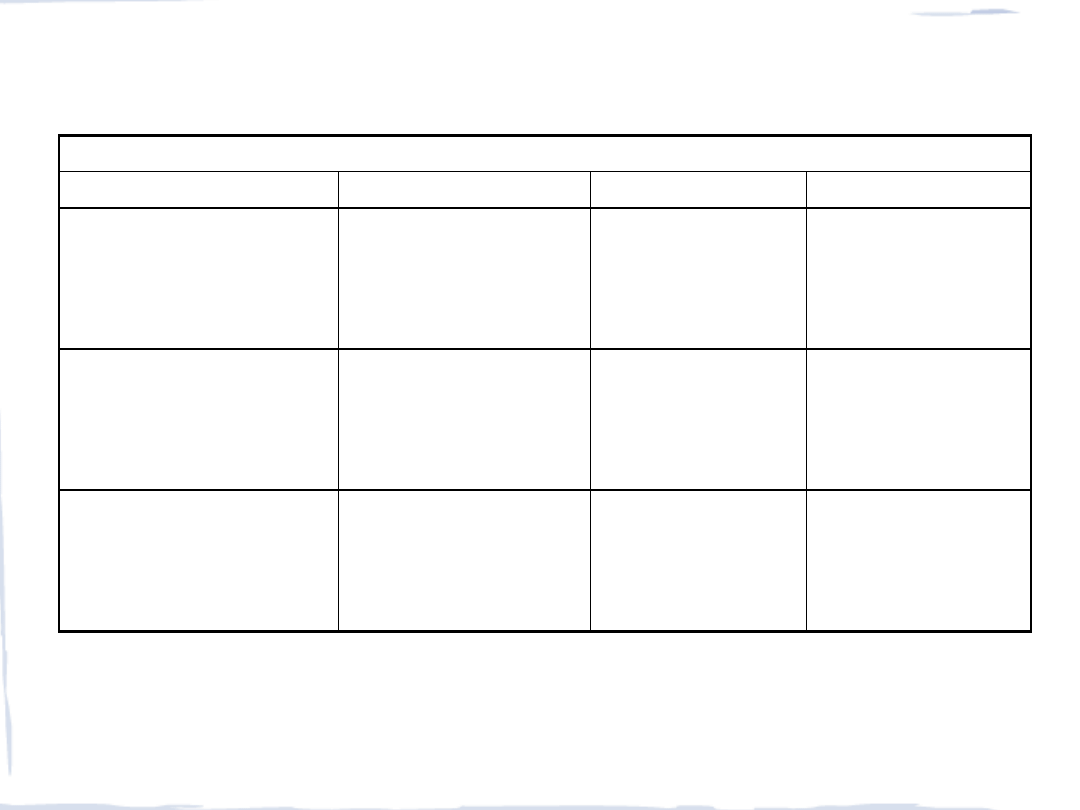
HALOGENKI
Stopień utlenienia
(+II)
(+III)
(+IV)
(+V)
VF
2
niebieski
VCl
2
jasnozielony
VBr
2
pomarańcz.-brązowy
VI
2
czerwono-fioletowy
VF
3
żółto-zielony
VCl
3
czerwono-fioletowy
VBr
3
brązowy
VI
3
ciemnobrązowy
VF
4
zielony
VCl
4
rdzawobrązowy
VBr
4
karmazynowy
-
VF
5
bezbarwny (ciecz)
-
-
-
-
-
-
-
(NbF
3
)* niebieski
NbCl
3
czarny
NbBr
3
brązowy
NbI
3
NbF
4
czarny
NbCl
4
fioletowy
NbBr
4
brązowy
NbI
4
zielony
NbF
5
biały
NbCl
5
żółty
NbBr
5
pomarańczowy
NbI
5
metaliczny
-
-
-
-
(TaF
3
)* niebieski
TaCl
3
czarny
TaBr
3
-
-
TaCl
4
czarny
TaBr
4
niebieski
TaI
4
TaF
5
biały
TaCl
5
biały
TaBr
5
żółty
TaI
5
czarny
Nb
i
Ta
tworzy głównie pięciohalogenki MX
5
, natomiast
wanad
tworzy różnorodne,
trwałe połączenia
ZWIĄZKI WANADOWCÓW Z HALOGENAMI
(+V)d
o
wanad
tworzy tylko VF
5
natomiast
Nb
i
Ta
tworzą halogenki z wszystkimi
fluorowcami
M
2
O
5
+ 5F
2
2MF
5
+ 2½O
2
2MCl
5
+ 5F
2
2MF
5
+ 5Cl
2
M=
Nb
,
Ta
MCl
5
+ 5HF
MF
5
+ 5HCl
w wyniku ogrzewania MX
5
w powietrzu – powstają tlenohalogenki MOX
3
, które
ulegają hydrolizie tworząc MO
5
MX
5
reagują z N
2
O
4
, tworząc azotany, np. NbO(NO
3
)
3
2V + 5F
2
2VF
5
2N b + 5Cl
2
2N bCl
5
2Ta + 5Cl
2
2TaCl
5
600
o
C
2VF
4
VF
5
+ VF
3
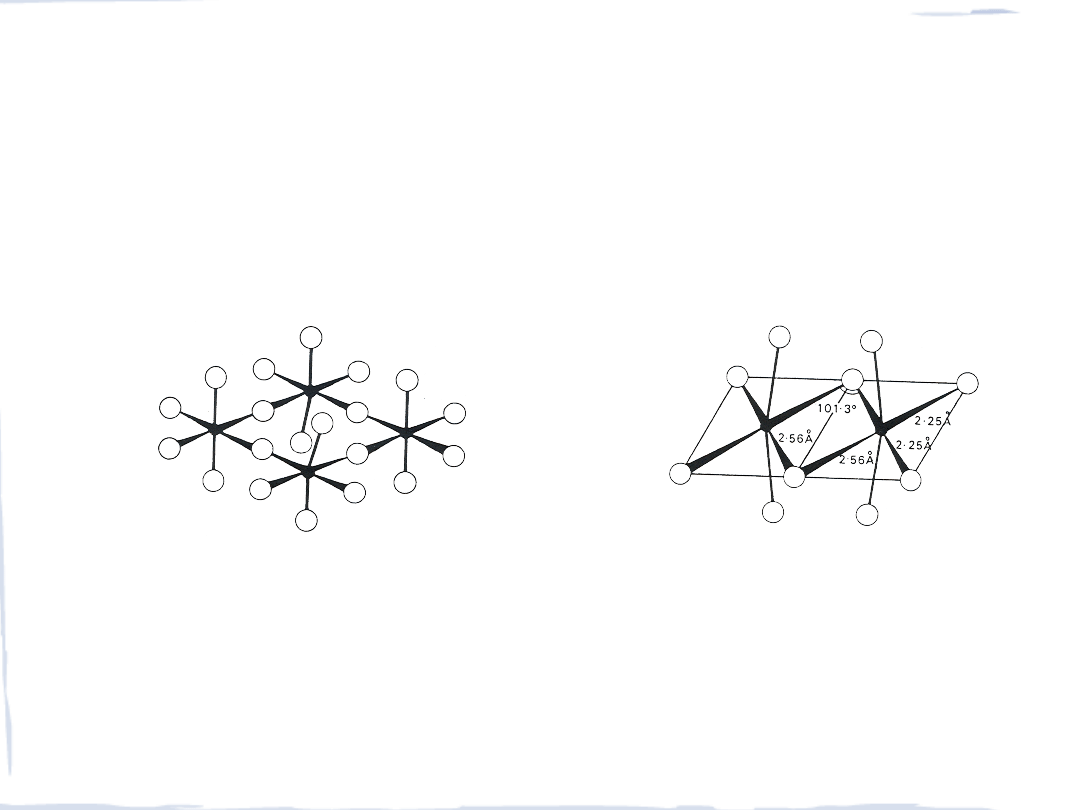
HALOGENKI MX
5
Halogenki mają różnorodne struktury, fluorki są zbudowane z oktaedrycznych jednostek
MF
6
, których dwa atomy fluoru są mostkami – dlugie lańcuchy oktaedrów (
VF
5
)
tetrameryczna struktura
NbF
5
i
TaF
5
dimeryczna struktura
NbCl
5
chlorki tworzą bipiramidę trygonalną,
która dimeryzuje

HALOGENKI
ulegają dysproporcjonowaniu
ulegają hydrolizie
VCl
4
+ H
2
O
VOCl
2
+ 2HCl
4Ta
IV
Cl
4
+ 5H
2
O
Ta
2
V
O
5
+ Ta
III
Cl
3
+ 10HCl
2VCl
4
2VCl
3
+ Cl
2
2VF
4
VF
5
+ VF
3
(+IV)d
1
znane są wszystkie halogenki, za wyjątkiem TaF
4
V + 2Cl
2
VCl
4
V + 4HF
VF
4
+ 2H
2
M=
Nb
,
Ta
red uk cj a
MX
5
MX
4
H
2,
Al , N b, T a
HALOGENKI
[V(H
2
O)
6
]
+2
et anol
N aOH
V(OH )
2
VSO
4
x
6
H
2
O
H
2
SO
4
(+III)d
2
znane są wszystkie halogenki, z wyjątkiem TaI
3
2V + 3Cl
2
2VCl
3
VCl
3
+ 3HF
VF
3
+ 3HCl
2VI
3
VI
2
+ VI
4
trójhalogenki
niobu
i
tantalu
są z reguły niestechiometryczne
(+II)d
3
znane są wszystkie halogenki
wanadu
oraz NbBr
2
i NbI
2
VF
3
+ Zn/HCl
VF
2
+ .....
[V(H
2
O)
6
]
+2
[V(H
2
O)
6
]
+3
w roztworach ulegają utlenieniu
znanych jest także kilka halogenków
Nb
i
Ta
o nietypowej stechiometrii, typu
klasteru
M=
Nb
,
Ta
N b
6
F
15,
Ta
6
Cl
15
N a, Al
M
6
Cl
14,
M
6
I
14
MX
5

TLENKI
wszystkie
wanad
owce reagują z tlenem, tworząc M
2
O
5
natomiast
wanad
tworzy
także VO
2
, V
2
O
3
i VO
(+V)d
o
V
2
O
5
– czerwony (defekty sieci krystalicznej)
VO
2
+
- żółty kation diokso
wanad
owy (V)
4M + 5O
2
2M
2
O
5
2N H
4
VO
3
+ H
2
SO
4
V
2
O
5
+ (N H
4
)
2
SO
4
+ H
2
O
2N H
4
VO
3
V
2
O
5
+ 2 N H
3
+ H
2
O
V
2
O
5
(amfoter)
VO
4
-3
(VO
2
)
2
SO
4
VOCl
3
VO
2
+ V
2
O
3
+ H
2
O
H
2
SO
4
N aOH
Cl
2
H
2

WANADANY I ZWIĄZKI WANADYLOWE
V
2
O
5
jest amfoteryczny, z przewagą właściwości zasadowych.
W wyniku rozpuszczenia w stężonym NaOH powstaje jon
wanad
anowy.
Dodając kwas i obniżając pH roztworu można uzyskać różne oksojony, aż ostatecznie
powstanie jon okso
wanad
owy VO
2
+
p H 12
[VO
4
]
-3
[VO
3
x
OH ]
-2
[V
2
O
6
x
OH ]
-3
[V
3
O
9
]
-3
*[V
5
O
14
]
-3
*V
2
O
5
x
(H
2
O)
n
[V
10
O
28
]
-6
[VO
2
]
+
bez barw ny
bez barw ny
bez barw ny
p omarañcz owy
cz erw ony
brąz owy osad
j asnożółty
p H 10
p H 9
p H 7
p H 6,5
p H 2,2
p H < 1
*wytrącony zostaje osad o takich wzorach

CHROMOWCE – GRUPA 6
Cr – chrom
(grec. kolor) – 1797 r. – L. N. Vauquelin;
crocoit jako pigment 1761 r.
Mo – molibden
(grec. ołów) – 1778 r. – C. W. Scheele
W
– wolfram
(tungsten – szwedz. ciężki kamień) – (1781 r. C.W.
Scheele –kwas wolframowy, 1783 r. Jose i Fausto Elhuyar –
izolacja)
Sg – seaborg
1974 r. (A. Ghiorso
263
Sg; G. N. Flerow
259
Sg)

WYSTĘPOWANIE I OTRZYMYWANIE
CHROM - Cr
FeCr
2
O
4
chromit
przy produkcji stali nierdzewnej, do stali wprowadza się jako żelazochrom
2FeCr
2
O
4
+ 4C
Fe + 2Cr + 4CO
f errochrom
w czystej postaci
Na
2
[Cr
2
O
7
] + 2C
Cr
2
O
3
+ Na
2
CO
3
+ CO
Cr
2
O
3
+ 2Al
2Cr + Al
2
O
3
2FeCr
2
III
O
4
+ 8N aOH + 3,5O
2
4N a
2
[Cr
VI
O
4
] + Fe
2
O
3
+ 4H
2
O
1100
o
C
chromit – FeCr
2
O
4
crocoit – PbCrO
4

WYSTĘPOWANIE I OTRZYMYWANIE
MOLIBDEN – Mo
MoS
2
molibdenit
w czystej postaci
molibden
otrzymuje się przez red. H
2
MoS
2
MoO
3
MoO
3
+ Fe
Fe + Mo
O
2,
N
2
f erromoli bd en
molibdenit

WYSTĘPOWANIE I OTRZYMYWANIE
WOLFRAM – W
CaWO
4
FeWO
4
x
MnWO
4
wolframit
stapianie wolframitu z Na
2
CO
3
, wymywanie wolframianu sodu i przekształcenie
w tlenek przez prażenie
red. tlenku wolframu wodorem
wolfram
wolframit

OTRZYMYWANIE
Sg -
znanych jest obecnie 12 izotopów
najtrwalszy izotop
269
Sg (T
1/2
= 2,1 min)
249
Cf +
18
O →
263
Sg +
4
He (T
½
= 0,9 s)
Seaborg

WŁAŚCIWOŚCI OGÓLNE
Chrom
owce są twarde, nielotne, mają wysokie temperatury topnienia
Chrom
ulega pasywacji – nie roztwarza się w
HNO
3
i wodzie królewskiej, a rozpuszcza się w HCl i H
2
SO
4
Mo
i
W
rozpuszczają się w mieszaninie HNO
3
/HF, a także w stopionym Na
2
O
2
i
KNO
3
/NaOH
Chrom
owce w normalnej temperaturze nie reagują z tlenem, a w podwyższonej
Cr
2
O
3
, MoO
3
, WO
3
Z fluorowcami po ogrzaniu – CrCl
3
, MoCl
6
, WCl
6

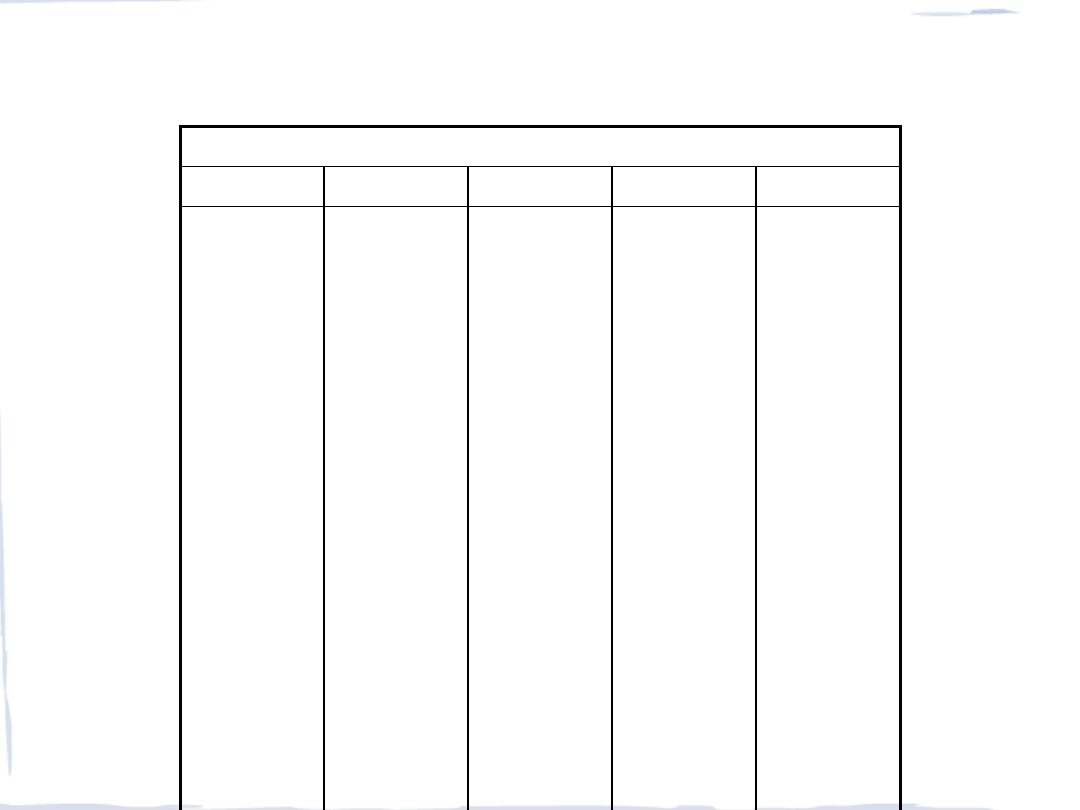
CHROMOWCE (GRUPA 6)
pierwiastek konfiguracja
stopnie
utlenienia
temp. top.
[
o
C]
zaw.
w skorupie [ppm]
promień
kowalencyjny [Å]
Cr
3d
5
4s
1
-II, -I, 0, (I),
II
,
III
, IV, (V),
VI
1 875
200
1.17
Mo
4d
5
5s
1
-II, 0, I, II, III,
IV, V,
VI
2 610
15
1.29
W
4f
14
5d
4
6s
2
-II, 0, I, II, III,
IV, V,
VI
3 410
70
1.30
Związki
chromu
(+II) działają redukująco,
Cr
(+III) najtrwalszy,
Cr
(+IV) silny
utleniacz
Mo
i
W
na stopniu (+III) działają silnie redukująco, a trwałe na (+VI)

ZASTOSOWANIE
Chrom –
produkcja ok. 5 mln ton
* metalurgia
– dodatki do stali – stal nierdzewna (11%)
– chromowanie
– pasywacja tlenkowa powierzchni Al, Zn, Cd
– anodowanie aluminium – elektrolityczne utlenianie Al
w elektrolicie chromianowym
anodowane aluminium
chromowanie

ZASTOSOWANIE
Chrom
* barwniki i pigmenty
– żółć chromowa PbCrO
4
– zieleń chromowa (błękit pruski + żółć chromowa)
– tlenki chromu, stosowane jako pigmenty
w ceramice i szkle
zieleń chromowa
żółć chromowa
zielone tlenki chromu jako pigmenty

ZASTOSOWANIE
Chrom
* naturalne rubiny (Al
2
O
3
) – czerwona barwa, spowodowana obecnością jonów
chromu (III)
– syntetyczne rubiny – pierwszy laser 1960 r.
* ochrona drewna
* garbowanie skór
– KCr(SO
4
)
2
; Cr
2
(SO
4
)
3
– sieciowanie włókien kolagenowych
* materiały ogniotrwałe
* katalizatory
– przetwórstwo węglowodorów
rubiny
garbowanie skór

ZASTOSOWANIE
Molibden
* stopy – 86% całej produkcji Mo
– stal o wysokiej twardości (~8% Mo)
– stal antykorozyjna
– powłoki ogniochronne – zastępuje wolfram
* stosowany jako nawóz (np. do kalafiorów)
* jako elektrody w niskonapięciowych źródłach promieniowania X,
np. w mammografach

ZASTOSOWANIE
Wolfram
- produkcja ok. 65 tys. ton
* materiały o wysokiej twardości – połowa całkowitej produkcji
– WC – urządzenia wiertnicze, szewskie, skrawające,
itp.
– wyroby jubilerskie – zastępuje złoto
* stopy – Hastelloy, Stellite – turbiny, aparatura chemiczna
* produkcja broni
* procesy chemiczne
– katalizator hydrodesulfuryzacji; smar wysokotemperaturowy
– selektywna redukcja NO do N
2
i H
2
O
* elektronika – włókna katodowe, mikroskopy elektronowe, układy scalone, itp.
wiertła z WC
TLENKI I HALOGENKI CHROMOWCÓW
Stopień utlenienia
(+II)
(+III)
(+IV)
(+V)
(+VI)
-
-
-
CrF
2
CrCl
2
CrBr
2
CrI
2
-
MoCl
2
MoBr
2
MoI
2
-
WCl
2
WBr
2
WI
2
Cr
2
O
3
-
-
CrF
3
CrCl
3
CrBr
3
CrI
3
MoF
3
MoCl
3
MoBr
3
MoI
3
-
WCl
3
WBr
3
WI
3
CrO
2
MoO
2
WO
2
CrF
4
CrCl
4
CrBr
4
CrI
4
MoF
4
MoCl
4
MoBr
4
MoI
4
(?)
WF
4
WCl
4
WBr
4
WI
4
(?)
-
Mo
2
O
5
(W
2
O
5
)
CrF
5
-
-
-
MoF
5
MoCl
5
-
-
WF
5
WCl
5
WBr
5
-
CrO
3
MoO
3
WO
3
(CrF
6
)
-
-
-
MoF
6
(MoCl
6
)
-
-
WF
6
WCl
6
WBr
6
-
ZWIĄZKI NA +II STOPNIU UTLENIENIA
Bezwodne halogenki otrzymuje się przez:
• redukcję MX
3
wodorem w temp. 500
o
C
• reakcję z HF, HCl, HBr lub I
2
w temp. 600
o
C
Cr + 2HCl
CrCl
2
+ H
2
H
2
O
[ Cr( H
2
O)
6
]
+ 2
Cl
2
600
o
C
w powietrzu halogenki MX
2
ulegają utlenieniu
2Cr
+2
+ H
+
+ H
2
O
H
2
+ 2Cr
+3
+ OH
-
octan
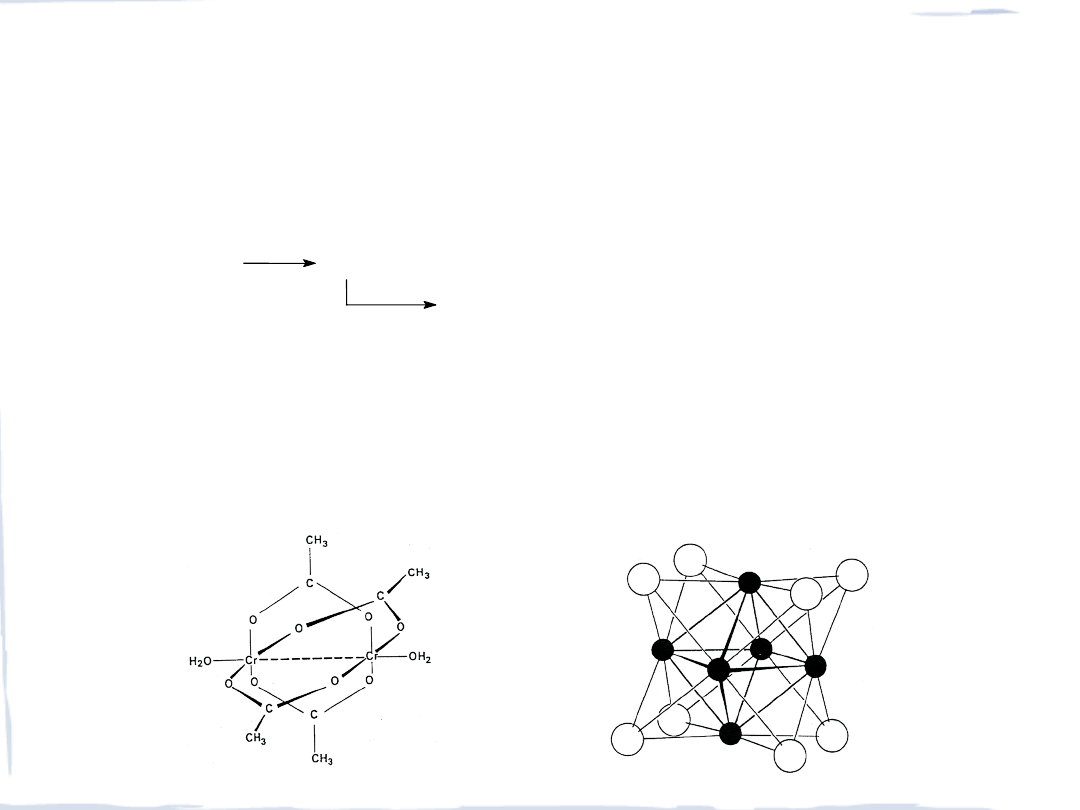
chromu
(II) jest jednym z najtrwalszych związków
chromu
halogenki
Mo
i
W
nie mają prostych wzorów, np. MoBr
2
to [Mo
6
Br
8
]Br
4
x
2H
2
O

ZWIĄZKI Cr (+III)
Cr
2
O
3
[Cr(H
2
O)
6
]
+3
[CrO
2
]
-
H
+
OH
-
Związki najważniejsze i najtrwalsze
Znane są wszystkie bezwodne halogenki CrX
3
,
tworzące w roztworze wodnym fioletowe jony [Cr(H
2
O)
6
]
+3
Cr
2
O
3
– zielony, o strukturze korundu
Otrzymywanie
(NH
4
)
2
Cr
2
O
7
Cr
2
O
3
+ N
2
+ 4H
2
O (sztuczne ognie)
4Cr + 3O
2
2Cr
2
O
3
4CrO
3
2Cr
2
O
3
+ 3O
2
Cr
+3
+ 3OH
-
Cr(OH)
3
Cr
2
O
3
(H
2
O)
n
tlenek jest amfoteryczny
stosowany do:
• otrzymywania
chromu
• jako pigment do farb, gumy i cementu
• katalizator syntezy polietylenu i butadienu
bezw. CrCl
3
tlenek chromu

ZWIĄZKI Cr (+III)
Jony Cr
+3
tworzą bardzo wiele różnorodnych kompleksów oktaedrycznych
[Cr(NH
3
)
6
]
+3
jedna forma
[Cr(NH
3
)
5
Cl]
+2
jedna forma
[Cr(NH
3
)
4
Cl
2
]
+
izomery cis i trans
[Cr(NH
3
)
3
Cl
3
]
izomery mer i fac
izomery d i l
[Cr(O O)
3
]
-3
TLENKI CHROMOWCÓW
CrO
2
– hydrotermalna redukcja CrO
3
, związek o strukturze rutylu
MO
3
+ H
2
MO
2
+ H
2
O
M=
Mo
,
W
brunatnofioletowe związki,
nierozpuszczalne w kwasach nieutleniających
CrO
3
– jasnopomarańczowe ciało stałe, trujące, tlenek kwasowy, bardzo silny
utleniacz
otrzymywanie
Na
2
Cr
2
O
7
+ H
2
SO
4
2CrO
3
+ Na
2
SO
4
+ H
2
O
właściwości
CrO
3
+ 2NaOH
NaCrO
4
+ H
2
O
2CrO
3
2CrO
2
+ O
2
CrO
3
+ 2HCl
CrO
2
Cl
2
+ H
2
O - chlorek chromylu
MoO
3
(biały) i WO
3
(cytrynowożółty) powstają w wyniku ogrzewania metalu w
powietrzu
Mogą tworzyć z tlenkami litowców lub berylowców, tlenki mieszane
CrO
3
+ F
2
CrO
2
F
2
+ 1/
2
O
2
150
o
C
CrO
3
+ 2F
2
CrOF
4
+ O
2
220
o
C

CHROMIANY, MOLIBDENIANY I WOLFRAMIANY
Silnie kwasowe tlenki w reakcji z NaOH tworzą tetraedryczne jony
CrO
3
CrO
4
-2
MoO
3
MoO
4
-2
WO
3
WO
4
-2
CrO
3
+ 2NaOH
2Na
+
+ CrO
4
-2
+ H
2
O
CrO
4
-2
Cr
2
O
7
-2
CrO
3
żółty
pomarańczowy
chrom
ian
di
chrom
ian
CHROMIANY, MOLIBDENIANY I WOLFRAMIANY
Polikwasy MoO
6
, WO
6
W wyniku zakwaszenia wodnych roztworów
molibden
ianów i
wolfram
ianów
powstają polikwasy, zawierające oktaedry MoO
6
i WO
6
• izopolikwasy, aniony tego samego typu
• heteropolikwasy (P, Si, B), różne aniony
molibden
ian
para
molibden
ian
okta
molibden
ian
[MoO
2
]
-4
[Mo
7
O
24
]
-6
[MoO
8
O
26
]
-4
MoO
3
x
2H
2
O
p H = 6
p H ~2
p H < 1
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
Wyszukiwarka
Podobne podstrony:
CN II 6 2013
CN II 9 2013
CN II 10 2013
francuski pr ii 2013
hiszpanski pr ii 2013
Prawo UE Demokratyczne podstawy (II 2013)
Enzymy II 2013
pytania treningowe, pytania treningowe wyklad II 2013, I zjazd - termodynamika
Prawo UE Wprowadzenie (II 2013)
Prawo UE Wartości, cele i zasady (II 2013)
TI II 2013 14 ramowy plan zajęć Informatyka w Historii sztuki
Giełda stoma Głowa II 2013
III rok harmonogram strona wydział lekarski 2013 2014 II i III Kopia
3 NOWY Aminokwasy II 2012 2013(1)
list intencyjny1, Prywatne, Technik administracji, II semestr 2013-zima, Technika Pracy Biurowej, do
Lepkość-sciaga, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
geo 1-2, Szkoła, Technikum Elektroniczne, szkoła II TA 2012;2013, Geografia
więcej podobnych podstron