
PRACA POGLĄDOWA
Acta Haematologica Polonica
Review Article
2006, 37, Nr 2 str. 167–183
MAREK SEWERYN
1
, JERZY HOŁOWIECKI
1
, JERZY WOJNAR
1
,
JOANNA WĘGRZYN
2
, EWA LECH-MARAŃDA
3
, JAROSŁAW SOKOŁOWSKI
4
Aktualne rekomendacje w leczeniu infekcji grzybiczych
u pacjentów w neutropenii i w nowotworowych zaburzeniach
odporności
Recommendations for treatment of fungal infections in neutropenic
and immunodeficiency cancer patients
1
Klinika Hematologii i Transplantacji Szpiku Śl.A.M. w Katowicach
Kierownik Klinki: Prof. dr hab. med. Jerzy Hołowiecki
2
Klinika Hematologii Collegium Medicum Uniwersytetu Jagiellońskiego w Krakowie,
Kierownik Klinki: Prof. dr hab. med. Aleksander B. Skotnicki
3
Klinika Hematologii U.M. w Łodzi
Kierownik Kliniki: Prof. dr hab. med. Tadeusz Robak
4
Klinika Hematologii A.M. w Białymstoku
Kierownik Kliniki: Prof. dr hab. med. Janusz Kłoczko
SŁOWA KLUCZOWE
: Rekomendacje – Infekcja grzybicza – Neutropenia – Stan obniżonej odporności –
Leki przeciwgrzybicze – Oporność na leki – Działania niepożądane
KEY WORDS
: Recommendations – Fungal infection – Neutropenia – Immunodeficiency status
– Antifungal drugs – Drug resistance – Side effects
STRESZCZENIE: Zakażenia grzybicze należą do najcięższych infekcji i dotyczą w dużej mie-
rze pacjentów neutropenicznych i z obniżoną odpornością w przebiegu choroby nowotworowej,
poddawanych intensywnej terapii zarówno antybiotykami, jak i glikokortykosterydami, czy le-
kami cytostatycznymi. Optymalne postępowanie w terapii zakażeń grzybiczych uwzględnia
przede wszystkim prawidłową profilaktykę, określenie czynników ryzyka, odpowiednią diagno-
stykę mikrobiologiczną oraz możliwie najlepsze postępowanie lecznicze w oparciu o dostępne
leki przeciwgrzybicze. Sekcja Infekcji przy Polskiej Grupie do spraw Leczenia Białaczek u doro-
słych (PALG) wypracowała polskie rekomendacje w terapii przeciwgrzybiczej u pacjentów neu-
tropenicznych i z nowotworowymi zaburzeniami odporności.
SUMMARY: Fungal infections are one of the most serious infections, concerning largely
neutropenic and immunodeficiency cancer patients, mainly after intensive antibiotic,
glicocorticosteroid and cytostatic therapy. Optimal therapy procedures for fungal infections
include: proper prophylaxis, staging for risk factors, proper microbiological examinations and
conducting the best possible antifungal treatment based on available antifungal drugs. The
Infections Section for the Polish Adult Leukaemia Group (PALG), has worked out Polish
recommendations for antifungal therapy in neutropenic and immunodeficiency cancer patients.

M. SEWERYN i wsp.
168
WSTĘP
Zakażenia grzybicze stają się w ostatnim czasie coraz większym problemem tera-
peutycznym ze względu na częściej spotykane czynniki predysponujące do ciężko
przebiegających infekcji. Wiele spośród stosowanych opcji terapeutycznych zawiera
czynniki ryzyka sprzyjające rozwojowi oportunistycznych zakażeń grzybiczych. Pa-
cjenci intensywnie leczeni antybiotykami, kortykosterydami, chemioterapią, pacjenci
w neutropenii, w stanach immunosupresji po transplantacjach, zarówno narządowych,
jak i szpiku kostnego, pacjenci z przewlekłymi chorobami wyniszczającymi i metabo-
licznymi są szczególnie predysponowani do wystąpienia ciężko przebiegających infek-
cji grzybiczych. Diagnostyka i terapia tego typu zakażeń jest wyjątkowo trudna ze
względu na niedoszacowanie problemu nadkażeń i zespołów nakładania się objawów
chorobowych oraz znacznie ograniczone w porównaniu do powikłań bakteryjnych,
możliwości wyboru leków.
CZYNNIKI RYZYKA
Wśród czynników usposabiających do wystąpienia infekcji grzybiczej przede
wszystkim wymienia się głęboką (<0,1 G/l) i długo trwającą (powyżej 10 dni) neutro-
penię, terapię glikokortykosterydami, szeroko zakresowe leczenie antybiotykami, stan
immunosupresji spowodowany przez nowotworową chorobę podstawową i inne (Tabe-
la 1). Choroba nowotworowa z jej zaburzeniami odporności nie tylko komórkowej, ale
również i humoralnej sama w sobie predysponuje do wystąpienia groźnych dla życia
fungemii. Zaburzenia odporności potęguje stosowanie glikokortykosteroidów, które
wchodzą w skład wielu schematów leczniczych w hematoonkologii. Z czynników ma-
jących wpływ na wystąpienie ciężko przebiegających grzybic, obok już wspomnianej
terapii przeciwnowotworowej i szerokozakresowej antybiotykoterapii, wymienić nale-
ży również długotrwałe stosowanie samych leków przeciwgrzybiczych np. flukonazo-
lu, amfoterycyny B, które powodują selekcję opornych gatunków patogenów.
Tabela 1. Czynniki ryzyka wystąpienia zakażeń grzybiczych
Table 1. Risk factors for development of fungal infections
Głęboka (<0,1G/l) i długo trwająca (>10dni) neutropenia
Glikokortykoterapia i leczenie immunosupresyjne
Intensywna antybiotykoterapia (np. stosowanie antybiotyków ponad 14 dni, poliantybiotykoterapia)
Ogólnoustrojowa, przewlekła terapia flukonazolem, amfoterycyną B - ponad 7 dni
Choroba przeszczep przeciwko gospodarzowi po allotransplantacji szpiku (ostra i przewlekła)
Stan po przeszczepie narządowym (zwłaszcza w starszym wieku)
Przewlekłe schorzenia wirusowe (np. CMV, HIV/AIDS)
Kolonizacja przewodu pokarmowego opornymi postaciami grzybów (posiew) oraz zanieczyszczone
otoczenie chorego (powietrze, pokarm)
Oporna, lub nawrotowa postać choroby nowotworowej pacjenta
Obecność centralnego cewnika naczyniowego
Podejrzenie infekcji grzybiczej w wywiadzie

Aktualne rekomendacje w leczeniu infekcji grzybiczych
169
Procedura transplantacji narządów oraz szpiku (przede wszystkim allogeniczna)
niesie za sobą zwiększone ryzyko wystąpienia grzybic układowych. W wielu przypad-
kach choroby przeszczep przeciwko gospodarzowi po allotransplantacjach szpiku
(zwłaszcza formy przewlekłej) mamy do czynienia z powikłaniami infekcyjnymi,
które nierzadko mają etiologię grzybiczą. Schorzenia takie przebiegają pod maską
zespołów auto- i alloimmunologicznych, co stwarza problemy nie tylko z odpowiednią
diagnostyką, ale i z szybkim wdrożeniem właściwego leczenia.
Zakażenia wirusem HIV i wystąpienie zespołu AIDS, ale także towarzyszące pro-
cedurom transplantacji reaktywacje schorzeń wirusowych (CMV, HSV, HPV) pogłę-
biają depresję układu immunologicznego sprzyjając wystąpieniu grzybic układowych.
Nie bez wpływu na poważne powikłania pozostaje kolonizacja przewodu pokar-
mowego wyselekcjonowanymi grzybami chorobotwórczymi lub potencjalnie chorobo-
twórczymi (grzybicza flora oportunistyczna). Sprzyjają temu, oprócz wspomnianych
czynników, również wielokrotne hospitalizacje pacjentów i ich regularny kontakt z mi-
krobiologią szpitalną.
Na wystąpienie powikłań w fazie krytycznie upośledzonej odporności ma także
nieodpowiednia dieta, która źle przygotowana może zawierać zarodniki a nawet wege-
tatywne, chorobotwórcze postacie grzybów. Należy więc pamiętać o odpowiedniej
preparatyce produktów żywnościowych u pacjentów narażonych na wystąpienie powi-
kłań infekcyjnych, głównie neutropenicznych. Kontaminacja pokarmu wpływa także
na wyniki czułych testów diagnostycznych i poprzez możliwość wystąpienia fałszywie
dodatnich wyników testów może prowadzić do podjęcia nieodpowiedniej terapii.
GRUPY RYZYKA
W przypadku infekcji grzybiczych, podobnie jak innych zakażeń, można wyróżnić
grupy wysokiego i niskiego ryzyka. Pacjenci, którzy spełniają kryteria wymienione
w Tabeli 1 należą do grupy wysokiego ryzyka. Ponadto wszyscy pacjenci z rozpozna-
niem ostrej białaczki oraz z innymi rozpoznaniami chorób nowotworowych poddawani
intensywnej chemioterapii lub allotransplantacji szpiku należą do grupy wysokiego
ryzyka i wymagają podjęcia szczególnych środków ostrożności – począwszy od
wstępnego badania mikrobiologicznego, poprzez odpowiednią profilaktykę i ewentual-
ną wczesną diagnostykę objawów – do możliwie najlepszej terapii przeciwinfekcyjnej.
W Tabeli 2 przedstawiono czynniki kwalifikujące chorych do grupy niskiego ryzyka.
EPIDEMIOLOGIA GRZYBIC – DROŻDŻAKI (CANDIDA spp)
Gatunek Candida jest najpopularniejszą grupą patogenów grzybiczych. Grzyby te
mogą bytować w środowisku szpitalnym, lub mogą wchodzić w skład flory przewodu
pokarmowego pacjentów (nosicielstwo) a ich nadmierny wzrost i patogenny charakter
ujawnia się głównie w sprzyjających warunkach. Grzyby te swoją „sławę” zawdzięcza-
ją szeroko stosowanej antybiotykoterapii oraz eskalacji chorób i stanów upośledzają-
cych odporność organizmu. Najpopularniejszym przedstawicielem jest Candida albi-

M. SEWERYN i wsp.
170
cans. Zakażenia drożdżakowe wywołują głównie powierzchowne zakażenia błon ślu-
zowych, ale u pacjentów hematoonkologicznych mają tendencję do uogólniania się
i wywoływania ciężkich zakażeń układowych. U pacjentów wysokiego ryzyka szcze-
gólnie w neutropenii mogą powodować zagrażające życiu infekcje układowe
Tabela 2. Klasyczny i punktowy wskaźnik pacjentów niskiego ryzyka
Table 2. Low risk patients – classical and scoring index for qualification
Klasyczne kryteria niskiego ryzyka
Indeks liczbowy niskiego ryzyka*
>/= 21 punktów
wg Klastersky and all
1. liczba granulocytów >/= 0,1 G/l
2. liczba monocytów >/= 0,1 G/l
3. brak widocznych zmian zapalnych w radio-
gramie klatki piersiowej
4. prawidłowe, lub zbliżone do prawidłowych
(do 2 razy norma) parametry funkcji nerek i
wątroby
5. czas trwania neutropenii – poniżej 7 dni
6. przewidywany czas do ustąpienia neutropenii
– poniżej 10 dni
7. objawy rozpoczynającej się regeneracji
szpiku kostnego
8. remisja choroby podstawowej
9. brak widocznych zmian zapalnych wokół
cewnika naczyniowego
10. brak zaburzeń neurologicznych i psychicz-
nych
11. brak bólu brzucha
12. brak objawów zwiększających ryzyko zgonu
(np.: wymioty, biegunka, niedotlenienie, za-
palenie płuc, objawy wstrząsu)
13. maks. temp. nie przekroczyła 39 st.C
1. brak objawów choroby - 5 punktów
-
nieznaczne objawy chorobowe – 5 punktów
-
widoczne, ale umiarkowane objawy chorobowe
– 3 punkty
2. brak spadku ciśnienia tętniczego – 5 punktów
3. brak przewlekłej obturacyjnej choroby płuc – 4
punkty
4. guz lity i brak objawów infekcji grzybiczej – 4
punkty
5. brak objawów odwodnienia – 3 punkty
6. wystąpienie gorączki poza szpitalem – 3 punkty
7. wiek poniżej 60 lat – 2 punkty
* indeks liczbowy niskiego ryzyka nie dotyczy
dzieci poniżej 16 roku życia.
W przypadku dzieci, przy braku objawów zwiększa-
jących ryzyko zgonu, liczbie monocytów >/= 0,1 G/l
i braku zmian zapalnych w radiogramie klatki pier-
siowej, pozwala kwalifikować je do grupy niskiego
ryzyka
W dobie przedflukonazolowej problem stanowił praktycznie jeden patogen z tej
grupy, wspomniany powyżej – Candida albicans. Od czasu wejścia flukonazolu na
rynek medyczny mamy do czynienia ze stałym wzrostem znaczenia flory opornej na
ten mykostatyk. Obecnie problem kliniczny zaczynają stanowić inne rodzaje z grupy
Candida, np.: Candida glabrata, Candida krusei, Candida parapsillosis, i inne bar-
dziej lub mniej wrażliwe na flukonazol. W związku z powyższym wszelkie literaturo-
we opracowania i protokoły lecznicze powinny kłaść szczególny nacisk na ogranicze-
nie stosowania tego leku wyłącznie do niezbędnych przypadków. Wśród zakażeń krwi
gatunek Candida aktualnie stanowi zaledwie kilka procent hodowanych drobnoustro-
jów, ale odsetek ten wzrasta.

Aktualne rekomendacje w leczeniu infekcji grzybiczych
171
PROBLEM ASPERGILOZY
Szczególny problem diagnostyczny i terapeutyczny stanowi u pacjentów neutrope-
nicznych i w immunosupresji zakażenie grzybami pleśniowymi, szczególnie gatunka-
mi Aspergillus (niger, flavus i inne). W zależności od zmian jakie w organiźmie wy-
wołuje, wyróżnia się postać nieinwazyjną, nosicielstwo (ślina, plwocina, kał) oraz po-
stać inwazyjną aspergilozy, gdzie dochodzi do „inwazji grzyba” do naczyń krwiono-
śnych, przekraczania barier obronnych i wywoływania choroby oraz jej uogólniania
się. Postać inwazyjna jest wyjątkowo groźnym dla życia i trudnym do leczenia stanem
chorobowym. Aspergiloza urosła w dzisiejszych czasach do rangi jednego z najbar-
dziej niebezpiecznego dla życia powikłania infekcyjnego. Przyczyniła się do tego po-
wszechność tego gatunku w środowisku (składnik wielu zanieczyszczeń), oporność
patogenu na najczęściej stosowany lek przeciwgrzybiczy – flukonazol oraz prowadze-
nie procesów terapeutycznych głęboko upośledzających układ odpornościowy. Nie
uzasadniona profilaktyka przeciwgrzybicza ułatwia inwazję organizmu tej grupie
drobnoustrojów. W przypadku gatunków Aspergillus bardzo ważną role odgrywa re-
żim sanitarny otoczenia pacjenta – odpowiednia czystość, brak kontaktu z zanieczysz-
czonym powietrzem i zakurzeniem. Na uwagę zasługuje, jak w przypadku innych
grzybic, fakt zanieczyszczonej i nieodpowiednio przygotowanej żywności. W po-
mieszczeniach wyposażonych w systemy nawiewu i oczyszczania powietrza należy
pamiętać o regularnej wymianie filtrów.
Aspergiloza inwazyjna jest bardzo prawdopodobna w przypadkach wysokiej, trwa-
jącej powyżej 4–5 dni gorączki, opornej na stosowane antybiotyki i/lub flukonazol,
z towarzyszącym kaszlem a szczególnie z krwiopluciem. Aspergiloza, oprócz lokaliza-
cji płucnej, może wystąpić w innych narządach a oprócz formy płucnej najistotniejsze
klinicznie pozostają aspergiloza OUN, zatok obocznych nosa oraz aspergiloza uogól-
niona (rozsiana) o wybitnie złym rokowaniu. Inwazyjność aspergilozy zależy w dużej
mierze również od indywidualnej predyspozycji pacjenta. Wpływ na taką sytuację
mają elementy zarówno wrodzone – np. zmiany w genach białka wiążącego mannozę
i genów odpowiedzialnych za prawidłową produkcję surfaktantu, a także elementy
odporności zarówno wrodzonej jak i nabytej, np. zaburzenia w układzie Th1/Th2.
Przykładem może być alergiczna aspergiloza oskrzelowo-płucna (ABPA) u pacjen-
tów z przewagą mediatorów układu Th2 nad Th1 (kilka procent pacjentów z astmą
alergiczną) a także u pacjentów z mukowiscydozą, którzy w ok. 7–10% rozwijają
ABPA. Prezentowana predyspozycja układu odpornościowego sprzyja ponadto wystą-
pieniu przewlekłej płucnej aspergilozy (CPA).
Przewaga z kolei mediatorów odpowiedzi Th1 (INF-g, TNF, Il-1, Il-6, Il-12, GM-
CSF, G-CSF) sprzyja korzystniejszej odpowiedzi na leczenie i lepszemu rokowaniu.
Aktualnie trwają intensywne badania nad określaniem czynników ryzyka inwazyj-
ności Aspergillus spp i innych grzybic a indywidualnymi predyspozycjami gospodarza
(pacjenta).

M. SEWERYN i wsp.
172
DIAGNOSTYKA GRZYBIC
Wykrywanie patogenów powodujących infekcje jest trudne ze względu na proble-
my w identyfikacji pewnych drobnoustrojów oraz ze względu na problem właściwej
interpretacji uzyskanych wyników. W dziedzinie diagnostyki grzybic do dyspozycji,
oprócz metod hodowlanych (metoda tzw „potwierdzająca”, „złoty standard”), mamy
szereg badań wykrywających elementy składowe czynnika infekcyjnego lub elementy
składowe odpowiedzi organizmu na infekcję (Tabela 3).
Tabela 3. Diagnostyka grzybów - metody nie hodowlane
Table 3. Fungal diagnostics – non-culture methods
Metoda Punkt
uchwytu
metody
Metoda PCR
• DNA grzybów; podjednostki rybosomalnego RNA grzybów
Wykrywanie antygenów grzyba
• Antygen mannanowy (dodatni w Candida spp),
• Antygen galaktomannanowy – GM test (dodatni w Aspergil-
lus spp; ujemny w Fusarium),
• 1-3 B-D-Glukan - BG test (dodatni w Candida spp, Aspergil-
lus spp, Fusarium, Trichosporon i w części przypadków w
Cryptococcus, Acremonium, Saccharomyces, Pneumocystis
jiovici; najcz. ujemny w Zygomycetes)
Wykrywanie przeciwciał przeciwko
antygenom grzyba
• Przeciwciała anty mannanowe (Candida spp),
• przeciwciała anty galaktomannanowe (Aspergillus)
Wykrywanie metabolitów grzybów
• D-Arabinitol (Candida spp),
• 1,3-B-D-glukan (jak wyżej)
Metody nie hodowlane identyfikacji grzybic obarczone są znacznie większym ry-
zykiem błędnej interpretacji uzyskanych wyników ze względu na ograniczoną czułość,
bądź swoistość. W przypadkach wątpliwych klinicznie, potwierdzenie klasyczną meto-
dą hodowlaną pomaga definitywnie rozwiać niejasności.
U pacjentów z deficytem odporności spowodowanym nowotworem, u których sto-
suje się chemioterapię, radioterapię, glikokortykoterapię lub inne leczenie immunosu-
presyjne – należy zwrócić uwagę na przewagę testów wykrywających bezpośrednio
antygeny drobnoustrojów, niż skierowane przeciw nim przeciwciała. Ze względu na
nikłe możliwości serokonwersji i produkcji przeciwciał w odpowiedzi na bodziec in-
fekcyjny, w takiej sytuacji badanie przeciwciał, mimo swojej wysokiej swoistości,
może być niewystarczające. Najpopularniejsze testy przedstawia zamieszczona poniżej
Tabela 4. Do badań hodowlanych i wykrywających antygeny grzybów pobieramy ma-
teriał biologiczny z podejrzanego miejsca infekcji: wymaz, punktat, plwocinę, płyn
mózgowo-rdzeniowy, krew, kał, mocz, czy wysięk, natomiast do testów wykrywają-
cych przeciwciała pobieramy krew (surowicę).
Czułość i swoistość testów jest ograniczona, co podważa ich 100% pewność.
Zwiększenie wiarygodności uzyskanego wyniku i jego przydatności klinicznej może
odbywać się, zarówno poprzez łączenie różnych dostępnych metod (wykrywanie za-
równo antygenów jak i przeciwciał), jak i ich wielokrotnemu powtarzaniu (Tabela 4).

Aktualne rekomendacje w leczeniu infekcji grzybiczych
173

M. SEWERYN i wsp.
174
Pod uwagę należy brać znane czynniki mogące mieć wpływ na fałszywie ujemne
i fałszywie dodatnie wyniki stosowanych metod i zawsze, w miarę możliwości, dążyć
do ich potwierdzenia metodą hodowlaną. W przypadku diagnostyki aspergilozy za
pomocą testów wykrywających galaktomannan (GM), z fałszywie dodatnim wynikiem
testu u pacjentów dorosłych mamy do czynienia od 5 do 15% przypadków (Tabela 5).
U dzieci, zwłaszcza małych, odsetek fałszywie dodatnich wyników jest jeszcze więk-
szy a u noworodków może znacznie przekraczać 50%.
Istotnym uzupełnieniem nowoczesnej diagnostyki grzybic jest pojawienie się no-
wych testów wykrywających odmienne antygeny grzybicze np. obok galaktomannanu
(GM) - testy wykrywające 1-3-B-D-glukan (BG) – składnik ściany komórkowej wielu
grzybów o dużym znaczeniu chorobotwórczym. Także w przypadku tych testów mamy
do czynienia w pewnych warunkach z fałszywie dodatnimi wynikami (Tabela 5).
Tabela 5. Fałszywie dodatnie wyniki testów na wykrywanie galaktomannanu (GM-tests) w diagnostyce
aspergilozy (5–15%) oraz B-D-Glukanu (BD-tests) w diagnostyce grzybic inwazyjnych
Table 5. False-positive results of the galactomannan’s tests in diagnostics of aspergillosis (5–15%) and
false-positive results of BG-tests in diagnostics of invasive fungal infections
GM-Tests
BG-Tests
Zanieczyszczone pokarmy (warzywa, ryż, modyfikowane
genetycznie rośliny) oraz uszkodzone śluzówki przewodu
pokarmowego (radioterapia, choroby jelit)
Niewydolność nerek w fazie hemodializo-
terapii z użyciem błon celulozowych
Zanieczyszczone powietrze (kurz i tzw airborne fungi:
Penicillinum chrysogeum, Aeromonas spp, Alternaria spp,
Fusaria spp)
Terapia immunoglobulinami
Wykonywanie testów w pomieszczeniu, gdzie przepro-
wadza się diagnostykę i hodowle grzybów (laboratorium
mikrobiologiczne!)
Pobieranie materiału bawełnianym maza-
kiem
Stosowanie niektórych antybiotyków np. amoxicil-
lin+clav., piperacylina (pewne partie tych antybiotyków!)
Obecność Candida spp zawierające w ścianie komórko-
wej galaktozę (nie należą do nich c. albicans, krusei, gla-
brata, tropicalis)
Pobieranie materiału bawełnianym mazakiem
Obecność Trypanosoma cruzi (Choroba Chagasa)
Krzyżowa reakcja z zawartymi w drobnoustrojach: beta-
D-galaktofuranozą, beta-D-galaktopyranozą, alfa- D-man-
nopyranozą, polisacharydami zawierającymi w składzie
galaktozę, lub sam galaktomannan
Składniki mleka matki (np. w przypadku dzieci karmio-
nych piersią)

Aktualne rekomendacje w leczeniu infekcji grzybiczych
175
LEKI PRZECIWGRZYBICZE
Leczenie zakażeń grzybiczych, mimo znacznego postępu, bywa znacznie trudniej-
sze niż zakażeń wywołanych przez bakterie. Na sytuację taką wpływa m.in. zdecydo-
wanie mniejsza ilość leków przeciwgrzybiczych w porównaniu do dostępnych antybio-
tyków oraz specyfika procesu infekcyjnego wywołana przez patogen grzybiczy – naj-
częściej głębsze zaburzenie układu odpornościowego pacjenta z grzybicą systemową.
Niestety znaczący wpływ ma również nieodpowiednia i nadużywana profilaktyka
przeciwgrzybicza.
Leki przeciwgrzybicze możemy podzielić ze względu na budowę chemiczną (po-
lieny, pochodne azolowe, echinokandyny, alliloaminy) oraz na generację leku w po-
szczególnej klasie (np. pierwsza, druga, trzecia generacja), sposób połączenia aktyw-
nego związku z nośnikami i substancjami pomocniczymi w formie konkretnego leku
(forma lipidowa, koloidalna, liposomalna) oraz mechanizm działania przeciwgrzybi-
czego (np. antymetaboliczny lub grzybostatyczny i grzybobójczy).
Do polienowych pochodnych leków przeciwgrzybiczych należą nystatyna, nata-
mycyna i amfoterycyna B. Nystatyna i natamycyna praktycznie nie wchłaniają się
z przewodu pokarmowego i są wykorzystywane głównie w leczeniu miejscowym.
Trwają badania nad skutecznością postaci liposomalnej nystatyny, dzięki czemu powi-
nien zwiększyć się udział i ranga tego leku w terapii grzybic (wstępne obserwacje kli-
niczne są obiecujące).
Amfoterycyna B do niedawna była najważniejszym terapeutykiem w leczeniu
grzybic inwazyjnych i układowych, często była lekiem „ostatniej szansy”. Mechanizm
fungobójczego działania amfoterycyny B polega na łączeniu się z ergosterolem błony
komórki grzybiczej, co powoduje zaburzenie przepuszczalności błony i w efekcie jej
lizę. Niestety mechanizm ten jest niespecyficzny a amfoterycyna B wiąże się z też
z innymi pochodnymi cholesterolowymi obecnymi w ludzkich komórkach uszkadzając
je (np. komórki kanalików nerkowych).
Flukonazol, a także inne, nowe pochodne azolowe o szerokim spektrum działania
przeciwgrzybiczego, jak itrakonazol, worikonazol, posakonazol, są lekami o innym
mechaniźmie działania niż amfoterycyna B. Blokują one z kolei biosyntezę ergosterolu
– integralnej części błony komórkowej grzyba. Pochodne azolowe działają głównie
fungostatycznie (worikonazol – również fungobójczo) a ich efekty uboczne są stosun-
kowo łagodne. Badania nad nowymi lekami w tej grupie, polegają na zwiększaniu
skuteczności przeciwmykotycznej, przy zachowaniu niskiej toksyczności ogólnej (dru-
ga i trzecia generacja, tzw nowe azole). Grupa azolowych leków grzybiczych może
wykazywać między sobą obecność zjawiska oporności krzyżowej.
Zarejestrowany w Polsce – worikonazol jest lekiem o aktywności grzybobójczej
w stosunku do Aspergillus spp a w stosunku do opornych na flukonazol: Candida gla-
brata i krusei – aktywności grzybostatycznej. Lek można stosować zarówno doustnie
jak i dożylnie, ma bardzo dobrą penetrację do ośrodkowego układu nerwowego i jest
przydatny w leczeniu grzybic O.u.n. Lek, obok postaci lipidowych i liposomalnych
amfoterycyny B i kaspofunginy stosowany jest w aspergilozie i grzybicach układo-

M. SEWERYN i wsp.
176
wych, gdyż spektrum działania obejmuje znaczną część chorobotwórczych grzybów
a efekty uboczne są stosunkowo łagodne (najbardziej charakterystyczne – zaburzenia
widzenia). Posakonazol (tylko forma doustna), nowy lek azolowy, został w ostatnim
czasie zarejestrowany w Niemczech, co może zapowiadać w najbliższym czasie roz-
szerzenie jego rejestracji o nowe kraje Unii Europejskiej.
Nowymi lekami przeciwgrzybiczymi, niespokrewnionymi z innymi grupami i
o zupełnie odmiennym mechanizmie działania są echinokandyny. Ich działanie polega
na wybiórczym zablokowaniu substratu służącego do budowy ściany komórkowej
grzyba (a nie samej błony). Substrat ten – 1,3-
β-D-glukan – nie występuje w ludzkich
komórkach, co stanowi o unikalnym i selektywnym mechanizmie działania oraz o
jego bezpieczeństwie dla chorego. Spektrum przeciwgrzybiczego działania obejmuje
większość chorobotwórczych gatunków, w tym Candida glabrata i Candida krusei
oraz Aspergillus spp. Dzięki tym cechom ich profil działania jest podobny do amfote-
rycyny B, natomiast efekty uboczne są zbliżone do pochodnych azolowych. Cechą
charakterystyczną tej grupy terapeutyków pozostaje brak krzyżowej oporności z inny-
mi grupami leków przeciwgrzybiczych (co obserwowane bywa natomiast np. w przy-
padku pochodnych azolowych). Przedstawicielami echinokandyn są kaspofungina
i mikafungina. W przypadku kaspofunginy nie ma potrzeby przeliczania dawki na ki-
logram wagi ciała dorosłego pacjenta – po dawce nasycającej 70 mg w pierwszej do-
bie, podaje się stałą dawkę 50 mg raz dziennie, dożylne. Preparat jest zarejestrowany
w Polsce (tylko forma dożylna).
Leki z grupy alliloamin, np. terbinafina, natylimina powodują zaburzenia w meta-
boliźmie komórki grzyba hamując epoksydazę skwalenową w błonie komórkowej, co
zaburza syntezę ergosterolu i prowadzi do jej śmierci. Są stosowane głównie w lecze-
niu grzybic skóry i jej przydatków, często miejscowo.
Do leków o antymetabolicznym działaniu w stosunku do grzybów (i niektórych
bakterii) należy flucytozyna. Profil jej działania jest stosunkowo szeroki wykazując
ponadto znaczny synergizm z amfoterycyną B, niemniej działania uboczne, szczegól-
nie u chorych onkohematologicznych (supresja szpiku, aplazja), powodują, że jej
udział w terapii zakażeń jest mniejszy.
PROFILAKTYKA PRZECIWGRZYBICZA
Leczenie profilaktyczne w terapii przeciwinfekcyjnej budzi wiele kontrowersji.
W zasadzie profilaktyka przeciwinfekcyjna ze względu m.in. na selekcję opornych
szczepów nie jest zalecana a w większości przypadków – przeciwwskazana. Istnieją
jednak sytuacje kliniczne, w których profilaktyka może przynieść korzyści. Przyjmuje
się, że jest ona dozwolona u wybranej grupy pacjentów wysokiego ryzyka w oparciu
o wyniki wstępnego badania mikrobiologicznego w kompleksowej ocenie na nosiciel-
stwo drobnoustrojów patogennych (obejmuje również posiew stolca). Chorzy, u któ-
rych występuje konieczność profilaktycznej dekontaminacji przewodu pokarmowego,
powinni otrzymywać miejscowo działającą nystatynę, której dawkowanie w takich
przypadkach powinno wynosić 3×500 000 j.m. (3×1 draż). Stałe, nieuzasadnione po-

Aktualne rekomendacje w leczeniu infekcji grzybiczych
177
dawanie flukonazolu jest bezwzględnie przeciwwskazane a jego profilaktyczne zasto-
sowanie ograniczone może być tylko do przypadków po allotransplantacji szpiku,
gdzie stosuje się go w dawce 100–400 mg dziennie, z preferowaną dawką oscylującą
wokół 400 mg dziennie. W wykonanych badaniach i na podstawie obserwacji klinicz-
nych stosowanie dziennej dawki powyżej 400 mg flukonazolu wiąże się ze zdecydo-
wanie większą toksycznością i zwiększonym ryzykiem interakcji z innymi stosowa-
nymi w terapii chorego lekami (szczególnie istotne po allotransplantacjach!). Część
autorów nie podziela jednak poglądu o konieczności stosowania profilaktyki flukona-
zolowej po allotransplantacji szpiku a opinia taka staje się coraz bardziej powszechna.
Należy pamiętać, że podawanie profilaktyczne flukonazolu nie zabezpiecza pacjen-
ta przed wystąpieniem kandinemii, czy inwazyjnej postaci aspergilozy. Ryzyko wystą-
pienia kandinemii w takim przypadku jest mniejsze niż 10%, jednak powodem takich
infekcji stają się grzyby bardziej niebezpieczne, wyselekcjonowane szczepy o zmniej-
szonej wrażliwości na flukonazol (Candida glabrata, Candida parapsillosis i in.) lub
oporne a priori na ten lek, np. Candida krusei, Aspergillus spp. Grzybice takie wyma-
gają w terapii zastosowania leków o najszerszym spektrum działania a zakażenia przez
niewywołane są znacznie bardziej niebezpieczne.
Wobec ciągłego sporu trwającego wokół różnych aspektów działań profilaktycz-
nych autorzy pracy uważają, że najbardziej słusznym postępowaniem u chorych z upo-
śledzoną odpornością jest tzw „pre-emptive therapy” czyli polityka czujnej diagnosty-
ki i wczesnego reagowania leczniczego na podejrzenie infekcji. Za tą opcją przemawia
coraz szersza dostępność czułych i swoistych badań diagnostycznych oraz coraz lepsze
precyzowanie czynników ryzyka i mechanizmów sprzyjających wystąpieniu ciężkich
infekcji grzybiczych.
LECZENIE GRZYBIC UKŁADOWYCH I INWAZYJNYCH
Terapia grzybic układowych a w szczególności ich postaci inwazyjnych, należy do
jednych z trudniejszych zadań w leczeniu przeciwinfekcyjnym chorego z upośledze-
niem odporności. Biorąc pod uwagę czynniki ryzyka, dotyczy ona wyjątkowo ciężko
chorych pacjentów w głębokiej immunosupresji, stanowiąc często krańcowo ciężki
stan kliniczny. Infekcje grzybicze z powodu m.in. trudnej diagnostyki i wielorakiej
manifestacji klinicznej dzielimy na możliwe (possible), prawdopodobne (probable)
i pewne (proven). Kryteriami tego podziału jest zależność od czynników ryzyka, wy-
wiadu, badań obrazowych i diagnostyki identyfikującej zakażenie, w tym diagnostyki
mikrobiologicznej. Do grzybic pewnych należą zakażenia o zidentyfikowanym i po-
twierdzonym w hodowli mikrobiologicznej czynniku (czynnikach). Leczenie prowadzi
się wtedy zgodnie z uzyskanym mykogramem i korygując ewentualnie terapię
w aspekcie uzyskanego efektu klinicznego.
Znacznie częstsze i zawiłe w terapii są przypadki zakażeń, w których czynnik
grzybiczy jest możliwy lub prawdopodobny. W takim przypadku mamy do czynienia
z leczeniem empirycznym, które należy prowadzić w niezwykle wyważony sposób

M. SEWERYN i wsp.
178
mając na uwadze stan kliniczny (objawy chorobowe w tym gorączkę), wyniki badań
mikrobiologicznych i ciągłą analizę czynników ryzyka.
W terapii empirycznej pacjentów niskiego ryzyka stosujemy flukonazol – dożylnie,
najczęściej w dawce 200 mg i głównie w przypadkach, gdy najbardziej prawdopodob-
ne jest zakażenie drożdżakami a najmniej prawdopodobne zakażenie innymi przedsta-
wicielami tzw. opornych grzybów, w tym pleśniowych. W razie podejrzenia, że przy-
czyną infekcji może być oporna postać grzybicy do wyboru w leczeniu empirycznym
pozostają: amfoterycyna B, kaspofungina, worikonazol, itrakonazol.
W każdym przypadku trwającej powyżej 5 dni gorączki neutropenicznej, mimo
zmiany antybiotyków, u pacjentów wysokiego ryzyka należy zastosować któryś z wy-
mienionych powyżej szeroko zakresowych leków przeciwgrzybiczych.
Pozornie łatwiejsze jest leczenie zakażeń grzybiczych w których mamy udowod-
niony za pomocą wykonanych badań czynnik etiologiczny zakażenia. Nigdy bowiem
nie jesteśmy pewni, że otrzymany wynik wskazujący na konkretny patogen grzybiczy
jest obiektywną przyczyną infekcji (diagnostyka grzybic). W takich przypadkach włą-
czamy leczenie zgodne z uzyskanym mykogramem lub w sposób charakterystyczny
dla terapii danego schorzenia grzybiczego (kandydiaza, aspergiloza, kokcydomykoza,
kryptokokoza itd.), obserwując jednocześnie efekt kliniczny.
Najpopularniejszym zakażeniem grzybiczym jest kandydiaza, która najpowszech-
niej występuje w formie zapalenia miejscowego śluzówek (jama ustna, gardło, po-
chwa, okolica urogenitalna i okolica odbytu). W leczeniu stosuje się miejscowo działa-
jące leki – nystatynę, clotrimazol, natamycynę (preparat: Pimafucin), roztwory fluko-
nazolu, lub amfoterycyny B (np. preparat Ampho-Moronal).
W leczeniu kandydiazy stosuje się flukonazol w dawce średnio 200 mg/d (najczę-
ściej 100–400 mg) łącznie z próbą identyfikacji drobnoustroju przed włączeniem le-
czenia przeciwgrzybiczego i ewentualną korektą terapii po otrzymaniu wyników analiz
i uzyskanego efektu klinicznego. Flukonazol stosuje się zarówno doustnie jak i dożyl-
nie. Flukonazol jest lekiem z wyboru w leczeniu Candida albicans, najczęstszego pa-
togenu grzybiczego.
W potwierdzonych zakażeniach drożdżakami stosuje się, jak w przypadku innych
grzybic leczenie zgodnie z mykogramem. W przypadkach możliwych i prawdopodob-
nych grzybic układowych lekiem pierwszego rzutu jest również flukonazol – podawa-
ny dożylnie, najczęściej w dawce 200–400 mg dziennie. W uzasadnionych przypad-
kach dawkę flukonazolu można zwiększyć do dawki 800 mg/d, lub nawet do 1200
mg/d (pamiętając o częstych interakcjach z innymi lekami w przypadku azoli!). Lecze-
nie prowadzi się do czasu ustąpienia gorączki i objawów zakażenia kontynuując tera-
pię jeszcze przez co najmniej 7 dni, bądź przez co najmniej 14dni, gdy chory pozostaje
w neutropenii lub wymaga dalszego stosowania antybiotyków.
W zakażeniach patogenami opornymi na flukonazol z gatunku Candida zaleca się
stosowanie itrakonazolu w dawce doustnej 200–400 mg dziennie (preparat: Orungal)
lub kaspofunginy (prep. Cancidas) w dawce 70 mg dożylnej w dniu pierwszym i 50
mg dziennie w dniach kolejnych, lub worikonazolu (preparat: Vfend) w dawce doust-
nej 2×400 mg w pierwszym dniu oraz 2×200 mg dziennie w dniach kolejnych, lub

Aktualne rekomendacje w leczeniu infekcji grzybiczych
179
w formie dożylnej: 2×6 mg/kg a następnie 2×4 mg/kg, lub amfoterycyny B w dawce
dożylnej 0,5–1,5 mg/kg w formie klasycznej (deoksycholan, preparat: Fungizone –
w Polsce nie zarejestrowany w związku z tym o ograniczonej dostępności), lub 3–5
mg/kg w formie lipidowej (preparat: Amphocil), lub koloidowej (preparat Abelcet), lub
liposomalnej (preparat: Ambisome).
Preparat kaspofunginy jest szczególnie zalecany, jeśli pacjent w dotychczasowym
procesie terapeutycznym był już leczony azolowymi preparatami przeciwgrzybiczymi.
W przypadku uzasadnionego podejrzenia aspergilozy stosujemy w zależności od
stanu klinicznego pacjenta amfoterycynę B w formie klasycznej, lipidowej lub
liposomalnej, lub kaspofunginę, lub worikonazol. W grzybicach uogólnionych i inwa-
zyjnych, w tym aspergilozy, leczenie musi być intensywne i prowadzone w dawkach
praktycznie maksymalnych – w przypadku klasycznej postaci amfoterycyny B: 1–1,5
mg/kg dziennie. Jednak ze względu na brak rejestracji tej formy leku w Polsce, jego
zastosowanie stwarza obecnie problemy wynikające zarówno z dostępności preparatu,
ale także z jego toksyczności przy proponowanym dawkowaniu.
W leczeniu aspergilozy i grzybic układowych zarejestrowanymi w Polsce formami
amfoterycyny B są formy lipidowe, koloidowe i liposomalne, które w takich przypad-
kach stosujemy w dawce 4–5 mg/kg (lipidowe i koloidowe) lub nawet ponad 5 mg/kg
masy ciała dziennie (liposomalne). W trakcie leczenia konieczne staje się regularnie
monitorowanie parametrów nerkowych i elektrolitów – min.2 razy dziennie. Należy
również wspomnieć, że istnieje pojęcie dawki amfoterycyny B skumulowanej w czasie
jaką może przyjąć pacjent, która waha się dla postaci liposomalnej od 1 do 3 g
w okresie 3–4 tygodni. Preparaty lipidowe, koloidowe i liposomalne nie są skutecz-
niejsze od formy klasycznej amfoterycyny B – ale są mniej toksyczne.
Zarejestrowanymi w Polsce lekami o wysokiej skuteczności w terapii zarówno
aspergilozy jak i innych inwazyjnych grzybic układowych są kaspofungina (preparat:
Cancidas) oraz przedstawiciel grupy azolowych leków przeciwgrzybiczych – woriko-
nazol (preparat: Vfend).
W przypadku zastosowania kaspofunginy (grupa echinokandyn) w leczeniu
aspergilozy i innych grzybic inwazyjnych – po dożylnej dawce nasycającej 70 mg
w pierwszej dobie, podaje się stałą dawkę 50 mg raz dziennie dożylnie. Lek wykazuje
bardzo dobry profil terapeutyczny przy stosunkowo niskiej toksyczności. Nie wykazu-
je reakcji krzyżowych z pozostałymi lekami antymykotycznymi – i jak wspomniano
przy leczeniu opornych kandydiaz – jest szczególnie polecany u chorych, u których
w wywiadzie stosowane były azolowe leki przeciwgrzybicze. Lek charakteryzuje się
unikalnym mechanizmem działania – blokowanie syntezy ściany komórkowej grzyba
(a nie tylko błony komórkowej) poprzez wybiórcze blokowanie substratu 1,3-
β-D-
glukanu niezbędnego do jej syntezy. Badania wykazały wysoką skuteczność leku
w przypadku empirycznej terapii zarówno podejrzenia inwazyjnej aspergilozy, jak i
w potwierdzonej inwazyjnej aspergilozie u pacjentów neutropenicznych z przetrwałą
gorączką. Aktualnie trwają badania nad zastosowaniem kaspofunginy w leczeniu
pierwszej linii w inwazyjnej aspergilozie i wielolekowej terapii przeciwgrzybiczej
z zastosowaniem kaspofunginy w najcięższych przypadkach mykoz inwazyjnych

M. SEWERYN i wsp.
180
(combination antifungal therapy). Lek nie wykazuje skuteczności in vitro w stosunku
do grzybów z rodzaju Zygomycetes, Fusarium, Trichosporon.
Profil bezpieczeństwa kaspofunginy jest szczególnie korzystny, niemniej należy
pamiętać o odpowiedniej korekcie dawkowania np. cykloposporyny A w trakcie lecze-
nia kaspofunginą.
Worikonazol w przypadkach inwazyjnych i układowych grzybic oraz aspergilozie
stosowany jest dożylnie w dawkach 2 razy dziennie 6 mg/kg w dniu pierwszym a na-
stępnie 2 razy dziennie 4 mg/kg. Ze względu na farmakokinetykę i przenikalność ba-
riery krew–mózg, powinien on być preferowany w leczeniu zarówno potwierdzonej jak
i podejrzanej aspergilozy ośrodkowego układu nerwowego. Donoszono ponadto
o wyjątkowo dobrych efektach uzyskiwanych w kokcydomykozie o.u.n.. Również
w rzadkich, lecz niezwykle ciężko przebiegających zakażeniach grzybami z rodzaju:
Scedosporium, Fusarium, worikonazol prezentuje dobry profil działania, przy stosun-
kowo niewielkich efektach ubocznych (najczęściej: zaburzenia widzenia i nadwrażli-
wość na światło spowodowana najprawdopodobniej wysokim stężeniem reitnolu
w surowicy związanym z zaburzeniem jego metabolizmu). Należy pamiętać, że na
grzyby z rodzaju Aspergillus, Scedosporium, Fusarium działa grzybobójczo, natomiast
w stosunku do drożdżaków z rodzaju Candida – działa grzybostatycznie. Przeciwko
grzybom z gatunku Zygomycetes praktycznie nie wykazuje aktywności. Podczas sto-
sowania worikonazolu (tak jak i innych leków z grupy azoli) należy pamiętać o licz-
nych interakcjach i konieczności korekty dawkowania stosowanych równolegle z nim
terapeutyków, takich jak: cyklosporyna A (zredukować jej dawkę o 50%), omeprazol
(o 50%) i takrolimus (o 30%). W przypadku cyklosporyny A i takrolimusu należy czę-
ściej niż zwykle kontrolować ich poziomy we krwi.
Itrakonazol w przypadkach ciężkich grzybic inwazyjnych podaje się w dawce ok.
400 mg dziennie a nawet zwiększając dawkę w przypadkach skrajnie ciężkich,
uwzględniając interakcje tego leku i monitorując parametry biochemiczne pacjenta (gł.
czynność wątroby). W przypadku itrakonazolu, dostępnego w Polsce tylko w formie
doustnej, należy uwzględnić wpływ obniżenia kwasowości żołądka na gorszą wchła-
nialność preparatu oraz predyspozycje indywidualne (duże wahania osobnicze we
wchłanialności). Stąd w trakcie terapii podwyższającej pH żołądka lub przy achlorchy-
dii, jeśli to możliwe, itrakonazol należy popijać colą (pH takiego napoju wynosi ok.2–
3), co zwiększa jego wchłanialność. W przypadkach opornych grzybic jednym z alter-
natywnych rozwiązań zwiększających efekt terapeutyczny itrakonazolu jest jego łącze-
nie np. z amfoterycyną B i rifampicyną (terapia wielolekowa). W aspekcie zakończo-
nych aktualnie badań należy jednak zaznaczyć, iż profil skuteczności itrakonazolu
w leczeniu grzybic inwazyjnych, zwłaszcza gatunków wieloopornych, w tym aspergi-
lozy, jest wyraźnie mniejszy niż kaspofunginy, worikonazolu czy amfoterycyny B.
Na zakończenie powyższych rekomendacji nieodzowne jest wspomnienie o moż-
liwości zastosowania wspomagającego rozwiązania „ponadstandardowego” w najcięż-
szych przypadkach grzybic układowych – w postaci przetoczeń mas granulocytarnych
u pacjentów neutropenicznych. Aktualnie ponownie wraca dyskusja nad efektywnością
Aktualne rekomendacje w leczeniu infekcji grzybiczych
181
wspomagania procesu terapeutycznego substytucją granulocytów w fazie przedłużają-
cej się neutropenii. Leczenie to wymaga odpowiedniego doboru dawcy, jego przygo-
towania i preparatyki w ośrodkach odpowiednio wyposażonych i do tego uprawnio-
nych. W Polsce Regionalne Centra Krwiodawstwa i Krwiolecznictwa wycofały z ofer-
ty preparaty masy granulocytarnej, co czyni z tego postępowania wspomagającego
rzecz praktycznie niemożliwą do wykonania, a co z kolei stoi w wyraźnej opozycji do
aktualnych trendów światowych w terapii ratunkowej chorych neutropenicznych (sa-
lvage therapy).
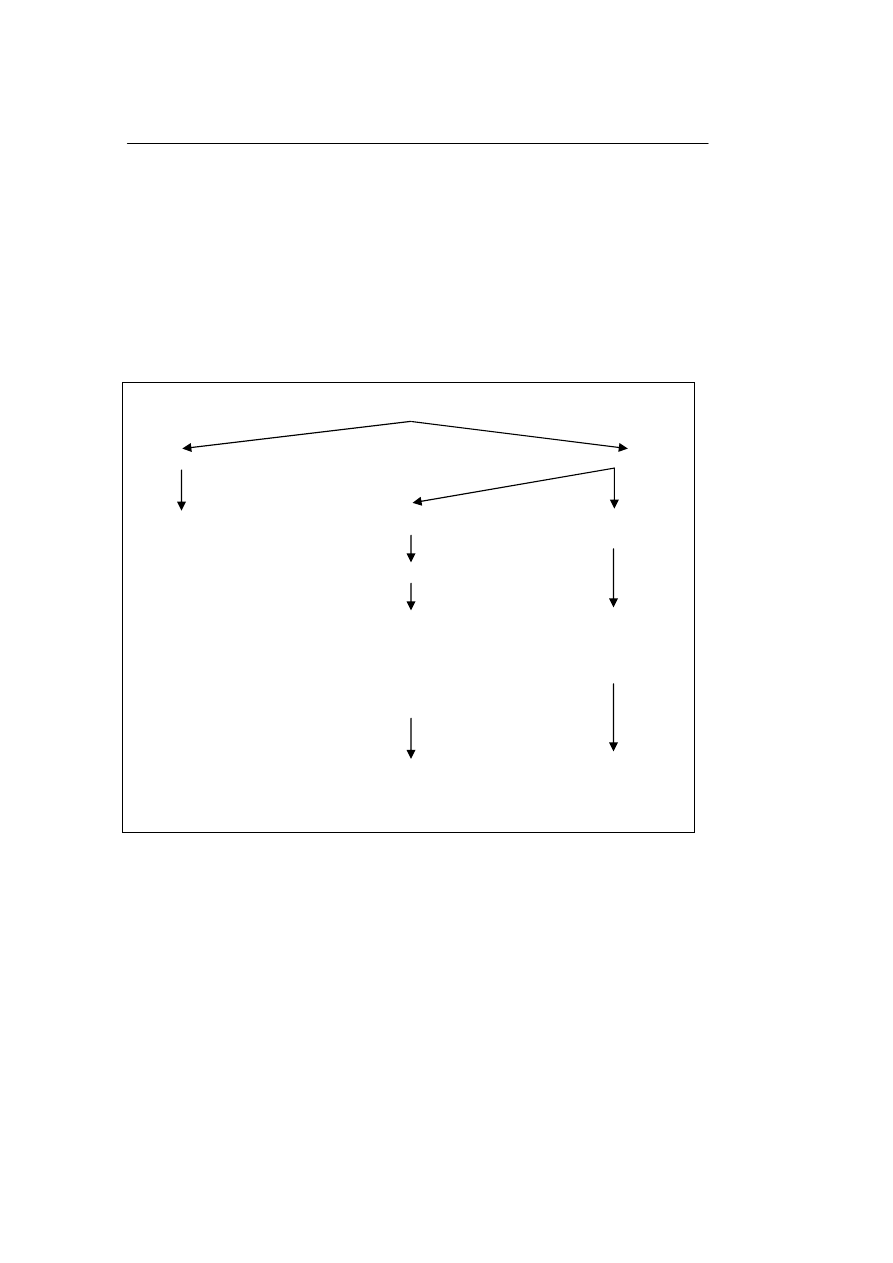
Tabela 6. Schemat postępowania w terapii przeciwgrzybiczej w neutropenii
Table 6. Diagram of antifungal therapeutic management during neutropenia
Zakażenie w neutropenii
pacjent niskiego ryzyka pacjent wysokiego ryzyka
czujna obserwacja, podejrzenie kandydiazy podejrzenie aspergilozy, lub
ewentualnie: innej opornej grzybicy
nystatyna,
lub flukonazol, flukonazol
lub terapia celowana
zgodnie z wynikiem mikrobiol.
w uzasadnionych przypadkach kontynuacja (C. albicans) amfoterycyna B
kaspofungina
brak efektu-rozważyć worikonazol
oporność na flukonazol itrakonazol
(C. glabrata, krusei i inne)
terapia celowana
itrakonazol potwierdzenie mikrobiol.
kaspofungina terapia celowana
amfoterycyna B
worikonazol
PODSUMOWANIE
Właściwa diagnostyka i odpowiednia terapia zakażeń grzybiczych pozostaje trud-
nym zagadnieniem we współczesnej medycynie, która coraz częściej prowadzi bardzo
agresywną i inwazyjną walkę z chorobami do niedawna uważanymi za nieuleczalne.
Specyfika wielu chorób krytycznie upośledzających naszą odporność oraz stosowane

M. SEWERYN i wsp.
182
do leczenia tych chorób środki, predysponują do eskalacji powikłań infekcyjnych
w szczególności o etiologii wieloopornych zakażeń grzybiczych. Wiedza na temat
zapobiegania, rozpoznawania w oparciu o czynniki ryzyka i leczenia chorób grzybi-
czych w stanach upośledzonej odporności wymaga ciągłego uaktualniania zagadnień
i temu, w zamierzeniu autorów, służy powyższa praca.
PIŚMIENNICTWO
1. Ansorg R, van den Boom R, Rath PM. Detection of Aspergillus galactomannan antigen in foods
and antibiotics. Mycoses. 1997; 40 (9–10): 353–357.
2. Aoun M. Clinical Efficacy of caspofungin in the treatment of aspergillosis. 2
nd
Advances against
Aspergillosis, 2006, Athens, Greece.
3. Boogaerts M, Winston DJ, Bow EJ, et al. Intravenous and oral itraconazole versus intravenous
amphotericin B deoxycholate as empirical antifungal therapy for persistent fever in neutropenic patients
with cancer who are receiving broad-spectrum antibacterial therapy: a randomized, controlled trial. Ann
Intern Med. 2001; 135: 412–422.
4. Buchanan AG et al. Nystatin prophylaxis of fungal colonization and infection in
granulocytopenic patients: correlation or colonization and clinical outcome. Clin Invest Med 8, 1985; 139–
147
5. Catalano L, Fiontina R, Scarpato N, et al. Combined treatment with amphotericin B and
granulocyte transfusion from G-CSF-stimulated donors in aplastic patient with invasive aspergillosis
undergoing bone marrow transplantation. Haematologica 1997; 82: 71–72.
6. Cortez KJ, Walsh TJ, Bennet JE. Succesful Treatment of Coccidioidal Meningititis with
Voriconazole. Clin Infect Dis 2003; 36: 1619–1622.
7. Dalle F, Lopez J, Caillot D, et al. False-positive results caused by cotton swabs in commercial
Aspergillus antigen latex agglutination test. Eur J Clin Microbiol Infect Dis. 2002; 21(2): 130–132.
8. Denning DW, Invasive aspergillosis. Clin Infect Dis. 1998; 26: 781–805.
9. Herbrecht R, Denning D et al. Voriconazole versus Amphotericin B for primery therapy of
invasive aspergillosis. N Eng J Med., vol. 347, No 6, 2002, 408–415.
10. Hughes WT, et al. 2002 Guidelines for the use of antimicrobial agents in neutropenic patients
with cancer. Clin Infect Dis 2002; 34: 730–751.
11. Klaasseen RJ, Goodman R, Pham BA, Doyle JJ. „Low-risk” prediction rule for pediatric patients
presenting with fever and neutropenia. J Clin Oncol 2000; 18: 1012–1019.
12. Klastersky J, Paesmans M, Rubenstein EB, et al. The multinational association for supportive
care in cancer risk index: a multinational scoring system for identify low-risk febrile neutropenic cancer
patients. J Clin Oncol 2000; 18: 3038–3051.
13. Knutsen AP. Genetic and respiratory tract risk factors for aspergillosis:ABPA and asthma with
fungal sensitisation. 2
nd
Advances against Aspergillosis, 2006, Athens, Greece.
14. Maertens J, Raad I, Petrikkos G et al. Efficacy and safety of caspofungin for treatment of
invasive aspergillosis in patients refractory to or intolerant of conventional antifungal therapy. Clin Infect
Dis 2004; 39: 1563–1571.
15. Maertens J, Verhaegen J, et al. Autopsy-controled prospective evaluation of serial screening for
circulating galactomannan by a sandwich enzyme-linked immunosorbent assay for haematological patients
at risk for invasive Aspergillosis. J Clin Microbiol. 1999; 37(10): 3223–3228.
16. Maesaki S, Kawamura S, Hashiguchi K, et al. Evaluation of sandwich ELISA galactomannan
test in samples of positive LA test and positive aspergillus antibody. Intern Med. 1999; 38(12): 948–950.
17. Maar KA, Boeckh M, Carter RA, Hyung Woo K, Corey L. Combination antifungal therapy for
invasive aspergillosis. Clin Infect Dis 2004; 38: 797–802.

Aktualne rekomendacje w leczeniu infekcji grzybiczych
183
18. Marr KA, Seidel K, White TC, et al. Candidemia in allogenic blood and marrow transplant
recipients: evolution of risk factors after the adoption of prophylalactic fluconazole. J Infect Dis 2000;
181: 309–316.
19. Marr KA, Carter RA, Boeckh M, Martin P, Corey L. Invasive aspergillosis in allogeneic stem
cell transplant recipients: changes in epidemiology and risk factors. Blood. 2002; 100(13): 4358–4366.
Epub 2002 Aug 22.
20. Nucci M, Biasoli I, Akiti T, et al. A double-blind, randomized, placebo-contolled trial of
itraconazole capsules as antifungal prophylaxis for neutropenic patients. Clin Infect Dis 2000; 30: 300–
305.
21. Rolston K, Rubenstein EB, Russel EL, Randall AP et al. Febrile Neutropenia. Martin Dunitz
Edition 2001, 27–42.
22. Safdar A, van Rhee F, et al. Candida glabrata and Candida krusei fungemii after high-risk
allogeneic marrow transplantation: no adverse effect of low-dose fluconazole prophylaxis on incidence
and outcome. Bone Marrow Transplant.2001; 28(9): 873–878.
23. Sambatakou H. Genetic and respiratory tract risk factors for aspergillosis: chronic pulmonary
aspergillosis/aspergilloma. 2
nd
Advances against Aspergillosis, 2006, Athens, Greece.
24. Seweryn M, Hołowiecki J, et al. Standardy postępowania w leczeniu chorób infekcyjnych w sta-
nach neutropenii i nowotworowych zaburzeniach odporności. Acta Haematologica Polonica 2003; 34: Nr
2, 151–167.
25. Slavin MA. Antifungal Strategies: prophylaxis, empiric or pre-emptive therapy. 2
nd
Advances
against Aspergillosis, 2006, Athens, Greece.
26. Stevens DA, Kan VL, Judson MA, et al. Practice guidelines for diseases caused by Aspergillus.
Clin Infect Dis. 2000; 30: 696–709.
27. Stevens DA. Th1/Th2 in Aspergillosis.2
nd
Advances against Aspergillosis, 2006, Athens,
Greece.
28. Walsh TJ, Pappas P et al. Voriconazole compared with liposomal amphotericin B for empirical
antifungal therapy in patients with Neutropenia and persistent fever. N Eng J Med. 2002; 346: 225–234.
29. Walsh TJ, Teppler H. Donowitz GR et al. Caspofungin versus liposomal amphotericin B for
empirical antifungal therapy in patients with persistent fever and neutropenia. N Eng J Med 2004; 351:
1391–1402.
30. Zielińska E. Korzyści i zagrożenia profilaktyki i terapii empirycznej w zwalczaniu zakażeń
grzybami u dzieci leczonych z powodu nowotworów. Zakażenia. 4/2003; 45–51.
Praca wpłynęła do Redakcji 27.03.2006 r. i została zakwalifikowana do druku 14.06.2006 r.
Adres Autorów:
Klinika Hematologii i Transplantacji Szpiku Śl.A.M.
ul. Reymonta 8
40-029 Katowice
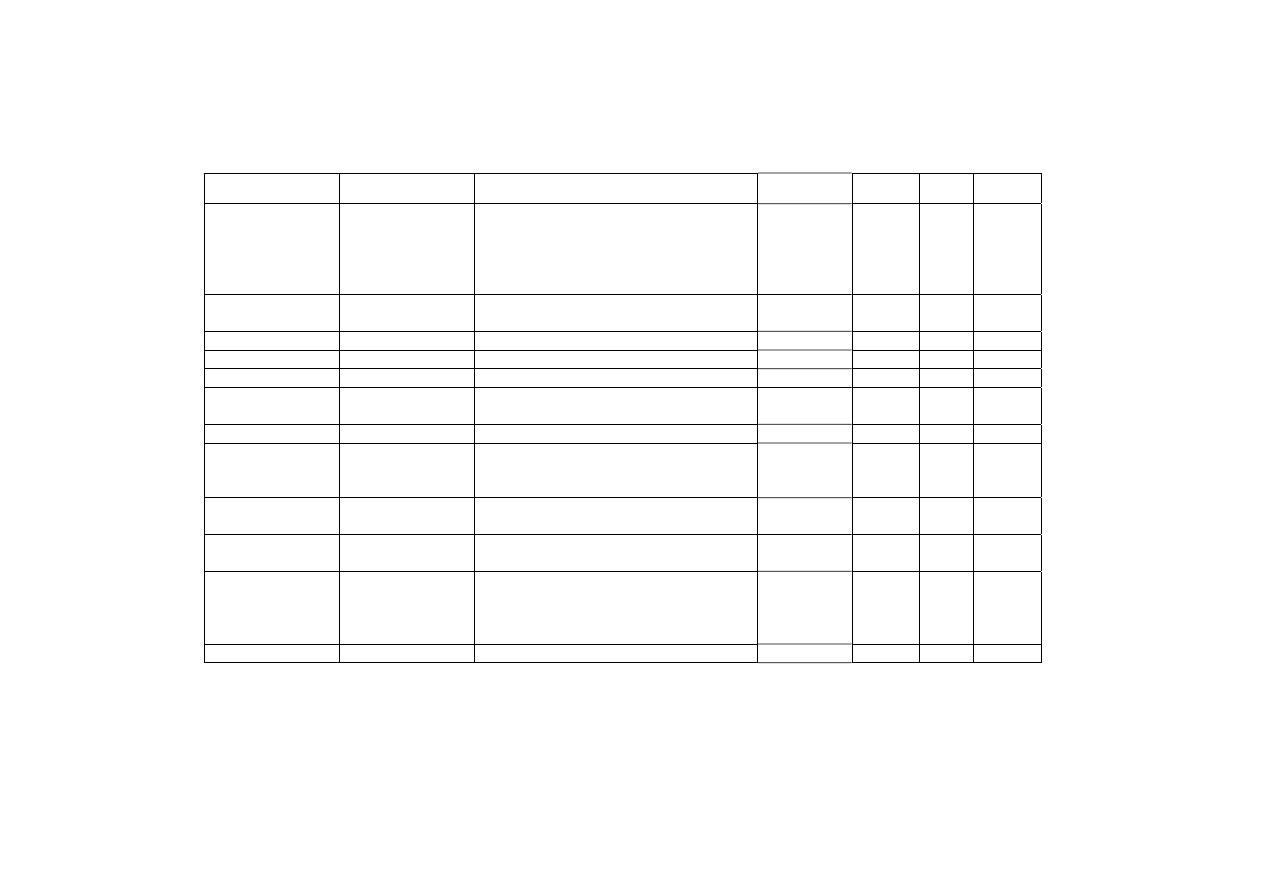
Tabela 4. Testy diagnostyczne i ich przydatność kliniczna
Table 4. The fungal diagnostics tests and theirs clinical usefullness
Grzyb
Substrat
Test
Czułość
Swoistość
PPV*
NPV**
Candida albicans
Mannan-oligoman-
nozyd B-D-Glukan
(dla wszystkich Can-
dida spp i innych
grzybów)
Platelia Candida Ag
Fungitec-G lub Glucatell
wysoka
wysoka
wysoka
wysoka
wysoka
wysoka
wysoka
wysoka
Candida albicans
przeciwciała
antymannannowe
Platelia Candida Ab
wysoka
wysoka
wysoka wysoka
Candida albicans
j.w. Platelia
Candida Ag i Ab - oba testy jednocześnie ok. 100%
ok. 100% wysoka wysoka
Candida glabrata
j.w.
Platelia
Candida Ag i Ab - oba testy jednocześnie
ok.
85%
średnia
średnia średnia
Candida tropicalis
j.w.
Platelia
Candida Ag i Ab - oba testy jednocześnie
ok.
80%
średnia
średnia średnia
Candida krusei
i Candida kefyr
j.w.
Platelia
Candida Ag i Ab - oba testy jednocześnie
ok.
50%
średnia
średnia średnia
Candida parapsillosis j.w.
Platelia
Candida Ag i Ab - oba testy jednocześnie
ok.
40%
średnia
średnia średnia
Aspegillus spp.
PCR – wykrywanie DNA grzyba
10fg DNA/ml
(1–5 CFU/ml
(ok. 100%)
70–99%
średnia
wysoka
Aspegillus spp.
Galaktomannan (GM) sandwichELISA-Platelia Aspergillus (Sanofi
Pasteur)
1–2 ng/ml
(ok. 90–93%)
60–95%
71-93% 89–98%
(wysoka)
Aspegillus spp.
Galaktomannan (GM) Latex aglutination - LA (Pastorex)
15 ng/ml
(ok. 80–90%)
40–90%
średnia wysoka
Aspegillus spp.
regularnie powtarzany test sELISA: Platelia
Aspergillus (Sanofi Pasteur) + hodowla mikrobio-
logiczna + bad.cytologiczno-histopatologiczne
podejrzanych zmian
93%
95%
93%
98%
Aspergillus spp.
B-D-Glukan (BG)
Fungitec-G lub Glucatell
wysoka
wysoka
wysoka wysoka
*PPV – positive predictive value (dodatnia wartość prognostyczna testu)
**NPV – negative predictive value (ujemna wartość prognostyczna testu)
Wyszukiwarka
Podobne podstrony:
CANCIDA w infekcjach grzybiczych
Chirurgiczne leczenie guza Wart Nieznany
Mikrobiologia mikroby grzybise Nieznany
leczenie spastycznosci i innych Nieznany
Leczenie trombolityczne w udarz Nieznany
Przewodnik po leczeniu ran 2 id Nieznany
CANCIDA w infekcjach grzybiczych
58 59 Grzybica paznokci BF0907 Nieznany (2)
Profilaktyka i leczenie grzybic stóp, Dermatologia
Leczenie prostaty id 264608 Nieznany
Leczenie endodontyczne zebow pr Nieznany
Immunomodulacja Leczenie zywie Nieznany
podstawy diagnostyki i leczenia Nieznany
OBJAWY, PRZYCZYNY I LECZENIE PR Nieznany
Postępy w rozpoznawaniu i leczeniu grzybicy paznokci
Choroby grzybicze 7 id 115019 Nieznany
więcej podobnych podstron