Politechnika Wrocławska
Wydział Inżynierii Środowiska
Studia niestacjonarne drugiego stopnia we Wrocławiu, USM
CHEMIA ŚRODOWISKA
Instrukcja laboratoryjna nr 3 i 4
Pobór prób powietrza i analiza jego zanieczyszczeń –
NH
3
, SO
2
i NO
2
Zespół dydaktyczny:
dr inż. A. Hołtra, dr inż. D. Zamorska-Wojdyła, mgr inż. P. Zwoździak
Zespół techniczny:
inż. J. Świetlik, mgr inż. I. A. Stanickiej-Łotockiej, mgr inż. M. Sitarska, mgr inż. I. Misiewicz
Wrocław, 2009
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
2
I. ZANIECZYSZCZENIA POWIETRZA
Tlenek węgla (CO), tlenki azotu (NO
x
), węglowodory (C
x
H
y
), tlenki siarki (SO
x
) i pyły to
tzw. zanieczyszczenia pierwotne powietrza. Stanowią one więcej niż 90% wszystkich znanych
zanieczyszczeń.
Główne źródła tych zanieczyszczeń to transport, spalanie paliw (źródła stacjonarne), procesy
przemysłowe, odpady stałe i inne.
Pomiary zanieczyszczeń powietrza pierwotnych i wtórnych
Zanieczyszczenia powietrza
Średni skład powietrza atmosferycznego odnoszący się do troposfery zalegającej do
wysokości około 13 km nad powierzchnią Ziemi jest przyjmowany jako stały.
Tabela. Średni skład powietrza atmosferycznego
Udział, ppm
Składnik
objętościowy
masowy
Azot N
2
Tlen O
2
Argon Ar
Dwutlenek węgla CO
2
Neon Ne
Hel He
Metan CH
4
Krypton Kr
Podtlenek azotu N
2
O
Wodór H
2
Ksenon Xe
780 900
209 500
9 300
300
28
5,2
2,2
1,0
1,0
0,5
0,08
755 400
231 500
12 800
460
12,5
0,72
1,2
2,9
1,5
0,03
0,36
Oprócz składników stałych, powietrze atmosferyczne, zawiera wiele innych składników,
które emitowane są do atmosfery. Za zanieczyszczenia powietrza atmosferycznego uważamy
wszystkie substancje w stanie stałym, ciekłym i gazowym, których udziały w powietrzu
przekraczają średnią zawartość tych substancji w czystym powietrzu atmosferycznym.
Zanieczyszczenia te pochodzą ze źródeł naturalnych lub antropologicznych (wynikających
z działalności człowieka).
Zanieczyszczenia naturalne powstają w wyniku aktywności wulkanicznej, pożarów lasów
lub rozkładu organizmów żywych. Są to przeważnie produkty gazowe, np.: dwutlenek siarki (SO
2
),
siarkowodór (H
2
S), amoniak (NH
3
), dwutlenek węgla (CO
2
), tlenek węgla (CO), węglowodory
(C
x
H
y
) oraz pyły pochodzące z wybuchów wulkanów czy obszarów pustynnych.
Oprócz zanieczyszczeń „naturalnych” do powietrza atmosferycznego są wprowadzane
znaczne ilości różnorodnych zanieczyszczeń pochodzących z takich źródeł, jak transport, spalanie
paliw, procesy przemysłowe i inne. Są to tlenek węgla (CO), tlenki azotu (NO
x
), węglowodory
(C
x
H
y
), tlenki siarki (SO
x
) i pyły. Stanowią one tzw. zanieczyszczenia pierwotne.
Skład jakościowy i rozkład stężeń zanieczyszczeń w powietrzu atmosferycznym są zmienne
w czasie i przestrzeni. Powietrze atmosferyczne stanowi swego rodzaju „reaktor”, do którego są
wprowadzane różnorodne substraty, reagujące między sobą oraz z tlenem, występującym pod
postacią tlenu cząsteczkowego (O
2
), atomowego (O) lub ozonu (O
3
). W wyniku tych przemian
powstają zanieczyszczenia wtórne, często bardziej toksyczne i szkodliwe od pierwotnych.
Wśród zanieczyszczeń wtórnych ważne miejsce zajmują niektóre aerozole. Aerozol jest to
układ dwufazowy zawierający cząstki stałe lub ciekłe zawieszone w gazie.
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
3
Prowadząc pomiary emisji zanieczyszczeń należy:
•
rozpoznać źródło czy źródła emisji, ich wielkość i rodzaj,
•
rozpoznać i przewidzieć możliwości i kierunki przemian zanieczyszczeń przebiegających
w powietrzu atmosferycznym,
•
dobrać właściwą metodę pomiarową.
Rozpoznanie źródeł emisji
Każdy proces technologiczny składa się z trzech zasadniczych etapów:
•
pozyskiwania surowca,
•
przygotowania surowca,
•
podstawowego procesu technologicznego.
Wielkość emisji i skład zanieczyszczeń zależą od stosowanego w procesie surowca, rodzaju
technologii i sprawności urządzeń do oczyszczania gazów odlotowych. Na podstawie znajomości
jakościowego i ilościowego składu surowca można przewidzieć wielkość emisji i skład
emitowanych zanieczyszczeń. Z zawartości siarki, popiołu i metali w węglu można przewidzieć
wielkość emisji dwutlenku siarki, popiołów lotnych i metali ciężkich.
Na wielkość i skład emisji ma również wpływ stosowany proces technologiczny.
W procesach energochłonnych i materiałochłonnych należy spodziewać się znacznych emisji
zanieczyszczeń. Technologie przestarzałe i mało sprawne są źródłem znacznych emisji
zanieczyszczeń, natomiast technologie nowoczesne, o dużej sprawności i mało- lub bezodpadowe,
będą stanowiły tylko nieznaczne zagrożenie dla środowiska.
Informacje dotyczące surowców i stosowanych procesów technologicznych dają odpowiedź
czego należy się spodziewać u wylotu komina i co należy mierzyć.
Wybór punktów pomiarowych
Ze względu na silną zmienność stężeń zanieczyszczeń powietrza atmosferycznego w czasie
i przestrzeni ważny jest wybór punktów pomiarowych i określenie ich liczby, w tym celu kierujemy
się następującymi kryteriami:
•
gęstość zaludnienia,
•
koncentracja zakładów przemysłowych,
•
warunki geograficzne i topograficzne,
•
warunki meteorologiczne,
•
warunki mikroklimatu lokalnego.
Liczba punktów pomiarowych powinna być proporcjonalna do gęstości zaludnienia
i koncentrować się w okolicy dużych zakładów przemysłowych oraz aglomeracji miejskich
i wiejskich. Na terenach płaskich punkty pomiarowe powinny być usytuowane na poziomie ulic i na
dachach najwyższych domów. W terenie o urozmaiconej rzeźbie punkty pomiarowe powinny być
położone na możliwie dużej liczbie poziomów. Przy rozmieszczaniu punktów pomiarowych należy
uwzględnić lokalną różę wiatrów.
Sieć pomiarowa prowadzona w celu ochrony atmosfery, informująca o stanie zagrożenia dla
zdrowia ludzi to sieć alarmowa. Punkty pomiarowe w tej sieci umieszczone są tam, gdzie
spodziewamy się maksymalnych stężeń. O czasowym i przestrzennym rozkładzie zanieczyszczeń
informacji dostarcza sieć nadzoru ogólnego, w której punkty pomiarowe tworzą geometryczną
kwadratową sieć o boku 2 kilometrów.
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
4
Przemiany zanieczyszczeń w powietrzu atmosferycznym
Procesy chemiczne i fizyczne przebiegające w powietrzu atmosferycznym zależą w dużej
mierze od stanu atmosfery. Duży wpływ na zanieczyszczenie atmosfery ma inwersja temperatury,
jest to zjawisko meteorologiczne, polegające na zakłóceniu naturalnego układu, w którym
temperatura powietrza maleje wraz z wysokością. W przypadku inwersji, gdy struga zimnego
powietrza przepływa na małej wysokości, wypiera do góry warstwę ciepłego powietrza i zajmuje
jego miejsce. W tych warunkach temperatura powietrza maleje do pewnej wysokości (450-900 m)
i potem wzrasta wraz z wysokością (900-1800 m). Powyżej tej wysokości obserwuje się znowu
normalną zależność, czyli spadek temperatury wraz z wysokością. Warstwa ciepłego powietrza
zalegająca na wysokości 900-1800 m stanowi warstwę inwersyjną przykrywającą niższe warstwy
atmosfery. Jest ona barierą dla niskich chłodnych warstw powietrza i utrudnia ich pionową
cyrkulację, powodują wzrost stężeń zanieczyszczeń. Stan inwersyjny charakteryzuje się zazwyczaj
pogodą bezchmurną. Stwarza to korzystne warunki dla reakcji fotochemicznych, w wyniku których
powstają zanieczyszczenia wtórne np. smog utleniający i inne.
Pod warstwę inwersyjną emitowane są zanieczyszczenia takie jak: tlenki węgla, tlenki azotu,
tlenki siarki, węglowodory i pyły. Z węglowodorów na drodze reakcji fotochemicznych powstają
rodniki organiczne: alkilowe R
•
, alkoksylowe RO
•
, nadtlenków alkili ROO
•
, formylowe HCO
•
,
nadtlenoformylowe
HC(O)OO
•
,
nadtlenoacylowe
RC(O)OO
•
,
mrówczanowe
HC(O)O
•
,
karboksylowe RC(O)O
•
i nieorganiczne (wodorotlenkowy HO
•
, nadtlenowodorowyHO
2
•
).
W warunkach inwersyjnych obserwuje się również wzrost stężenia tlenu atomowego (O)
i ozonu (O
3
). Dochodzi do tego jeszcze emisja pyłów i pary wodnej z elektrociepłowni w wyniku
czego otrzymujemy wielofazowy i wieloskładnikowy układ reakcyjny.
Reakcje fotochemiczne
Na drodze fotochemicznej będą reagować substancje absorbujące wysokoenergetyczne
promieniowanie w zakresie 300-700 nm. Akt absorpcji przez substancję A można opisać
równaniem:
A + h
ν
→
A*
Powstała wzbudzona cząstka A* może ulec następującym przemianom:
•
fluorescencji
A*
→
A + h
ν
•
dezaktywacji zderzeniowej A* + M
→
A + M*, gdzie M to trzecie ciało, nie biorące
udziału w reakcji, niezbędne do pochłaniania energii reakcji (najczęściej przeważający
w powietrzu tlen i azot);
•
dysocjacji
A*
→
B + C
•
bezpośredniej reakcji
A* + B
→
C +…
Substancje
absorbujące
nieabsorbujące
Tlen
Ozon
Dwutlenek azotu
Dwutlenek siarki
Kwas azotowy (III) i azotany(III) alkili
Kwas azotowy (V) i azotyny (V) alkili
Związki nitrowe
Aldehydy
Azotyny i azotany acyli
Cząstki pyłów
Azot
Woda
Tlenek węgla
Dwutlenek węgla
Tlenek azotu (NO
2
)
Trójtlenek siarki
Kwas siarki
Alkohole
Kwasy organiczne
W powietrzu atmosferycznym istotną rolę odgrywają reakcje dysocjacji i bezpośredniej reakcji.

Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
5
Przemiany tlenku węgla
Tlenek węgla jest bezbarwny, bezwonny i pozbawiony smaku. Pod postacią gazu występuje
w temperaturze powyżej 81 K. Jest nieco lżejszy od powietrza i rozpuszczalny w wodzie, powstaje
w wyniku następujących procesów:
•
niezupełnego spalania węgla lub związków zawierających węgiel
2C + O
2
→ 2CO
2CO + O
2
→ 2CO
2
Pierwsza reakcja przebiega 10 razy szybciej niż druga, zatem CO jest produktem
pośrednim globalnej reakcji spalania i może pojawić się jako produkt końcowy w razie
niedoboru tlenu niezbędnego do pełnego spalania. CO może powstawać jako produkt
końcowy nawet jeżeli ilość tlenu jest wystarczająca, w przypadku gdy paliwo
i powietrze są niewłaściwie mieszane.
•
wysokotemperaturowej redukcji CO
2
przez substancje zawierające węgiel
CO
2
+ C → 2CO
Reakcja przebiega w wysokich temperaturach w wielkich piecach i innych urządzeniach
technologicznych (przemysł hutniczy jako źródło zanieczyszczenia CO). Tlenek węgla
spełnia tu rolę czynnika redukującego.
•
wysokotemperaturowej dysocjacji CO
2
CO
2
↔ CO +
2
1
O
2
W pewnych warunkach, nawet w obecności tlenu w ilościach wystarczających do
pełnego spalania, produktem reakcji może być tlenek węgla. Jest to związane
z wysokotemperaturową dysocjacją CO
2
na CO i O
2
.
W wyniku przemysłowej emisji CO jego stężenie powinno ulegać podwojeniu co 4-5 lat.
W rzeczywistości przyrost CO w atmosferze jest znacznie mniejszy. Istnieją naturalne mechanizmy
usuwania tlenku węgla z powietrza atmosferycznego, należą do nich:
•
reakcja utleniania CO do CO
2
, reakcja ta przebiega jednak bardzo powoli i w niższych
warstwach atmosfery jest wystarczająca do utlenienia 0,1% CO na godzinę w obecności
światła słonecznego;
•
utlenianie CO do CO
2
może przebiegać szybciej nad wielkimi zbiornikami wody (morza
i oceany) dzięki dobrej rozpuszczalności produktu reakcji (CO
2
) w wodzie;
•
niektóre mikroorganizmy glebowe mają zdolność do szybkiego przyswajania CO
z powietrza atmosferycznego. Udział tego procesu w usuwaniu CO jest przeważający.
Zdolność pochłaniania CO przez mikroorganizmy wynosi 500 mln ton rocznie, co
pięciokrotnie przewyższa wielkość emisji do atmosfery.
Wynika z tego, że wysokich koncentracji CO w atmosferze należy się spodziewać
w miastach, które dysponują mniejszą wolną powierzchnią ziemi zdolnej do pochłaniania.
Jednocześnie w miastach stężenie CO zależy od natężenia emisji z pojazdów mechanicznych od
rozprzestrzeniania się zanieczyszczeń, czyli od warunków atmosferycznych.
Przemiany tlenków azotu NO
x
Symbol NO
x
oznacza mieszaninę gazów NO
2
i NO. Tlenek azotu NO jest gazem
bezbarwnym, pozbawionym zapachu. NO
2
ma kolor brunatny i ostry , duszący zapach. Tlenek
azotu jest emitowany do atmosfery w znacznie większych ilościach niż NO
2
. Gazy te powstają
w reakcji z tlenem powietrza atmosferycznego:
N
2
+ O
2
↔ 2 NO – Q
2 NO + O
2
↔ 2NO
2
+ Q
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
6
Powietrze atmosferyczne zawiera 78% azotu i 20% tlenu. W temperaturze pokojowej gazy
te nie reagują ze sobą. W wysokich temperaturach (powyżej 1480 K) reakcja przebiega zgodnie
z równaniem pierwszym. Ponieważ większość procesów spalania przebiega w temperaturze
1480-2037 K, są one głównym źródłem NO. Reakcji drugiej sprzyja niska temperatura i wysokie
stężenie tlenu. Warunki te spełnione są za wylotem konina. W rzeczywistości tylko 10% NO zostaje
utlenione do NO
2
. Jest to spowodowane szybkim i znacznym spadkiem stężenia substratów na
skutek rozcieńczenia mieszaniny reakcyjnej.
Czas przebywania NO
x
w powietrzu atmosferycznym wynosi 3-4 dni. Wynika z tego, że
istnieje naturalny proces usuwania NO
x
z powietrza w tym również reakcje fotochemiczne.
Bezpośrednia reakcja NO
2
z wodą nie wchodzi raczej w rachubę. Zaproponowano inny mechanizm
tworzenia się HNO
3
:
O
3
+ NO
2
→ NO
3
+ O
2
NO
3
+ NO
2
→ N
2
O
5
N
2
O
5
+ H
2
O
→ 2HNO
3
Końcowym produktem NO
x
jest kwas azotowy, który po reakcji z metalami zawartymi
w pyłach jest usuwany z atmosfery pod postacią soli, przez opady deszczu lub wraz z pyłami.
Istnieją jeszcze inne mechanizmy przemian NO
x
związane z tzw. cyklem fotolitycznym
NO
2
, opisanym przez reakcje:
NO
2
→ NO + O
O + O
2
+ M → O
3
+ M
O
3
+ NO→ NO
2
+ O
2
Cykl fotolityczny przebiega w kolejnych etapach:
•
NO
2
absorbuje promieniowanie ultrafioletowe ze światła słonecznego,
•
w wyniku absorpcji promieniowania NO
2
rozkłada się na NO i O; powstający tlen atomowy
jest produktem bardzo reaktywnym,
•
tlen atomowy O reaguje z tlenem atmosferycznym O
2
i powstaje ozon O
3
, wtórne
zanieczyszczenie powietrza,
•
ozon reaguje z NO i tworzy się NO
2
i O
2
.
M oznacza trzecie ciało, które nie bierze udziału w reakcji, lecz jest niezbędne do pochłaniania
energii.
W środowisku miejskim dobowe zmiany stężeń NO
x
i O
3
zależą od natężenia
promieniowania słonecznego i ruchu ulicznego. Można je scharakteryzować w następujący sposób:
•
przed świtem poziom NO i NO
2
jest stały, nieco ponad dobowe minimum,
•
ze zwiększeniem natężenia ruchu samochodowego (godz. 6-8) wzrasta gwałtownie poziom
NO,
•
ze zmniejszeniem nasłonecznienia i spadkiem ruchu samochodowego (w godz. 17-18)
stężenie NO zaczyna powoli wzrastać,
•
po zachodzie słońca fotochemiczny mechanizm konwersji NO do NO
2
zanika, natomiast
przeważać zaczyna udział reakcji utleniania przez nagromadzony w czasie dnia ozon,
wynikiem tego jest spadek stężenia ozonu w atmosferze.
Mamy tu do czynienia z szybką zmianą stężeń NO i NO
2
oraz O
3
, oraz zmianą składu tych
zanieczyszczeń w powietrzu atmosferycznym. Zmiany te zależą od pory dnia (nasłonecznienia)
oraz od natężenia emisji, czyli intensywności ruch samochodowego. Prześledzenie tych zmian jest
możliwe tylko szybkimi metodami pomiarowymi, stosowanymi w sposób ciągły, a więc za pomocą
systemu monitoringu.

Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
7
Przemiany węglowodorów i utleniacze fotochemiczne
Węglowodory i utleniacze fotochemiczne stanowią osobne, lecz ściśle ze sobą związane
kategorie zanieczyszczeń powietrza. Węglowodory zalicza się do zanieczyszczeń pierwotnych,
ponieważ wprowadzane są bezpośrednio do powietrza atmosferycznego.
Powietrze atmosferyczne jest zanieczyszczone przez znaczne ilości różnych węglowodorów.
Metodą chromatograficzną zidentyfikowano około 56 różnych węglowodorów. Naturalne źródła
węglowodorów to procesy biologiczne, aktywność geotermiczna i procesy zachodzące w pokładach
węgla, ropy i gazu ziemnego. Wynikające z tej emisji tło określa się na 1,0-1,6 ppm dla metanu
i mniej niż 0,1 ppm dla pozostałych węglowodorów. Głównym źródłem antropogennym jest
transport oraz przemysł. W zależności od budowy, węglowodory dzielimy na trzy grupy:
alifatyczne, aromatyczne i alicykliczne.
Utleniacze fotochemiczne są to substancje występujące w powietrzu atmosferycznym,
powstające w wyniku procesów fotochemicznych i zdolne do utleniania materiałów nieutlenialnych
przez tlen atmosferyczny. Substancje te są wtórnymi zanieczyszczeniami powietrza.
Szkodliwe oddziaływanie węglowodorów jest spowodowane nie tylko obecnością samych
węglowodorów, lecz także produktów reakcji fotochemicznych, stanowiących zanieczyszczenia
wtórne. Same węglowodory tylko w nieznacznym stopniu ulegają reakcjom fotochemicznym, są
natomiast bardzo reaktywne w stosunku do innych substancji będących produktami reakcji
fotochemicznych. Emisja węglowodorów zaburza cykl fotochemiczny NO
2
w wyniku czego
powstaje ozon i azotan nadtlenku acetylu (PAN) – zanieczyszczenia wtórne. Cykl ten opisują trzy
równania:
NO
2
→ NO + O
O + O
2
→ O
3
O
3
+ NO → NO
2
+ O
2
Ozon i tlenek azotu powstają tu i zanikają w jednakowych ilościach. W obecności
węglowodorów cykl ten ulega zaburzeniu. Węglowodory wchodzą łatwo w reakcję z tlenem
atomowym i ozonem. Przeważającą reakcją jest reakcja z tlenem atomowym, ponieważ jest ona 10
8
razy szybsza niż z ozonem. Reakcja miedzy tlenem atomowym a tlenem cząsteczkowym, w której
wyniku powstaje ozon jest szybsza od reakcji miedzy tlenem atomowym a węglowodorami.
Szybkość tej ostatniej jest jednak wystarczająca, aby zaburzyć cykl fotolityczny dwutlenku węgla.
Jednym z przejściowych produktów reakcji między tlenem atomowym i węglowodorami
jest bardzo reaktywny wolny rodnik RO
2
•
. Taki rodnik może reagować z NO, NO
2
, O
3
oraz
z różnymi węglowodorami. Na podstawie badań można stwierdzić, że:
•
wolne rodniki reagują szybko z NO, wyniku czego powstaje NO
2
. Konsekwencją tego jest
usunięcie ze środowiska reakcji NO i eliminacja mechanizmu likwidowania ozonu oraz
wzrost jego stężenia;
•
wolne rodniki mogą reagować z O
2
i NO
2
, w wyniku czego powstają nadtlenki organiczne
(PAN);
•
wolne rodniki mogą reagować z innymi węglowodorami oraz z tlenem (O, O
2
lub O
3
),
w wyniku czego powstają różne szkodliwe związki organiczne.
Mieszanina węglowodorów, która tworzy się w wyniku działania węglowodorów na cykl
fotolityczny NO
2
, zwana jest smogiem fotochemicznym. Składa się on z ozonu, tlenku węgla, PAN
i innych związków organicznych (aldehydów, ketonów i azotanów alkili). Zwiększone stężenia
azotanu nadtlenku acetylu (PAN) i ozonu występują w wielkich aglomeracjach miejskich,
w okresach występowania inwersji i intensywnego nasłonecznienia.
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
8
Przemiany tlenków siarki
Wspólnym wzorem SO
x
oznaczone są dwutlenek siarki SO
2
oraz trójtlenek SO
3
. Dwutlenek
siarki ma charakterystyczny, duszący zapach. Trójtlenek siarki jest bardzo reaktywny. Tworzą się
one w wyniku spalania paliw zawierających siarkę. W skali światowej 1/3 związków siarki
pochodzi ze źródeł przemysłowych, a pozostałe 2/3 ze źródeł naturalnych, jako H
2
S i SO
2
.
Zanieczyszczenia ze źródeł naturalnych rozłożone są w miarę równomiernie. Zanieczyszczenia ze
źródeł sztucznych są skoncentrowane na stosunkowo małych przestrzeniach aglomeracji miejskich
i przemysłowych.
Mechanizm powstawania SO
x
można opisać reakcjami:
S + O
2
↔ SO
2
2 SO
2
+ O
2
↔ 2 SO
3
Wydajność drugiej reakcji jest stosunkowo mała. W wysokich temperaturach równowaga reakcji
ustala się szybko, lecz stężenie SO
3
w mieszaninie jest małe. W niskich temperaturach szybkość
reakcji jest tak mała, że stan równowagi i odpowiadające mu stężenie SO
3
nie zostaje osiągnięte.
W powietrzu atmosferycznym następuje częściowa konwersja SO
2
do SO
3
i w dalszej kolejności w obecności pary wodnej do H
2
SO
4
. Proces ten przebiega przez reakcje
fotochemiczne i katalityczne i zależy od następujących czynników:
•
zawartości pary wodnej w powietrzu,
•
intensywności, czasu trwania i widma promieniowania słonecznego,
•
liczby związków i substancji katalizujących ten proces,
•
obecności sorbentów i substancji alkalicznych.
W porze dziennej w warunkach małej wilgotności powietrza istotną rolę odgrywają reakcje
fotochemiczne SO
2
i NO
2
oraz obecność węglowodorów.
W porze nocnej w warunkach dużej wilgotności powietrza lub podczas opadów deszczu
następuje sorpcja SO
2
na alkalicznych kropelkach wody, z jednoczesnym powstawaniem
siarczanów. Istnieje również możliwość adsorpcji na cząstkach pyłów, z jednoczesnym utlenianiem
do siarczanów.
Homogeniczne utlenianie w układzie SO
2
– powietrze atmosferyczne
W powietrzu atmosferycznym SO
2
ulega wielu przemianom. Najważniejszym procesem jest
utlenianie fotochemiczne.
2SO
2
+ O
2
→
hv
2SO
3
Szybkość tego procesu nie zależy od stężenia tlenu i wynosi około 5% objętościowych na godzinę.
Proces konwersji SO
2
do SO
3
tłumaczy się również obecnością tlenu atomowego
powstającego w reakcji wzbudzonej cząsteczki SO
2
z tlenem cząsteczkowym. Mechanizm ten
można opisać następująco: Cząsteczki SO
2
absorbują wysokoenergetyczne promieniowanie
słoneczne, wzbudzają się i reagują z niewzbudzonymi cząsteczkami SO
2
lub z tlenem
cząsteczkowym, w wyniku czego powstaje SO
3
SO
2
→
hv
SO
2
•
λ< 300nm
SO
2
•
+ SO
2
→ SO
3
+ SO
SO
2
•
+ O
2
→ SO
3
+ O
Tlen atomowy reaguje z dwutlenkiem siarki i tlenem cząsteczkowym
SO
2
+ O→ SO
3
O
2
+ O→ O
3
SO + O
2
→ SO
3

Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
9
Wydajność tych reakcji zależy od stopnia wzbudzenia SO
2
i od stężenia tlenu atomowego.
Powstający w tych reakcjach SO
3
reaguje z parą wodną, w wyniku czego powstaje mgła kwasu
siarkowego.
SO
3
+ H
2
O → H
2
SO
4
Układ SO
2
-węglowodory-NO
2
– powietrze atmosferyczne
Obecność tlenków azotu przyspiesza konwersję SO
2
do SO
3
. Istotną rolę odgrywa tu tlen atomowy
powstający w wyniku fotolizy NO
2
.
NO
2
→
hv
NO + O
SO
2
+ O → SO
3
Usuwanie SO
2
z układu SO
2
-NO
2
-powietrze atmosferyczne może przebiegać w sposób następujący:
SO
2
+ NO
2
→ SO
3
+ NO
SO
2
+ NO
3
→ SO
3
+ NO
2
SO
2
+ N
2
O
5
→ SO
3
+ N
2
O
4
Wprowadzenie węglowodorów do układu SO
2
– NO
2
-powietrze atmosferyczne powoduje
znaczny wzrost szybkości utleniania SO
2
do SO
3
. Proces ten przebiega najprawdopodobniej przez
pośrednie stadia z udziałem produktów reakcji miedzy ozonem a olefinami, jak rodniki alkilowe,
nadtlenki alkili bądź nadtlenki acyli:
R
•
(RO
•
, ROO
•
) + SO
2
→ RSO
2
(ROSO
2
, ROOSO
2
)
lub
RO
•
(ROO
•
) + SO
2
→ SO
3
+ R
•
(RO
•
)
Mechanizm ten jest prawdopodobny tylko dla stężeń węglowodorów większych od 0,1 ppm,
czyli w atmosferze typowej dla miast i rejonów uprzemysłowionych.
Ważną rolę w procesie utleniania SO
2
odgrywają również rodniki nieorganiczne OH
•
i HO
2
•
w okresach nasilenia reakcji fotochemicznych (długotrwałe inwersje).
Rodnik hydroksylowy OH
•
powstaje w różnych wtórnych reakcjach fotochemicznych:
CH
3
•
+ O
2
→ CH
2
O + OH
•
H + O
3
→ OH
•
+ O
2
NO
2
+ NO + H
2
O → 2HNO
2
→
hv
2NO + 2OH
•
Zaproponowano następujący mechanizm utleniania SO
2
przez OH
•
w reakcji łańcuchowej:
OH
•
+ SO
2
→ HOSO
2
•
→
2
O
HOSO
2
O
2
•
→
NO
HOSO
2
O
•
+ NO
2
i dalej
HOSO
2
O
•
+ RH → HOSO
2
OH + R
•
Rodniki R
•
mogą zainicjować kolejną reakcję łańcuchową.
W wyniku niektórych reakcji fotochemicznych powstają również rodniki HO
2
•
OH
•
+ O
3
→ O
2
+ HO
2
•
CH
3
O + O
2
→ CH
2
O
•
+ HO
2
•
Kolejną reakcją jest utlenianie SO
2
HO
2
•
+ SO
2
→ OH
•
+ SO
3
Heterogeniczne utlenianie SO
2
w strudze spalin
W strudze spalin, z jednoczesnym nakładaniem się pary wodnej pochodzącej z wież
chłodniczych, może zachodzić katalityczne utlenianie SO
2
do SO
3
. Proces ten może przebiegać
w kropelkach aerozolu, w którym absorbuje się SO
2
lub na cząstkach pyłów z zaadsorbowaną parą
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
10
wodną. Reakcje te mogą być przyspieszane katalitycznie przez chrom, żelazo, mangan i wanad.
Najistotniejszą rolę odgrywają tu żelazo i mangan. Na przebieg procesu ma wpływ pH roztworu
oraz obecność innych zanieczyszczeń, jak np. amoniak.
Znany jest proces utleniania roztworów siarczynów w kontakcie z powietrzem. Przypuszcza
się, że w procesie biorą udział rodniki HSO
3
•
lub HSO
5
•
. Poniżej przedstawiono proponowany
przebieg reakcji:
1) HSO
3
-
→ HSO
3
•
2) HSO
3
•
+ O
2
→ HSO
5
•
3) HSO
5
•
+ HSO
3
-
→ HSO
3
•
+ HSO
5
-
4) HSO
5
-
+ HSO
3
-
→ 2HSO
4
-
5) HSO
5
•
+ HSO
3
•
→ koniec reakcji łańcuchowej.
Szybkość reakcji zależy od stężenia SO
2
i pH roztworu. Przy większych wartościach pH zwiększa
się rozpuszczalność SO
2
. Dlatego w obecności amoniaku szybkość reakcji znacznie wzrasta.
W rejonach silnie uprzemysłowionych wartości pH są małe (3-6) i przyspieszenie procesu
konwersji spowodowane jest najprawdopodobniej obecnością katalizatorów. W reakcjach tych
biorą udział pośrednio kompleksy SO
2
i Mn
2+
nSO
2
+ Mn
2+
→ [Mn(SO
2
)
n
]
2+
Zaproponowano również mechanizm, w którym powstaje pośredni kompleks [Mn(SO
3
)
3
]
4-
inicjujący dwie reakcje łańcuchowe HSO
3
•
i HO
2
•
:
O
2
•
+ H
+
→ HO
2
•
HO
2
•
+ SO
3
=
→ OH
•
+ SO
4
=
OH
•
+ HSO
3
-
→ HSO
3
•
+ OH
-
I dalej zgodnie z reakcjami 1 – 5.
Istnieje również możliwość konwersji SO
2
w warstewce wody zaadsorbowanej na
powierzchni cząstek pyłów zawierających katalizatory. W tych reakcjach stwierdza się prostą
zależność od wilgotności powietrza i niejednoznaczny wpływ temperatury. Zaobserwowano
również, że aktywność oksydacyjna aerozolu znacznie maleje na odległości pierwszego kilometra
od źródła emisji, a dalej się ustala. Proces katalitycznego utleniania przebiega zatem z największą
wydajnością w strudze bezpośrednio po opuszczeniu komina i jego znaczenie maleje z odległością.
Utlenianie SO
2
w powietrzu atmosferycznym można sprowadzić do kilku podstawowych
reakcji. W obecności węglowodorów i NO
x
(smogu utleniającego) SO
2
reaguje z NO
2
, ozonem lub
innymi utleniaczami (wolne rodniki) i powstaje kwas siarkowy, który może reagować z alkaliami
zawartymi w opadach atmosferycznych bądź cząstkami pyłów:
SO
2
+ NO
2
→ SO
3
+ NO
SO
2
+ O
3
→ SO
3
+ O
SO
3
+ H
2
O→ H
2
SO
4
H
2
SO
4
+ 2MeOH → Me
2
SO
4
+ 2H
2
O
Reakcje te mają wpływ na przebieg reakcji zachodzących podczas powstawania smogu
fotolitycznego ze względu na wiązanie utleniaczy (O
3
), co powoduje spadek ich stężenia
w powietrzu atmosferycznym.

Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
11
II. POMIAR ZANIECZYSZCZEŃ POWIETRZA
Zasadniczym celem pomiarów stężeń zanieczyszczeń powietrza atmosferycznego jest ocena
stopnia jego zanieczyszczenia. Pomiary takie wykonuje się w różnych odległościach od źródeł
emisji, a także w gazach opuszczających źródło. Oceny takiej dokonuje się przez porównanie
zmierzonych stężeń zanieczyszczeń gazowych i pyłowych z normami dopuszczalnymi. Uzyskane
informacje pozwalają na podjęcie decyzji przeciwdziałających nadmiernemu skażenia powietrza.
Wyniki pomiarów zależą od wielu czynników, między innymi od stosowanej metody
pomiarowej. Jest to związane z małymi stężeniami zanieczyszczeń występujących w powietrzu, do
których wyznaczenia konieczne są metody analityczne selektywne i bardzo czułe. Stosowane
w analizie zanieczyszczeń powietrza atmosferycznego metody pomiarowe są oparte na klasycznej,
fizykochemicznej technice analitycznej.
W pomiarach stężeń zanieczyszczeń, zarówno atmosferycznych, jak i w gazach odlotowych,
obowiązują te same zasady postępowania.
Klasyczny pomiar stężeń zanieczyszczeń składa się z trzech zasadniczych etapów:
•
poboru próbki zanieczyszczeń,
•
analizy ilościowej pobranej próbki zanieczyszczeń,
•
przeliczenia wyników analizy na wymagane jednostki stężeń.
Od poprawnego wykonania każdego z tych etapów zależy dokładność końcowa wyników
pomiarów stężeń. Duży wpływ na ostateczny wynik stężeń zanieczyszczeń w powietrzu
atmosferycznym ma pobór próbek zanieczyszczeń.
Pobieranie próby powietrza polega na ilościowym wydzieleniu badanego związku
z określonej ilości powietrza. Ze znanych najczęściej stosowanych metod poboru
zanieczyszczeń największe znaczenie mają dwie:
•
aspiracyjna,
•
izolacyjna.
O zastosowaniu jednej z tych metod decyduje stopień zanieczyszczenia powietrza oraz
metoda analizy, którą stosuje się do ilościowej oceny zanieczyszczeń.
POBÓR PRÓBEK POWIETRZA ZAWIERAJĄCEGO ZANIECZYSZCZENIA
METODA ASPIRACYJNA (absorpcja w cieczy lub na ciele stałym)
Metodę aspiracyjną poboru próbek zanieczyszczeń powietrza stosuje się w razie
małego stężenia tych zanieczyszczeń w miejscach poboru. Zasadą tej metody jest
przepuszczenie znanej objętości badanego powietrza przez odpowiednio dobrane ciekłe lub
stałe substancje pochłaniające, ogólnie zwane sorbentami. Podczas poboru prób powietrza,
oznaczana substancja łączy się z sorbentem. Czynnikami powodującymi takie połączenie są
zjawiska fizyczne: rozpuszczanie, absorpcja, adsorpcja, chemisorpcja oraz reakcje chemiczne. Przy
wyborze sorbentu należy pamiętać, że powinien on wykazywać odpowiednie powinowactwo do
badanej substancji, spełniając jednocześnie warunek selektywności. Aby zapewnić dużą wydajność
wydzielania zanieczyszczeń z powietrza przepuszczanego przez sorbent, należy właściwie dobrać
czynniki wpływające na proces wydzielania, a zatem na dokładność poboru.
Na dokładność poboru próbki zanieczyszczeń metodą aspiracyjną wpływają
następujące czynniki:
•
szybkość przepływu przez sorbent,
•
zjawisko aeracji,
•
ilość przepuszczonego powietrza.
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
12
Wpływ szybkości przepływu powietrza przez sorbent na dokładność poboru próbki
Gdy wiązanie oznaczanej substancji z sorbentem następuje w wyniku reakcji chemicznej,
wydajność wydzielania zależy od szybkości tej reakcji. Szybkość ta decyduje o natężeniu
przepływu powietrza przez sorbent. Jeżeli pochłanianie następuje w wyniku rozpuszczania,
wydajność procesu zależy od szybkości przechodzenia do roztworu składnika znajdującego się
w fazie gazowej. Szybkość ta zależy od wielu parametrów, jak: szybkość własna ruchu cząsteczki
gazowej, napięcie powierzchniowe roztworu pochłaniającego, rozpuszczalność substancji w danym
roztworze itd.
Zwiększanie wydajności wydzielania substancji z powietrza uzyskuje się przez przedłużenie
czasu reakcji i zwiększenie powierzchni kontaktu gazu z roztworem (zastosowanie związków
powierzchnio czynnych, zmniejszenie szybkości przepływu powietrza, wydłużenie drogi gazu).
Wpływ ilości przepuszczonego powietrza na dokładność poboru próbek
Do stałej objętości sorbentu należy dobrać odpowiednią objętość powietrza, a następnie
przepuszczać je przez ten sorbent. Objętość przepuszczonego powietrza musi być dostatecznie
duża, aby oznaczana substancja mogła wydzielić się w ilości przekraczającej próg wykrywalności
(czułości) stosowanej metody oznaczeń ilościowych. Poza tym, objętość przepuszczonego
powietrza nie może być większa od objętości, w której oznaczona substancja zawarta jest w ilości
odpowiadającej zdolności wiązania stosowanego sorbentu.
Stosowane sorbenty
Dobór
odpowiedniego
sorbentu
w
aspiracyjnej
metodzie
poboru
próbek
zanieczyszczeń powietrza decyduje o dokładności pomiaru. Obowiązuje tu zasada, że jeśli
oznaczana substancja występuje w powietrzu w postaci gazu lub par, to pochłanianie jej w
większości przypadków odbywa się w sorbencie ciekłym. Jeśli natomiast oznaczana substancja
znajduje się w postaci ciekłej lub aerozolu (dym, mgła, obłok), to pobór prób powietrza odbywa się
z zastosowaniem sorbentu stałego lub ciekłego. Jako sorbenty stałe stosuje się najczęściej: watę
szklaną, wełnę mineralną, węgiel aktywny oraz filtry bibułowe. Sorbenty ciekłe obejmują dużą
rozmaitość roztworów pochłaniających, dobieranych w zależności od rodzaju badanej
substancji. I tak na przykład, sorbentem ciekłym dla amoniaku jest woda lub kwas, dla
dwutlenku siarki natomiast roztwór jodu lub roztwór czterochlorortęcianu sodu.
Aparatura do poboru próbek zanieczyszczeń powietrza metodą aspiracyjną
Schemat zestawu aparatury stosowanej do poboru próbek zanieczyszczeń powietrza metodą
aspiracyjną przedstawiono na niżej zamieszczonym rysunku
Schemat zestawu aparatury do poboru próbki powietrza metodą aspiracyjną:
1 - filtr pyłowy, 2 - płuczka z roztworem pochłaniającym, 3 - płuczka zabezpieczająca, 4 - zawór regulujący, 5 - pompa,
6 - miernik objętości powietrza.
W skład zestawu aparatury stosowanej do poboru próbek zanieczyszczeń powietrza
metodą aspiracyjną wchodzą następujące przyrządy:
•
pochłaniacze, w których umieszcza się sorbent,
•
przyrządy do oznaczania objętości przepuszczonego powietrza,
•
urządzenia zasysające powietrze.
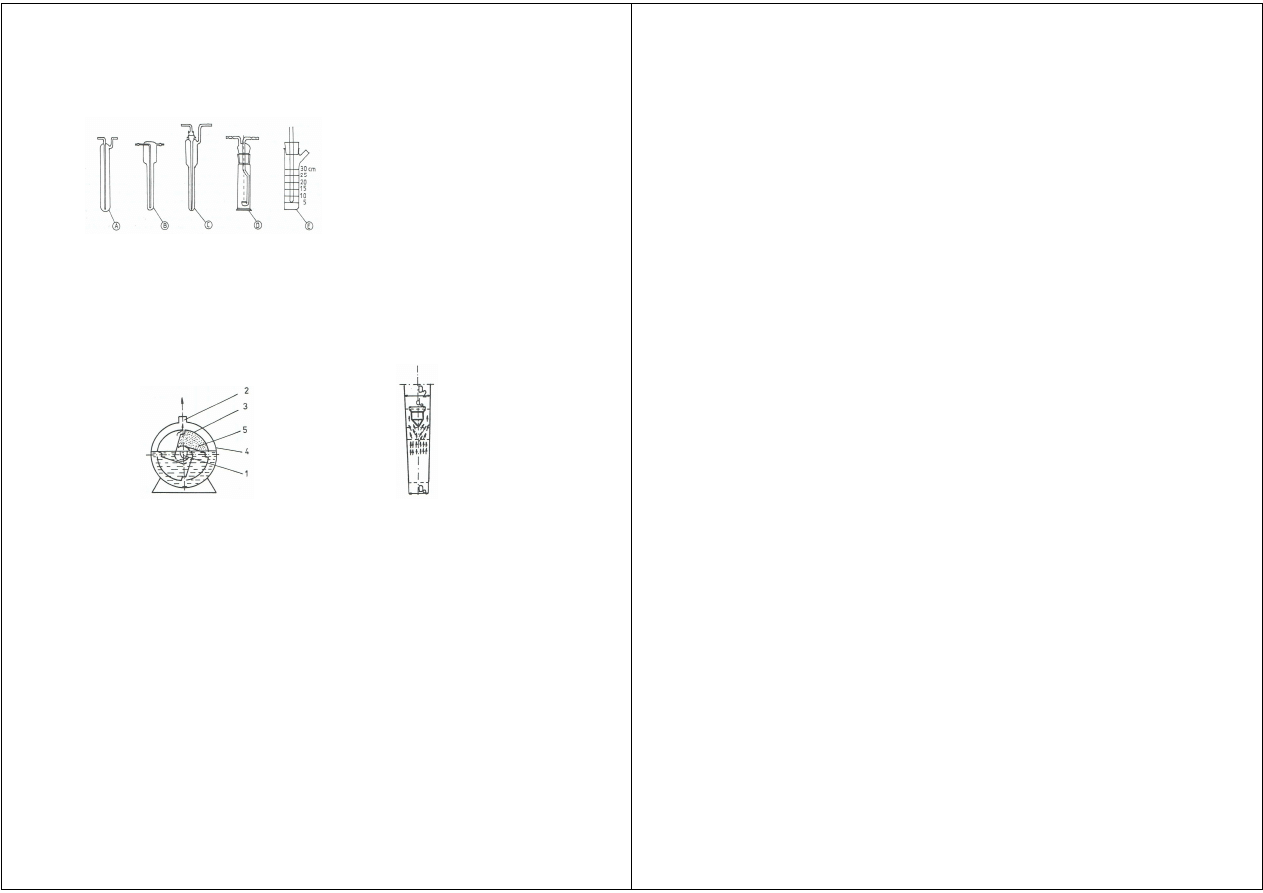
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
13
Najczęściej stosowanym pochłaniaczem są płuczki, których podstawowe typ
przedstawiono na poniższym rysunku.
Typy płuczek stosowanych w poborze próbki powietrza
metodą aspiracyjną:
A - Petriego,
B - Zajcewa,
C - Poleżajewa,
D - ze szkłem porowatym,
E - pyłowa (impinger).
Do najczęściej stosowanych przyrządów mierzących objętość gazu należą gazomierze
wodne i rotametry. Schemat budowy gazomierza wodnego przedstawiono poniżej. Gaz wpływa do
gazomierza przewodem 1 i napełnia komorę 5, zmuszając przez to wirnik 3 do obrotu. Na skutek
obrotu wirnika komora napełniana gazem zostaje w pewnym momencie odcięta od jego dopływu
i jednocześnie połączona z przestrzenią gazomierza, z której gaz przewodem 2 zostaje
odprowadzony. Proces ten powtarza się cyklicznie, a liczba obrotów i tym samym objętości gazu są
liczone za pomocą licznika mechanicznego. Oprócz gazomierzy wodnych stosuje się niekiedy
gazomierze suche – takie same lub podobne do używanych w pomiarach zużycia gazu
w sieci gazowej.
Schemat budowy gazomierza
Schemat budowy rotametru
Rotametr stosowany zamiast gazomierza przedstawiono schematycznie na
rysunku. Rotametry działają na zasadzie ustalania się poziomu pływaka we wznoszącym
strumieniu gazu. Pływak jest umieszczony w rozszerzającej się rurze, a wysokość jego wznosu
zależy od natężenia przepływu gazu. Gdy znana jest zależność poprzecznego przekroju rury
pomiarowej rotametru od jej długości, wówczas określonemu wznosowi pływaka będzie
odpowiadać ściśle określone natężenie przepływu gazu. Na rurze rotametru jest umieszczona
podziałka wskazująca natężenie przepływu gazu (w m
3
/h).
METODA IZOLACYJNA
Metodę izolacyjną poboru próbek zanieczyszczeń powietrza stosuje się w razie
występowania dużych stężeń zanieczyszczeń. Metoda ta polega na pobraniu do naczynia określonej
objętości powietrza, które następnie poddaje się analizie. Do pobrania próbek powietrza omawianą
metodą służą tzw. pipety gazowe. Są to szklane lub metalowe rury o objętości 0,1, 0,25 lub 1 dm
3
,
zakończone kranami na szlif lub teflonowymi albo wężami gumowymi z zaciskami. Przed
pobraniem próby należy w pipecie wytworzyć podciśnienie wypompowując powietrze pompą
próżniową. Taką pipetę przenosi się na miejsce pobory próby, otwiera karany, a po wypełnieniu
powietrzem zamyka i zawartość pipety poddaje analizie. Innym sposobem wytwarzania
podciśnienia w pipecie jest opróżnienie jej z wody, którą wcześniej musi być napełniona.
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
14
III. ANALIZA ILOŚCIOWA ZANIECZYSZCZEŃ POWIETRZA
OZNACZANIE SO
2
– METODA MIARECZKOWA (JODOMETRYCZNA)
Ze względu na stosunkowo małą czułość, metoda jodometryczna nadaje się przede
wszystkim do pomiarów emisji dwutlenku siarki zawartego w gazach odlotowych. Pomiar emisji
SO
2
wymaga zastosowania specjalnej aparatury, stanowiącej rozszerzenie sprzętu do pomiaru
próbek gazu o sondę pomiarową, filtry pyłu oraz przyrządy do pomiaru temperatury i ciśnienia
gazów odlotowych. Wpływ temperatury i ciśnienia gazów odlotowych uwzględnia się w określeniu
ich objętości przepływających przez płuczki z roztworem jodu. W przypadku zwiększenia stężenia
SO
2
, w poborze próbek zanieczyszczeń można przewidzieć większą objętość roztworu
pochłaniającego, jak również większe stężenie jodu (I
2
).
Z reguły, w zestawie do poboru prób uwzględnia się trzy płuczki połączone szeregowo.
Dwie z nich napełnione są roztworem jodu, a trzecia płuczka roztworem tiosiarczanu sodu.
W warunkach pomiaru emisji SO
2
, korzysta się z następującej aparatury oraz metodyki pomiarów
i obliczeń:
1.
Sonda do poboru gazów o średnicy zewnętrznej 100 mm i długości dostosowanej do
warunków poboru prób powinna być wykonana z twardego szkła lub stali kwasoodpornej.
Ponadto sonda powinna być zaopatrzona w nakrętkę zamykającą otwór w przewodzie.
Na wlocie sondy należy umieścić korek z waty szklanej lub kwarcowej odpowiednio
przygotowanej, służącej jako filtr do pyłu. Watę szklaną lub kwarcową należy przygotować
w następujący sposób: watę wypłukać kilkakrotnie w zlewce woda destylowaną, następnie
zalać 10% roztworem HCl i pozostawić do następnego dnia. W dalszym ciągu wypłukać
wodą destylowaną aż do zaniku reakcji na chlorki. Po wysuszeniu w suszarce
w temperaturze 378 K wata nadaje się do użycia.
2.
Płuczka ze spiekiem szklanym.
3.
Pompa ssąca.
4.
Gazomierz wodny i rotametr.
5.
Statyw laboratoryjny z uchwytami do umocowania płuczek.
Sondę do poboru próbki gazu umieszcza się w otworze przewodu gazowego na głębokości
1/3 średnicy. Dwie płuczki napełnione po 50 m
3
roztworem 0,05 [mol/dm
3
] jodu (I
2
), a trzecią
płuczka z roztworem tiosiarczanu sodu (Na
2
S
2
O
3
) w ilości 50 cm
3
połączyć w szereg (płuczkę
z tiosiarczanem sodu umieści na końcu) i zestawić układ poboru próbek zanieczyszczeń powietrza
metodą aspiracyjną. Przez płuczki przepuszcza się powietrza z żądaną prędkością zasysania.
Po zakończonym pomiarze, odłączeniu płuczek, spiek należy przepłukać niewielką ilością
wody destylowanej. Roztwory ze wszystkich trzech płuczek zmieszać, a następnie dodać 2 cm
3
kwasu siarkowego (1:1) i odmiareczkować nadmiar jodu roztworem tiosiarczanu sodu. Pod koniec
miareczkowania przy jasnożółtej barwie roztworu dodać roztworu skrobi i miareczkować do
pierwszego odbarwienia.
OZNACZANIE NO
2
- METODA OPTYCZNA (KOLORYMETRYCZNA)
Spektroskopia optyczna zajmuje się efektami wzajemnego oddziaływania promieniowania
elektromagnetycznego z materią
•
nadfioletu (UV)
•
w zakresie widzialnym (VIS)
•
podczerwieni (IR)
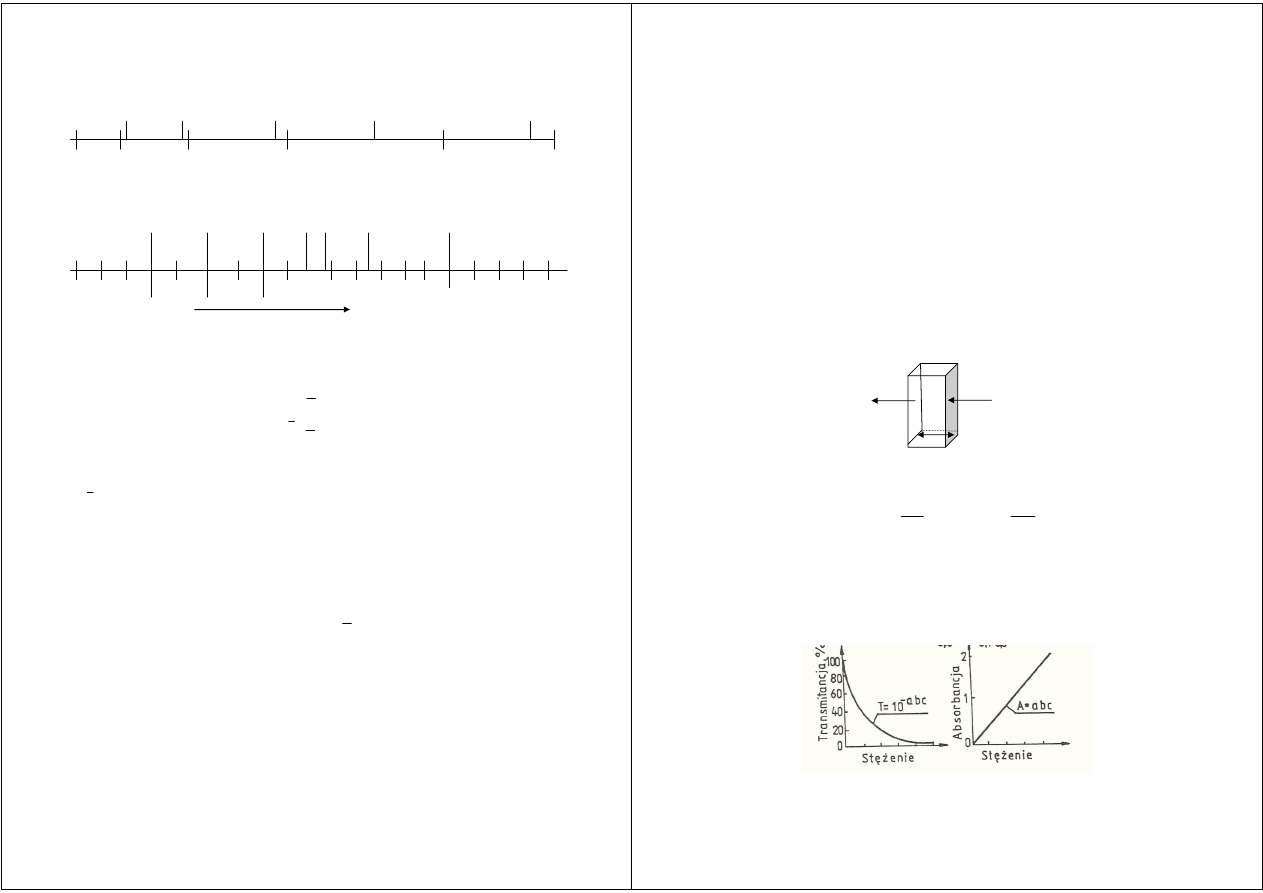
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
15
Fioletowy Niebieski Zielony Żółty Pomarańczowy Czerwony
300 400 500 600 700 800
Zakres widzialny (VIS)
Promieniowanie Prom. Prom. Prom. Prom Mikrofale Prom.
Kosmiczne Gamma X UV IR radiowe
10
-6
10
-5
10
-4
10
-3
10
-2
10
-1
10
0
10
1
10
2
10
3
10
4
10
5
10
9
10
12
Długość fali ,
λ [nm]
Widmo promieniowania elektromagnetycznego.
Opis fali elektromagnetycznej
λ
ν
c
=
λ
ν
1
=
c – prędkość światła w próżni,
λ – długość fali [mm],
ν
– częstotliwość [s
-1
] drgań (częstość drgań na sekundę),
ν
– liczba falowa [cm
-1
] (częstość drgań na centymetr).
Całkowita energia cząsteczki:
E = E
r
+ E
o
+ E
e
E – energia całkowita cząsteczki,
E
r
– energia rotacyjna,
E
o
– energia oscylacyjna,
E
e
– energia elektronowa.
∆E = h
ν
=
λ
c
h
h – stała Plancka 6,624·10
-34
[J·s],
∆E – zmiana energii.
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
16
W zależności od zjawiska stanowiącego efekt oddziaływania promieniowania
elektromagnetycznego z materią (substancją oznaczaną) wyróżniamy metody:
•
absorpcyjne – związane z absorpcją (pochłonięciem) promieniowania,
•
emisyjne – związane z emisją (odbiciem) promieniowania przez cząstki lub atomy
wzbudzone
•
nefelometrię i turbidymetrię – związane z rozpraszaniem promieniowania.
Prawa absorpcji
I
o
= I
a
+ I
r
+ I
t
I
o
–
promieniowanie padające na próbkę,
I
a
–
promieniowanie pochłonięte,
I
r
–
promieniowanie rozproszone,
I
t –
promieniowanie przechodzące przez próbkę.
Uwaga: dla roztworów nie zawierających zawiesin stosuje się równanie
I
o
= I
a
+ I
t
(bo I
r
< 4%)
Prawo Lamberta-Beera
I
t
= I
o
· 10
-ε · c · l
czyli absorbancja (A):
A = log
T
l
c
t
I
o
I
100
log
=
⋅
⋅
=
ε
ε –
molowy współczynnik absorpcji gdy stężenie wyrażone jest w [kmol/m
3
]
Absorbancja
wiązki
promieniowania
monochromatycznego
przechodzącego
przez
jednorodny ośrodek jest wprost proporcjonalna do długości drogi optycznej (czyli grubości
kuwety ) i do stężenia analitu
A = f(c) =
l
c
⋅
⋅
ε
Zależność transmitancji i absorbancji od stężenia.
I
o
I
t
l

Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
17
Błędy metod spektrofotometrii absorpcyjnej
Odchylenie od prawa Beera, czyli zależności A = f (c), spowodowane są:
a) zmianami chemicznymi roztworu zachodzącymi w miarę wzrostu stężenia
•
reakcje polimeryzacji
•
reakcje kondensacji cząsteczek
•
reakcje jonów absorbujących (między jonami a rozpuszczalnikiem)
b) warunkami aparaturowe
•
brak monochromatyczności promieniowania
Układy barwne na ogół nie spełniają prawa Lamberta-Beera ze względu na możliwość stopniowego
tworzenia kompleksów.
Aparatura stosowana do pomiarów VIS i UV
VIS - oznaczanie barwnych soli nieorganicznych oraz związków organicznych
UV - oznaczanie węglowodorów aromatycznych i innych związków organicznych,
a także metali ziem rzadkich)
•
kolorymetry – urządzenie proste wizualne lub fotoelektryczne do pracy w świetle
widzialnym VIS
•
absorpcjometry – kolorymetry i aparaty w zakresie UV i IR (jedno- i dwuwiązkowe)
•
spektrofotometry – zwierają monochromator pozwalający na wyodrębnienie wiązki
promieni o mniejszej szerokości spektralnej, czyli posiadające zdolność analizowania
w zakresie VIS i UV
Elementy składowe układu aparatury stosowanej do metod spektrofotometrii absorpcyjnej:
a)
Źródło promieniowania
•
w kolorymetrach – światło okienne lub żarówka,
•
w fotokolorymetrach – lampa wolframowa lub rtęciowa,
•
w spektrofotometrach – lampa wolframowa lub rtęciowa ( zakres VIS),
lampa deuterowa lub wodorowa (zakres UV).
b)
Regulacja natężenia promieniowania
•
przysłona,
•
szczelina.
c)
Urządzenie do zmiany długości fali
•
filtr,
•
monochromator (pryzmat, sitka dyfrakcyjna) w spektrofotometrach.
d)
Komora z probówką lub kuwetą na substancję barwną (szkło – VIS , kwarc – UV).
e)
Detektor
•
w kolorymetrach – oko ludzkie,
•
w fotokolorymetrach i spektrofotometrach – fotoogniwa, fotopowielacze, fotokomórki.
f)
Wskaźnik lub rejestrator
•
galwanometr,
•
samopis,
•
potencjometr,
•
oscyloskop.
Zalety metod spektrofotometrycznych
•
dobra czułość (dla A = 0,05 i l = 1 cm czułość jest wartością stężenia substancji [µg/dm
3
],
•
dobra precyzja i dokładność (powtarzalność i zgodność otrzymanych wyników),
•
selektywność oznaczeń (wybiórczość).
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
18
LITERATURA
1. Irena Trzepierczyńska „Fizykochemiczna analiza zanieczyszczeń powietrza”. Oficyna
Wydawnicza Politechniki Wrocławskiej, Wrocław
2. Edward Gomółka, Andrzej Szaynok „Ćwiczenia laboratoryjne z chemii wody i powietrza”.
Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław
3. Edward Gomółka, Andrzej Szaynok „Chemia wody i powietrza”. Oficyna Wydawnicza
Politechniki Wrocławskiej, Wrocław
4. Jan D. Rutkowski „Źródła zanieczyszczeń powietrza atmosferycznego”. Oficyna Wydawnicza
Politechniki Wrocławskiej, Wrocław
5. Rozporządzenie Ministra Środowiska z dnia 5 grudnia 2002 r., w sprawie wartości odniesienia
dla niektórych substancji w powietrzu, Dz. Ust. Nr 1 poz. 12.

Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
19
ZBIÓR ZADAŃ
1.
Przez płuczkę zawierającą 10 cm
3
0,04 M I
2
przepuszczono powietrze zanieczyszczone
dwutlenkiem siarki (SO
2
), z natężeniem 30 dm
3
/h (30l/h) w czasie 15 minut. Nadmiar
nieprzereagowanego jodu odmiareczkowano 0,035 M roztworem tiosiarczanu sodu
Na
2
S
2
O
3
. Do miareczkowania zużyto 2,3 cm
3
Na
2
S
2
O
3
. Obliczyć stężenie SO
2
w badanym powietrzu w mg/m
3
, %obj oraz ppm.
2.
Przez płuczkę napełnioną wodą w ilości 50 cm
3
przepuszczono powietrze
zanieczyszczone NH
3
. Powietrze przepuszczono z prędkością 50 dm
3
/h (50l/h) przez 10
minut. Do analizy pobrano 10 cm
3
wody z pochłoniętym amoniakiem i miareczkowano
0,1 M roztworem HCl. W czasie analizy zużyto 5,5 cm
3
tego kwasu. Obliczyć stężenie
NH
3
w powietrzu w mg/dm
3
.
3.
Zanalizowano 2,4 mg SO
2
przepuszczając przez roztwór pochłaniający 15 dm
3
zanieczyszczonego dwutlenkiem siarki (SO
2
) powietrza. Obliczyć stężenie SO
2
w powietrzu w g/m
3
, %obj oraz ppm.
4.
Stężenie dwutlenku siarki (SO
2
) w powietrzu wynosi 0,425 g/dm
3
. Przeliczyć stężenie na
%obj i ppm (zał. V
powietrza
= 1 dm
3
).
5.
Stężenie dwutlenku siarki (SO
2
) w powietrzu wynosi 1,5% obj. Przeliczyć stężenie na ppm
i g/dm
3
(zał. V
powietrza
= 1 dm
3
).
6.
Stężenie dwutlenku siarki (SO
2
) w powietrzu wynosi 1500 ppm. Przeliczyć stężenie na
%obj oraz g/dm
3
(zał. V
powietrza
= 1 dm
3
).
7.
Wyznaczone stężenie amoniaku (NH
3
) w powietrzu wynosi 1250 ppm. Przeliczyć stężenie
na %obj i mg/dm
3
(zał. V
powietrza
= 1 dm
3
).
8.
Wyznaczone stężenie amoniaku (NH
3
) w powietrzu wynosi 0,550 mg/dm3. Przeliczyć
stężenie na %obj i ppm (zał. V
powietrza
= 1 dm
3
).
9.
Wyznaczone stężenie CO w powietrzu wynosi 0,485 mg/dm
3
. Przeliczyć stężenie na %obj
i ppm (zał. V
powietrza
= 1 dm
3
).
10.
Wyznaczone stężenie CO
2
w powietrzu wynosi 1,25 %obj. Przeliczyć stężenie na mg/dm
3
i ppm (zał. V
powietrza
= 1 dm
3
).
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
20
Zadanie 1. Pobór próbek powietrza zanieczyszczonego amoniakiem NH
3
metodą aspiracyjną.
Oznaczanie ilości amoniaku w powietrzu.
Zasada oznaczenia polega na absorpcji gazowego amoniaku w roztworze pochłaniającym (woda
destylowana) i wyznaczeniu jego stężenia metodą miareczkową za pomocą roztworu HCl.
Materiały:
- zestaw aparatury do poboru próbki powietrza metodą aspiracyjną,
- kolby stożkowe Erlenmeyer’a/biurety/pipety,
- tryskawki z wodą destylowaną,
- oranż metylowy (metylooranż), 0,1% roztwór wodny,
- 0,1 M kwas solny (HCl).
Wykonanie:
•
Płuczki napełnić zadaną ilością wody destylowanej (zgodnie z raportem do sprawozdania
z laboratorium nr 3).
•
Wyliczyć czas poboru próby
•
Włączyć aspirator i przepuścić przez płuczkę powietrze zanieczyszczone parami amoniaku
z odpowiednim natężeniem przepływu.
•
Pobrać z płuczki porcję roztworu pochłaniającego z zaabsorbowanym amoniakiem do kolby
Erlenmajera dodać kilka kropel oranżu metylowego i miareczkować 0,1 M roztworem HCl.
Dla każdej próby miareczkowanie wykonać dwukrotnie.
•
Obliczyć całkowitą ilość pochłoniętego amoniaku w powietrzu i wynik podać w następujących
jednostkach [mg/m
3
, %obj, ppm].
Oznaczenie ilości pochłoniętego amoniaku wykonać według stechiometrii następujących
reakcji chemicznych:
1)
pochłanianie amoniaku w wodzie: NH
3
+ H
2
O = NH
4
OH (NH
3
·H
2
O)
2)
oznaczanie zawartości amoniaku w roztworze sorpcyjnym NH
4
OH + HCl = NH
4
Cl + H
2
O
Zadanie 2. Oznaczanie SO
2
w powietrzu metodą jodometryczną
Zasada oznaczenia polega na utlenianiu zanieczyszczenia dwutlenku siarki (SO
2
) jodem (J
2
) do
kwasu siarkowego (H
2
SO
4
) według równania:
SO
2
+ J
2
+ H
2
O = 2HJ + H
2
SO
4
W oznaczaniu przeszkadzają substancje redukujące (np. H
2
S) i utleniające (np. tlenki azotu).
Nieprzereagowany nadmiar jodu (J
2
) odmiareczkowuje się przy pomocy mianowanego roztworu
tiosiarczanu sodu (Na
2
S
2
O
3
) według równania:
2Na
2
S
2
O
3
+ J
2
= Na
2
S
4
O
6
+ 2 NaJ
Materiały:
- kolby stożkowe Erlenmeyer’a/biurety/pipety,
- 0,05 M roztwór jodu (J
2
),
- stężony kwas siarkowy (H
2
SO
4
),
- 0,025 M roztwór tiosiarczanu sodu (Na
2
S
2
O
3
),
- 0,5% wodny roztwór skrobi.
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
21
Wykonanie:
•
Kolbę stożkową Erlenmajera napełnić roztworem pochłaniającym 0,05 M J
2
w ilości 10 cm
3
.
•
Dodać 5 cm
3
badanej próbki oraz 2 krople stężonego H
2
SO
4
.
•
Zawartość kolby miareczkować 0,025M roztworem Na
2
S
2
O
3
do uzyskania zabarwienia
słomkowego, a następnie dodać kilka kropli roztworu skrobi (około 1 cm
3
) i miareczkować
powoli do odbarwienia się roztworu.
Obliczenia:
W czasie wkraplania H
2
SO
4
do roztworu Na
2
SO
3
zachodzą reakcje:
H
2
SO
4
+ Na
2
SO
3
= Na
2
SO
4
+ H
2
SO
3
H
2
SO
3
= H
2
O + SO
2
Stężenie SO
2
w pobranym powietrzu oblicza się w zależności
=
3
.
2
2
m
mg
V
m
c
pow
SO
SO
2
SO
m
oblicza się z iloczynu moli SO
2
(
2
SO
n
) przereagowanego z jodem i jego masy molowej
2
2
2
SO
SO
SO
M
n
m
⋅
=
[mg]
Ilość moli SO
2
, która przereagowała z jodem oblicza się z zależności:
•
n
1
– początkowa ilość moli jodu w 10 cm
3
roztworu pochłaniającego
3
3
1
1000
05
,
0
10
cm
M
cm
n
⋅
=
•
n
2
–
ilość moli tiosiarczanu sodu, który przereagował z nadmiarem jodu
3
3
2
1000
025
,
0
cm
M
cm
x
n
⋅
=
gdzie : x – ilość 0,025 M roztworu tiosiarczanu sodu zużytego do miareczkowania.
•
n
3
– ilość moli jodu, który przereagował z SO
2
, równoważna ilość moli SO
2
2
2
1
3
n
n
n
−
=
gdzie: ze stechiometrii równania reakcji chemicznej:
2
2
n
- ilość moli jodu, który nie przereagował z SO
2
Uwaga: stężenie SO
2
w powietrzu przedstawić w [g/m
3
, % obj. i ppm].
Instrukcja laboratoryjna nr 3 i 4: Pobór prób powietrza i analiza jego zanieczyszczeń Chemia środowiska
22
Zadanie 3. Oznaczenie ilościowe dwutlenku azotu NO
2
w powietrzu metodą kolorymetryczną
(modyfikacja metody Saltzmana)
Zasada oznaczenia polega na wyodrębnieniu dwutlenku azotu (NO
2
) z powietrza sposobem
aspiracyjnego pochłaniania w zmodyfikowanym roztworze Saltzmana, w którym kwas sulfanilowy
wiąże dwutlenek azotu w dwóch następujących po sobie reakcjach: dysproporcjonowania na kwas
azotowy i azotawy oraz dwuazowania. Utworzony kwas dwuazowy ulega sprzęganiu z obecnym
w roztworze chlorowodorkiem N-(1naftyl) etylenodwuaminy dając w efekcie barwną sól kwasu
N-(1-naftyl)etylenodwuamino-p-azobenzo-p-sulfonowego. Intensywność uzyskanego różowego
zabarwienia jest podstawą kolorymetrycznego oznaczenia ilościowego dwutlenku azotu.
Materiały:
- zestaw do poboru prób: aspirator
- gotowy roztwór podstawowy A - o stężeniu 0,05 mg NO
2
/cm
3
- kolby miarowe/ probówki do wykonania wzorców/pipety,
- kolorymetr jednowiązkowy Specol (firmy Zeiss);
λ
= 560 nm.
Wykonanie:
Pobór próby
•
Płuczkę napełnić 5cm
3
roztworem pochłaniającym (Saltzmana), połączyć ją z aspiratorem
•
Włączyć aspirator, przepuścić przez płuczkę określoną ilość zanieczyszczonego powietrza
z natężeniem przepływu nie większym niż 20 dm
3
/h.
•
Zanotować objętość przepuszczonego powietrza.
Wykonanie krzywej kalibracji:
•
Z roztworu podstawowego (A) o stężeniu 0,05 mg NO
2
/cm
3
przygotować roztwór roboczy (B)
o stężeniu 0,001 mgNO
2
/m
3
w kolbie miarowej
•
Sporządzić skalę wzorców dodając do probówek roztwór roboczy (B) i roztwór Saltzmana
w następujących proporcjach:
Nr wzorca
Ilość roztworu
wzorcowego (B) [cm
3
]
Ilość roztworu Saltzmana
[cm
3
]
Ilość mg NO
2
zwartych
w 5 cm
3
wzorca
1
0,0
5,0
0,0000
2
0,2
4,8
0,0002
3
0,3
4,7
0,0003
4
0,4
4,6
0,0004
5
0,6
4,4
0,0006
6
0,8
4,2
0,0008
7
1,0
4,0
0,0010
8
1,3
3,7
0,0013
9
1,6
3,4
0,0016
10
2,0
3,0
0,0020
•
Po sporządzeniu wzorców probówki z wzorcami dokładnie wymieszać i pozostawić na 20
minut dla ustalenia barwy.
•
Odczytać wartość absorbancji dla przygotowanych wzorców względem „ślepej próby” ( roztwór
Saltzmana) przy długości fali 560 nm.
•
Sporządzić wykres krzywej wzorcowej jako zależność absorbancji od zawartości NO
2
we
wzorcach: A = f(c [mgNO
2
])
•
Odczytać wartość absorbancji pobieranej próby i z krzywej wzorcowej odczytać zawartość NO
2
w badanej próbce.
Obliczenia
Obliczyć stężenie NO
2
w badanym powietrzu i określić je w następujących jednostkach [mg/m
3
,
%obj; ppm].

In
st
ru
k
cj
a
la
b
o
ra
to
ry
jn
a
n
r
3
i
4
:
P
o
b
ó
r
p
ró
b
p
o
w
ie
tr
za
i
a
n
al
iz
a
je
g
o
z
an
ie
cz
y
sz
cz
e
ń
C
h
e
m
ia
ś
ro
d
o
w
is
k
a
2
3
Im
ię
i
n
az
w
is
k
o
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
.
D
at
a
…
…
…
…
…
…
…
…
…
…
..
G
ru
p
a…
…
…
…
…
.
N
r
p
ró
b
k
i…
…
…
…
…
..
…
…
…
.
R
a
p
o
rt
d
o
s
p
ra
w
o
zd
a
n
ia
z
l
a
b
o
ra
to
ri
u
m
n
r
3
P
o
b
ó
r
p
ró
b
y
p
o
w
ie
tr
za
z
a
n
ie
cz
y
sz
cz
o
n
eg
o
N
H
3
m
et
o
d
ą
a
sp
ir
a
cy
jn
ą
.
O
zn
a
cz
a
n
ie
i
lo
śc
i
a
m
o
n
ia
k
u
w
p
o
w
ie
tr
zu
.
1
.
W
a
ru
n
k
i
p
o
b
o
ru
p
ró
b
k
i
d
o
a
n
a
li
zy
O
b
ję
to
ść
r
o
z
tw
o
ru
p
o
ch
ła
n
ia
ją
c
e
g
o
…
..
.…
..
…
…
…
…
…
…
…
..
m
l
O
b
ję
to
ść
r
o
z
tw
o
ru
p
o
ch
ła
n
ia
ją
c
e
g
o
w
z
ię
te
g
o
d
o
a
n
al
iz
y
.
…
…
..
…
…
…
…
…
…
…
..
…
m
l
N
at
ę
ż
en
ie
p
rz
ep
ły
w
u
g
az
u
…
…
..
.…
…
…
…
.…
..
.…
d
m
3
/h
O
b
ję
to
ść
p
rz
ep
u
sz
cz
o
n
eg
o
g
az
u
…
…
…
…
…
…
…
…
…
…
..
d
m
3
C
z
as
p
o
b
o
ru
p
ró
b
k
i
…
…
…
..
…
…
…
…
…
…
..
..
m
in
O
b
ję
to
ść
r
o
z
tw
o
ru
z
u
ż
y
te
g
o
d
o
m
ia
re
cz
k
o
w
an
ia
(
0
,1
M
H
C
l)
…
…
..
. .
…
…
…
…
..
…
…
…
.m
l
2
.
O
b
li
cz
y
ć
s
tę
ż
en
ie
a
m
o
n
ia
k
u
(
N
H
3
)
w
p
o
w
ie
tr
z
u
[
%
o
b
j,
m
g
/m
3
,
p
p
m
]
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
..
…
…
.…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
.…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
3
.
W
n
io
sk
i
P
o
ró
w
n
ać
o
tr
z
y
m
an
ą
w
ar
to
ść
s
tę
ż
en
ia
z
an
ie
cz
y
sz
c
z
en
ia
p
o
w
ie
tr
z
a
z
w
ar
to
śc
ią
d
o
p
u
sz
cz
al
n
ą
z
g
o
d
n
ie
z
R
o
z
p
o
rz
ą
d
z
en
ie
m
M
in
is
tr
a
Z
d
ro
w
ia
z
d
n
ia
5
g
ru
d
n
ia
2
0
0
2
r
.

In
st
ru
k
cj
a
la
b
o
ra
to
ry
jn
a
n
r
3
i
4
:
P
o
b
ó
r
p
ró
b
p
o
w
ie
tr
za
i
a
n
al
iz
a
je
g
o
z
an
ie
cz
y
sz
cz
e
ń
C
h
e
m
ia
ś
ro
d
o
w
is
k
a
2
4
Im
ię
i
n
az
w
is
k
o
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
.
D
at
a
…
…
…
…
…
…
…
…
…
…
..
G
ru
p
a…
…
…
…
…
.
N
r
p
ró
b
k
i…
…
…
…
…
..
…
…
…
.
R
a
p
o
rt
d
o
s
p
ra
w
o
zd
a
n
ia
z
l
a
b
o
ra
to
ri
u
m
n
r
3
A
n
a
li
za
S
O
2
w
p
ró
b
ce
z
a
n
ie
cz
y
sz
cz
o
n
eg
o
p
o
w
ie
tr
za
m
et
o
d
ą
j
o
d
o
m
et
ry
cz
n
ą
1
.
W
a
ru
n
k
i
p
o
b
o
ru
p
ró
b
k
i
d
o
a
n
a
li
zy
O
b
ję
to
ść
r
o
z
tw
o
ru
p
o
ch
ła
n
ia
ją
c
e
g
o
(
0
,0
5
M
J
2
)
…
…
…
…
…
…
…
…
…
..
…
..
m
l
O
b
ję
to
ść
b
ad
an
ej
p
ró
b
k
i
…
…
..
…
…
…
…
…
…
…
..
…
m
l
N
at
ę
ż
en
ie
p
rz
ep
ły
w
u
g
az
u
…
…
..
.…
…
…
…
.…
..
.…
d
m
3
/h
C
z
as
p
o
b
o
ru
p
ró
b
k
i
…
…
…
..
…
…
…
…
…
…
..
..
m
in
O
b
ję
to
ść
r
o
z
tw
o
ru
z
u
ż
y
te
g
o
d
o
m
ia
re
cz
k
o
w
an
ia
(
0
,0
2
5
M
N
a
2
S
2
O
3
)
…
…
…
…
..
…
…
…
..
m
l
2
.
O
b
li
cz
y
ć
s
tę
ż
en
ie
d
w
u
tl
en
k
u
s
ia
rk
i
(S
O
2
)
w
p
o
w
ie
tr
zu
[
%
o
b
j,
m
g
/m
3
,
p
p
m
]
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
..
…
…
.…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
.…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
3
.
W
n
io
sk
i
P
o
ró
w
n
ać
o
tr
z
y
m
an
ą
w
ar
to
ść
s
tę
ż
en
ia
z
an
ie
cz
y
sz
c
z
en
ia
p
o
w
ie
tr
z
a
z
w
ar
to
śc
ią
d
o
p
u
sz
cz
al
n
ą
z
g
o
d
n
ie
z
R
o
z
p
o
rz
ą
d
z
en
ie
m
M
in
is
tr
a
Z
d
ro
w
ia
z
d
n
ia
5
g
ru
d
n
ia
2
0
0
2
r
.
In
st
ru
k
cj
a
la
b
o
ra
to
ry
jn
a
n
r
3
i
4
:
P
o
b
ó
r
p
ró
b
p
o
w
ie
tr
za
i
a
n
al
iz
a
je
g
o
z
an
ie
cz
y
sz
cz
e
ń
C
h
e
m
ia
ś
ro
d
o
w
is
k
a
2
5
Im
ię
i
n
az
w
is
k
o
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
.
D
at
a
…
…
…
…
…
…
…
…
…
…
..
G
ru
p
a…
…
…
…
…
.
N
r
p
ró
b
k
i…
…
…
…
…
..
…
…
…
.
R
a
p
o
rt
d
o
s
p
ra
w
o
zd
a
n
ia
z
l
a
b
o
ra
to
ri
u
m
n
r
4
A
n
a
li
za
d
w
u
tl
en
k
u
a
zo
tu
N
O
2
w
p
ró
b
ce
z
a
n
ie
cz
y
sz
cz
o
n
eg
o
p
o
w
ie
tr
za
(m
et
o
d
a
k
o
lo
ry
m
et
ry
cz
n
a
)
1
.
W
a
ru
n
k
i
p
o
b
o
ru
p
ró
b
k
i
d
o
a
n
a
li
zy
N
at
ę
ż
en
ie
p
rz
ep
ły
w
u
g
az
u
…
…
..
.…
…
…
…
.…
..
.…
d
m
3
/h
O
b
ję
to
ść
p
rz
ep
u
sz
cz
o
n
eg
o
p
o
w
ie
tr
z
a
…
…
…
..
…
…
…
…
…
…
..
..
d
m
3
N
r
p
ró
b
y
Z
a
w
a
rt
o
ść
N
O
2
m
g
N
O
2
/5
c
m
3
w
zo
rc
a
W
a
rt
o
ść
a
b
so
rb
a
n
cj
i
1
0
,0
0
0
0
2
0
,0
0
0
2
3
0
,0
0
0
3
4
0
,0
0
0
4
5
0
,0
0
0
6
6
0
,0
0
0
8
7
0
,0
0
1
0
8
0
,0
0
1
3
9
0
,0
0
1
6
1
0
0
,0
0
2
0
a
n
a
li
za
2
.
O
b
li
cz
y
ć
s
tę
ż
en
ie
d
w
u
tl
en
k
u
a
z
o
tu
N
O
2
w
p
o
w
ie
tr
z
u
[
%
o
b
j,
m
g
/m
3
,
p
p
m
]
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
..
…
…
.…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
.…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
…
3
.
W
n
io
sk
i
P
o
ró
w
n
ać
o
tr
z
y
m
an
ą
w
ar
to
ść
s
tę
ż
en
ia
z
an
ie
cz
y
sz
c
z
en
ia
p
o
w
ie
tr
z
a
z
w
ar
to
śc
ią
d
o
p
u
sz
cz
al
n
ą
z
g
o
d
n
ie
z
R
o
z
p
o
rz
ą
d
z
en
ie
m
M
in
is
tr
a
Z
d
ro
w
ia
z
d
n
ia
5
g
ru
d
n
ia
2
0
0
2
r
.
Wyszukiwarka
Podobne podstrony:
Analizy środowiskowe badania zanieczyszczeń powietrza
Chemiczna Analiza ZanieczyszczeńĆW wody, powietrza i gleby
Zanieczyszczenie powietrza 2
11 Główne zanieczyszczenia powietrza atmosferycznego klasyfikacja, źródł
Zadanie z zanieczyszczenia powietrza(2) (1)
Zanieczyszczenia powietrza
zanieczyszczenie powietrza
Ściągi, Angielski 4, air pollution zanieczyszczenie powietrza alternative energy energia alternatywn
Emisje Głównych Zanieczyszczeń Powietrza W Polsce I Wpływ Na Środowisko Prezentacja (Juda Rezle
podział zanieczyszczeń powietrza
Zanieczyszczenie powietrza 1
11 2 4 Zanieczyszczenia powietrza
Szkol Zanieczyszczenia powietrza
Niekorzystne zjawiska zanieczyszczenie powietrza
Cw 11 Analiza mikrobiologiczna POWIET
więcej podobnych podstron