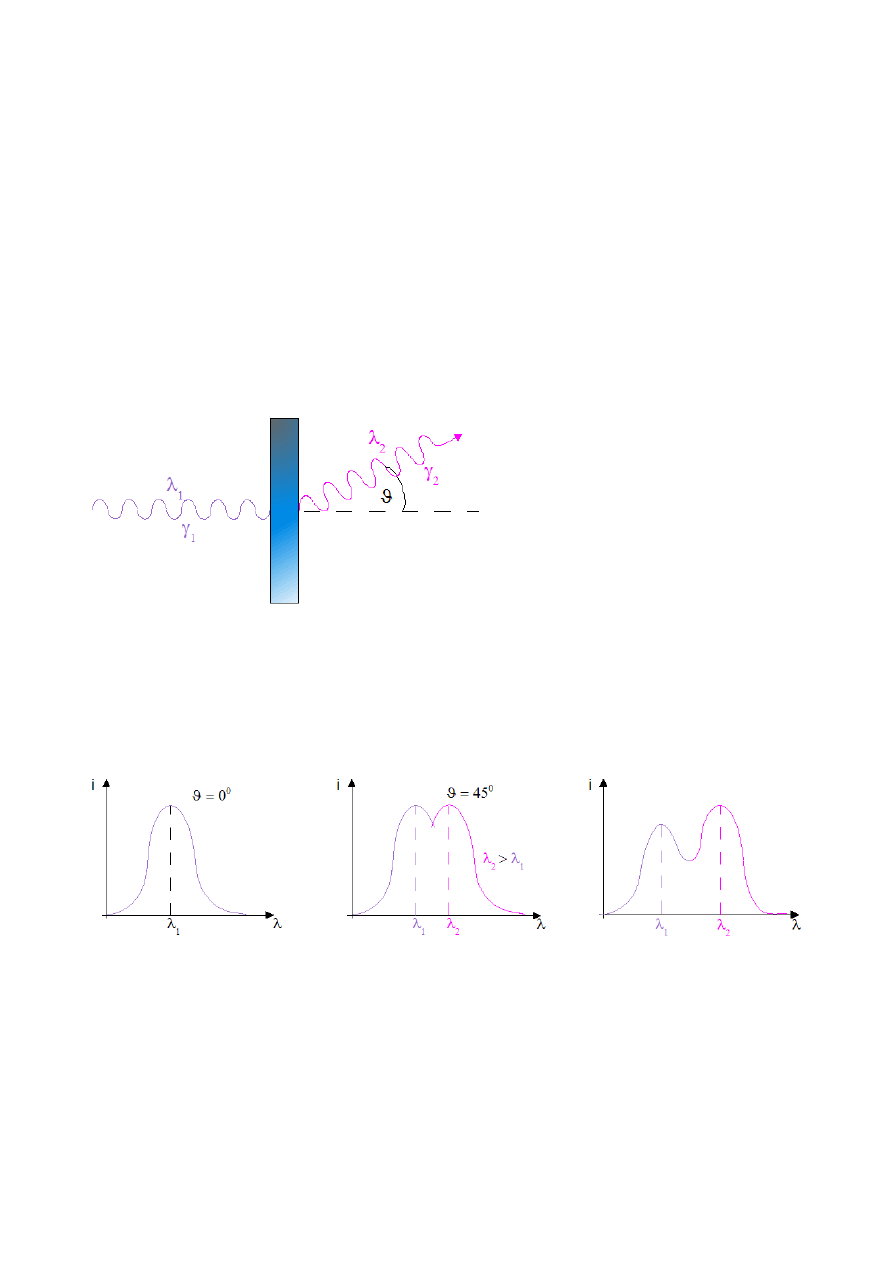
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
III.
EFEKT COMPTONA (1923)
Zjawisko zmiany długości fali promieniowania roentgenowskiego rozpraszanego na
swobodnych elektronach.
Zjawisko to stoi u podstaw mechaniki kwantowej.
III.1. EFEKT COMPTONA
Rys.III.1. Rozpraszanie kwantu
γ
na tarczy.
Compton badał rozpraszanie promieniowania roetgenowskiego na tarczy.
I – natężenie promieniowania roentgenowskiego po przejściu przez folię metalową
Rys.III.2. Zależność natężenia promieniowania Rtg po przejściu przez folię od długości fali promieniowania.
=
2
−
1
= f
– nie zależy od długości fali
promieniowanie Rtg – jego energia 10000-100000eV
–
rozpraszanie ma miejsce na elektronach swobodnych (tzw. elektronach przewodzenia
– 1 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
lub walencyjnych)
Siły wiązań metalicznych – elektron swobodny odrywa się od atomu, tworzy gaz
elektronowy.
Równanie Comptona:
= 1−cos
(III.1.1a)
= 2 sin
2
2
(III.1.1b)
Λ – comptonowska długość fali
=
h
m
0
c
= 0,0242 Å
(III.1.2)
E
= hf
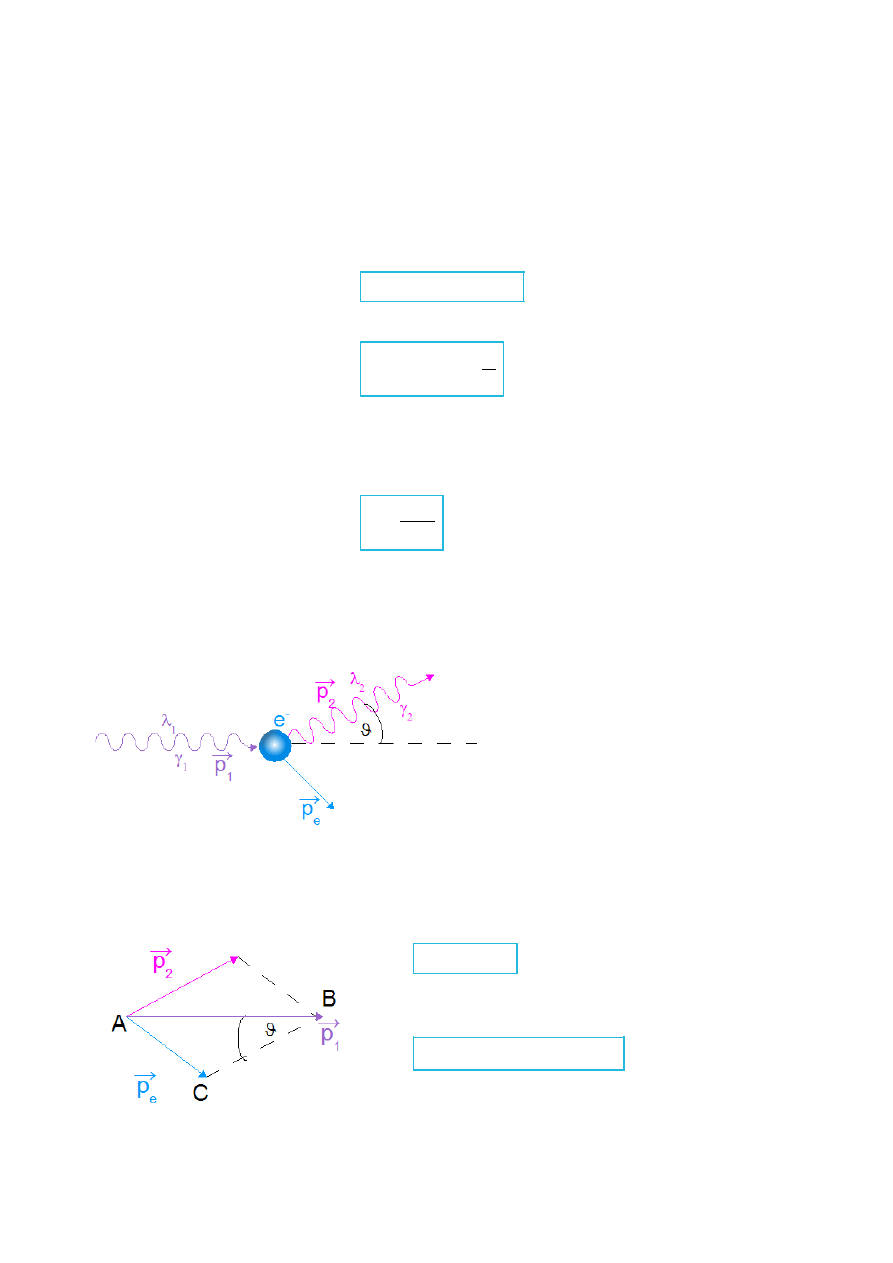
Compton światło traktował jak strumień fotonów.
p
e
- pęd elektronu, który uzyskuje
po zderzeniu z fotonem
Rys.III.3. Zderzenie fotonu z elektronem. Po zderzeniu foton częściowo przekazuje swój pęd elektronowi.
–
prawo zachowania pędu:
p
1
= p
2
p
e
(III.1.3)
z prawa cosinusów:
p
e
2
= p
1
2
p
2
2
−2p
1
p
2
cos
(III.1.4)
Rys.III.4. Interpretacja wektorowa prawa zachowania pędu.
– 2 –
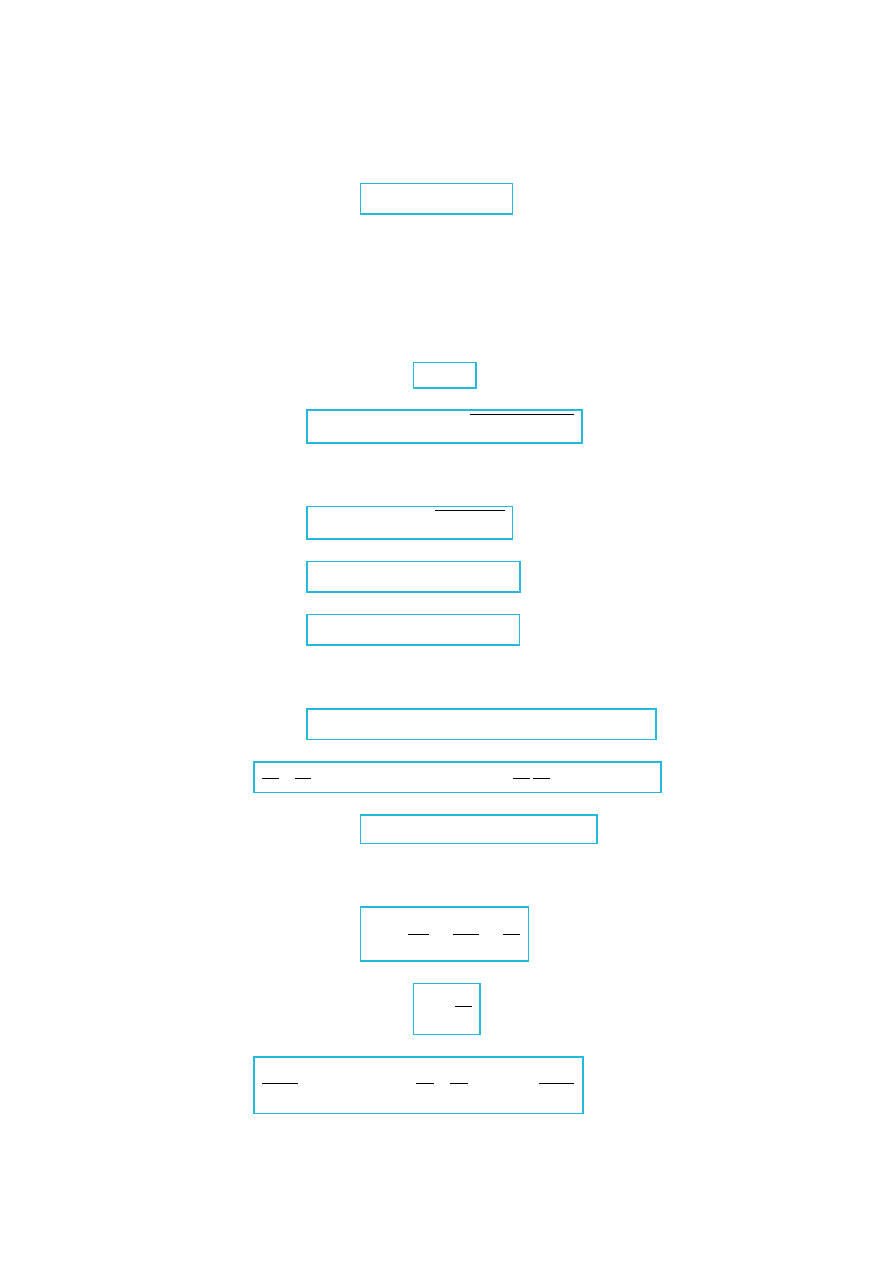
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
–
prawo zachowania energii:
E
2
= c
2
p
2
m
0
c
2
2
(III.1.5)
dla fotonu:
m
0
= 0
(masa spoczynkowa)
z (III.1.5) wynika:
E = pc
(III.1.6)
p
1
c
m
0
c
2
= p
2
c
p
e
2
c
2
m
0
c
2
2
(III.1.7)
Wyprowadzimy równania Comptona z zależności (III.1.7):
p
1
m
0
c = p
2
p
e
2
m
0
2
c
2
(III.1.7a)
p
1
− p
2
m
0
c
2
= p
e
2
m
0
2
c
2
(III.1.7b)
p
e
2
=
p
1
− p
2
m
0
c
2
−m
0
2
c
2
(III.1.7c)
Z (III.1.4) i (III.1.7c) wynika:
p
1
− p
2
m
0
c
2
−m
0
2
c
2
= p
1
2
p
2
2
−2 p
1
p
2
cos
(III.1.8)
p
1
2
p
2
2
−2 p
1
p
2
2 m
0
c
p
1
− p
2
= p
1
2
p
2
2
−2 p
1
p
2
cos
(III.1.8a)
p
1
p
2
1−cos= p
1
− p
2
m
0
c
(III.1.9)
Na podstawie postulatu Plancka:
p
1
=
E
1
c
=
hf
1
c
=
h
1
(III.1.10a)
p
2
=
h
2
(III.1.10b)
h
2
1
2
1−cos = h
1
1
−
1
2
m
0
c
/⋅
1
2
h
2
(III.1.11)
– 3 –

K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
1
−cos =
m
0
c
h
2
−
1
/⋅
h
m
0
c
(III.1.12)
Otrzymaliśmy równanie (1b):
2
−
1
=
h
m
0
c
1−cos
(III.1.13)
1
:
= 0 =
h
m
0
c
= 0 <=> m
0
∞
Rozpraszanie na elektronach związanych.
Dualna natura światła – w różnych warunkach obserwujemy jego naturę:
–
falową (dyfrakcja, interferencja)
–
światło zachowuje się jak strumień cząstek.
Doświadczenie Comptona potwierdza fakt, że materia składa się z elektronów. Powstał
problem struktury atomu. Stwierdzono , że atomy składają się co najmniej z elektronów,
wykazano również jaki jest ładunek elektronu. Z drugiej strony wiedziano, że atom jest
elektrycznie obojętny, wynikało z tego, że muszą istnieć cząstki dodatnie wchodzące w
skład atomu.
III.2. KONCEPCJA BUDOWY ATOMU.
–
problem ładunku dodatniego (gdzie jest zlokalizowany, co go stanowi)
–
problem masy ( gdzie jest zlokalizowana i co stanowi masę atomu )
m
e
=
m
H
+
1836
– jest zbyt mały, by wytłumaczyć masę atomu
Model Thomsona
–
równomiernie naładowana sfera ładunkiem dodatnim z elektronami
r
~10
-10
m
q =
∣e∣⋅Z
– 4 –
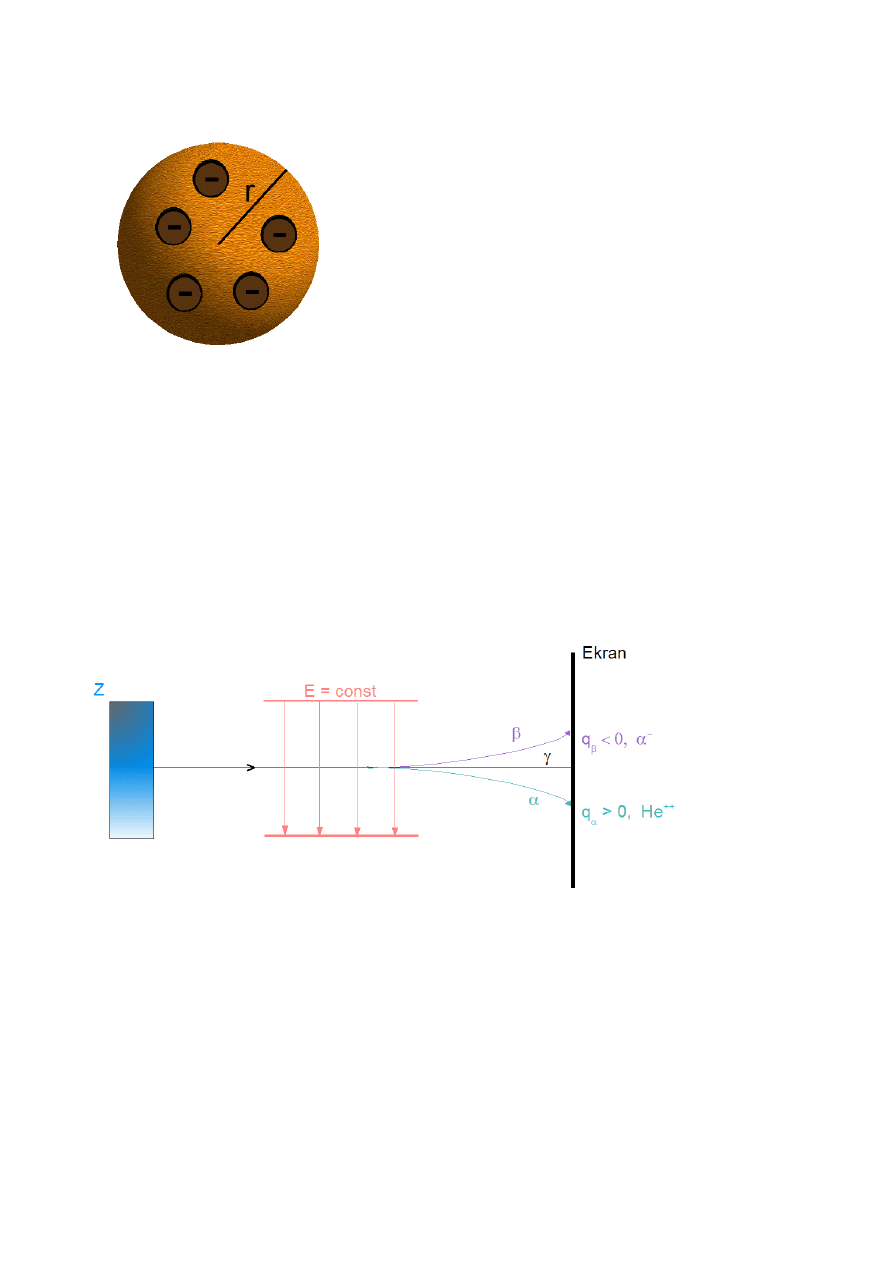
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
Rys.III.5. “Plum pudding model” (“ciasto z rodzynkami”) – model atomu Thomsona.
Weryfikacja modelu
Rutherford (1911) – poprzez swoje doświadczenie (rozpraszanie cząstek α) wykluczył
model Thomsona.
Cząstki α:
Becquerel odkrył, że rudy uranu wysyłają “tajemnicze” promieniowanie.
–
Składową naładowaną elektrycznie można zidentyfikować badając nań wpływ pola
E
lub
B
.
Rys.III.6. Wpływ pola elektrycznego na promieniowanie rudy uranu (Z)
γ
– emitowane zawsze gdy jądra atomowe są w stanie wzbudzonym
To samo można zrobić w polu magnetycznym
F
B
=q v×B
F
B
⊥v , B
.
Różnica jest taka, że odchylenie następuje w płaszczyźnie prostopadłej do kartki.
Rutherford badał prawdopodobieństwo rozproszenia cząstek α.
– 5 –

K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
Ra - Rad
K - kolimator
D – detektor (ZnS)
Rys.III.7. Ilustracja graficzna doświadczenia Rutherforda.
max
e
=
q
~10
-4
rad
90
0
≤≤180
0
- cząstki rozproszone do tyłu
N
≥90
0
N
~10
-4
–
niemożliwe, żeby cząstka została rozproszona do tyłu, gdyby model Thomsona był
rzeczywisty, z tego wynika, że model atomu Rutherforda jest lepszym
–
koncepcja jądra atomowego – ulokowane w centralnej części atomu
–
masa atomu związana z ładunkiem dodatnim
Rutherford wyprowadził następującą formułę:
N
d =
8
N
t
zZe
2
1
2
Mv
2
2
sin
sin
4
2
d
(III.2.1)
Liczba cząstek α rozproszonych pod kątem
w kąt bryłowy
d
.
t – grubość tarczy
M – Masa cząstki α
=>
1
2
M v
2
=E
k
v – jej prędkość
– 6 –
K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
ze
=q
, Ze
=q
Doświadczenie wykonywał stosując różne źródła cząstek α (dzięki czemu dysponował
cząstkami α o różnej energii kinetycznej) oraz tarcze o różnej grubości.
Eksperymentalnie stwierdził, że:
~t
~
1
E
k
Na podstawie otrzymanych wyników wyliczył ładunek jądra i stwierdził, że jest on równy
liczbie porządkowej w tablicy Mendelejewa.
Nierozwiązany problem: rozmiar jądra atomowego.
Rutherford oszacował rozmiar jądra atomowego:
R
=
D
2
1
1
sin
2
D
=
zZe
2
1
2
Mv
2
D – odległość najbliższego zbliżenia (zderzenie centralne)
R jest równe D gdy cząstka jest rozproszona do tyłu (
=180
0
)
Dla
Cu
29
63
:
R
=
180
0
1,7
⋅10
-14
m
–
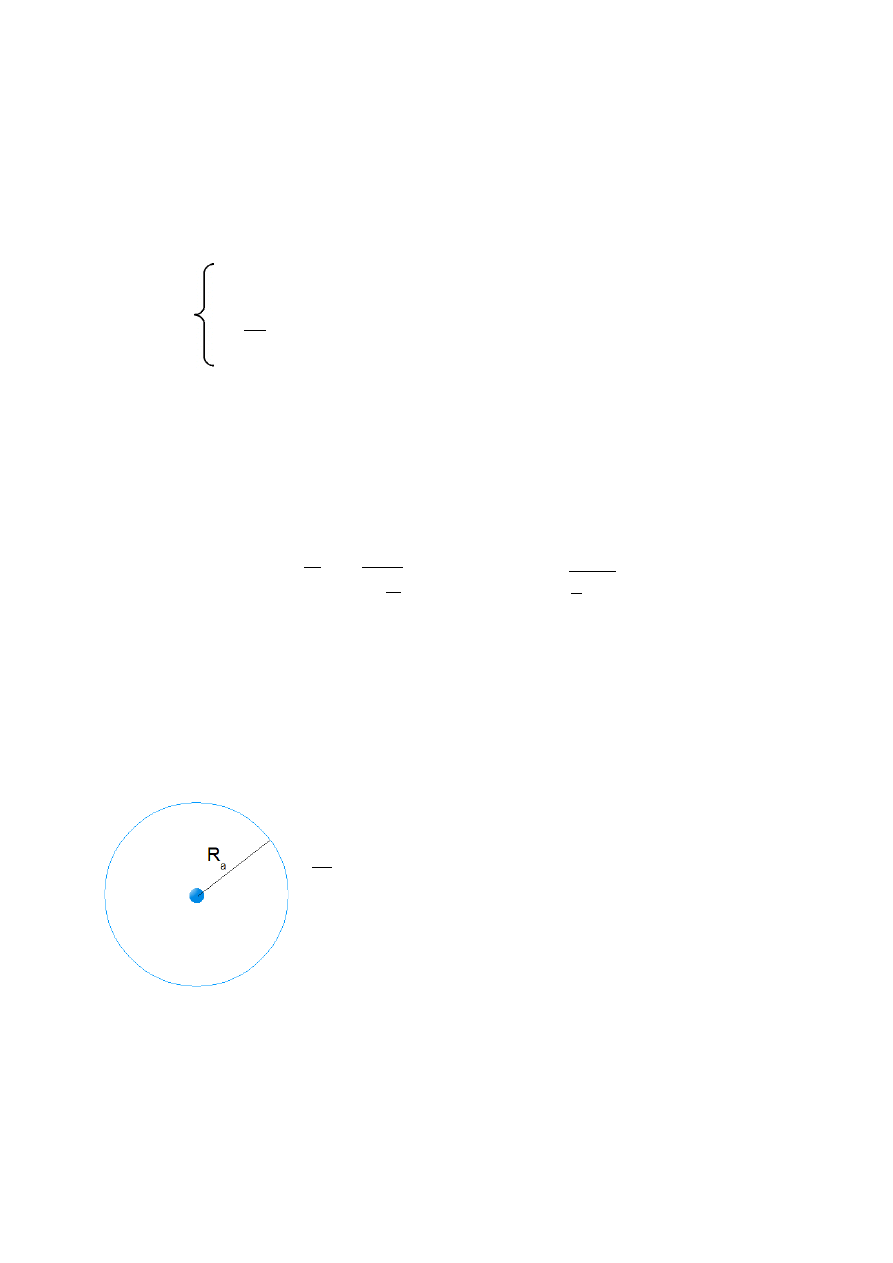
jądro atomu jest 10 tys. razy mniejsze od całego atomu.
R
a
R
=10
4
, R
a
– promień atomu, R – promień jądra
–
atom jest pusty (praktycznie cała materia skupiona jest w
jądrze)
analogia: pestka wiśni na środku stadionu piłkarskiego
Rys.III.8. Model atomu Rutherforda.
Problemem nie rozwiązanym przez Rutherforda była lokalizacja elektronów. Nie mogą być
one ulokowane w jądrze ani na jego powierzchni, bo atom byłby bardzo mały.
Przypuszczał, że elektrony mogą być rozmieszczone na orbitach.
– 7 –
N
d =

K.Czopek, M.Zazulak – Notatki w internecie. Wstęp do fizyki atomowej i kwantowej.
Gdyby elektrony sie nie poruszały, to siła kulombowska przyciągnęłaby je do jądra,
natomiast gdy się poruszają, ładunek doznaje przyspieszenia, a więc traci energię,czyli
prędzej czy później spadałyby emitując promieniowanie o ciągłym widmie.
Mimo, iż Rutherford przypuszczał, że elektrony są na orbitach, nie rozwiązał problemu
stabilności atomu.
– 8 –
Wyszukiwarka
Podobne podstrony:
i4 promieniowanie x efekt comptona
Efekt Comptona(1)
Egzamin - sciagi, 31. Zjawisko fotolelktryczne i efekt Comptona, 31
efekt comptona2, Akademia Morska Szczecin, SEMESTR II, Fizyka, sciaga fiza
Oddziaływanie promieniowania X i gamma z materią – efekt fotoelektryczny, efekt Comptona, tworzenie
i4 promieniowanie x efekt comptona
kaczmarek,elektronika ciała stałego,Efekt Comptona
03 Sejsmika04 plytkieid 4624 ppt
03 Odświeżanie pamięci DRAMid 4244 ppt
podrecznik 2 18 03 05
od Elwiry, prawo gospodarcze 03
Probl inter i kard 06'03
TT Sem III 14 03
więcej podobnych podstron