
Materia y wi
ce w zale no ci od mechanizmu wi zania
dzielimy na:
Spoiwa
– wi
ce w wyniku reakcji chemicznej
Lepiszcza
– wi
ce w wyniku przemiany fizycznej np. krzepni cia lub
odparowania rozpuszczalnika
Spoiwa
ywiczne
utwardzane wed ug reakcji polimeryzacji bez
wydzielania produktu ubocznego lub wed ug reakcji polikondensacji z
wydzieleniem produktu ubocznego, np. wody

ówne spoiwa mineralne to:
CEMENT, WAPNO I GIPS
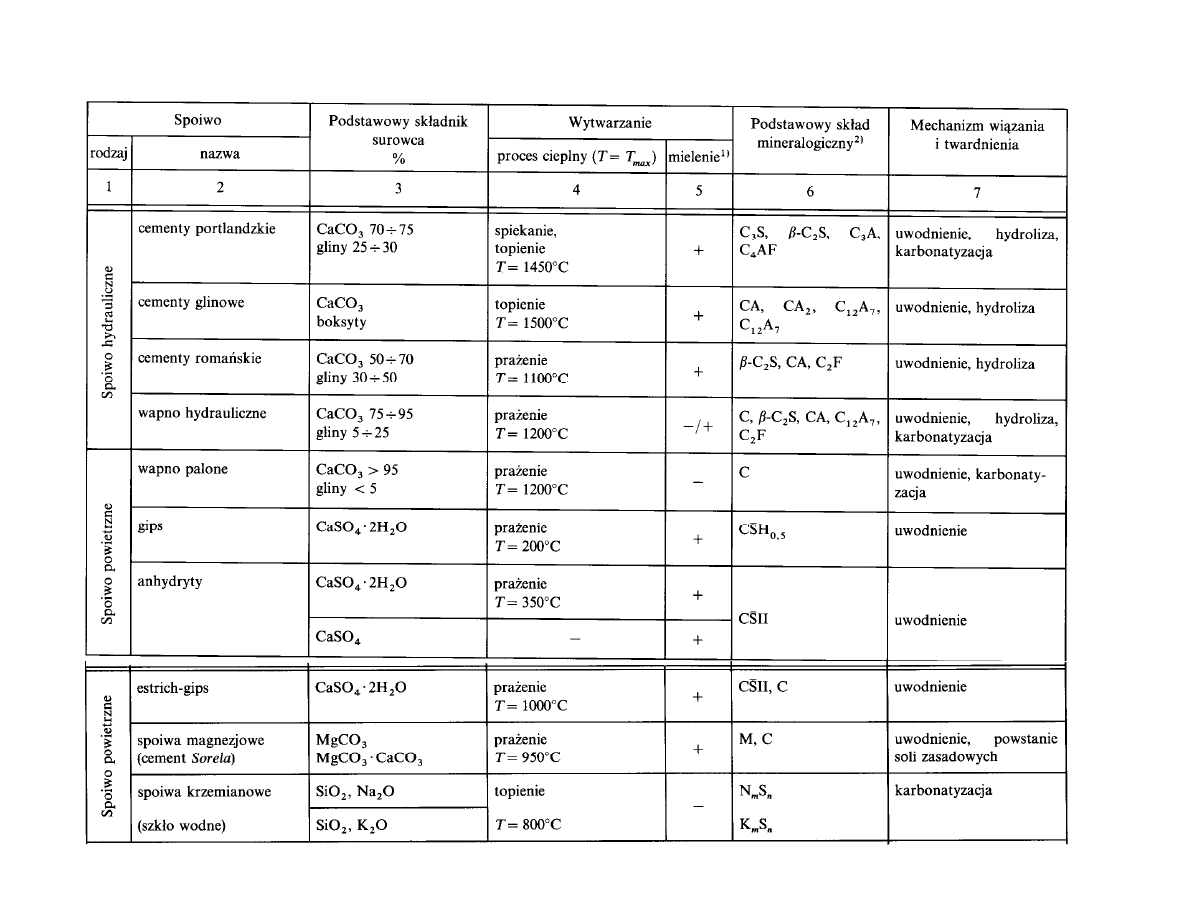
Spoiwa mineralne mo na podzieli wed ug:
- podstawowego sk adu chemicznego surowca: wapniowe, siarczanowo-
gipsowe i magnezjowe
- rodzaju procesu cieplnego (wypalanie), wyst puj cego podczas
wytwarzania spoiw: pra enie, spiekanie, topienie
- zachowanie si
rodowisku wody:
spoiwa powietrzne
– twardniej ce
na powietrzu,
spoiwa hydrauliczne
– twardniej ce w powietrzu i w
wodzie
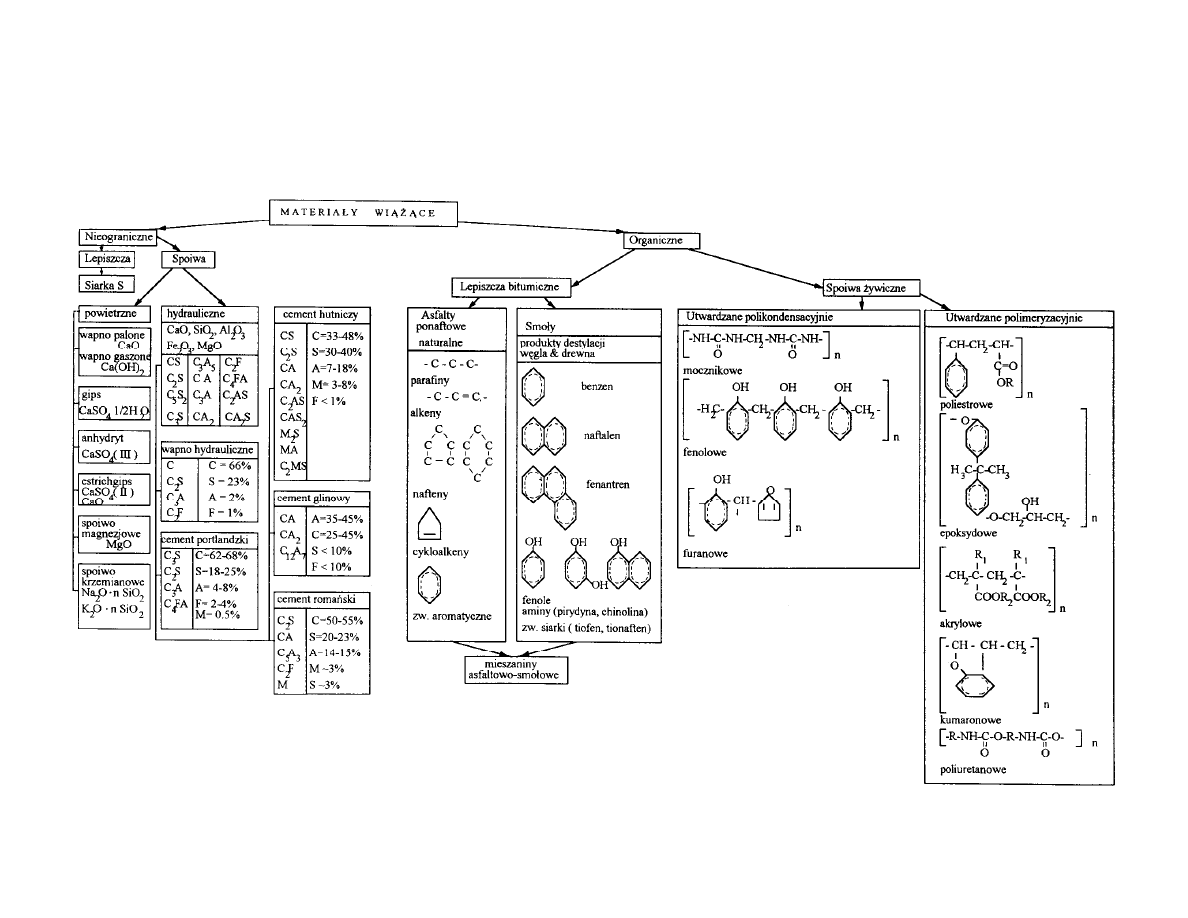
Ogólny podzia materia ów wi
cych

Wynalazca angielski, z zawodu murarz z Leeds (1779-1855).
21 pa dziernika 1824 roku zg osi patent na "sztuczny
kamie " czyli cement (wynaleziony ju by mo e w roku
1811), który nazwa portlandzkim - Nazwa "cement
portlandzki" nasun a si Aspdinowi ze wzgl du na wielkie
podobie stwo jego "sztucznego kamienia" do kamienia z
okolic Portlandu, powszechnie wówczas stosowanego w
angielskim budownictwie. Pocz tkowo wynalazek znalaz
zastosowanie jedynie do robót tynkarskich. Pierwsz wielk
budow , do której go u yto, by
ynny tunel pod Tamiz ,
zbudowany w latach 1825-1843 przez Marca I. Brunela.
Podstawowe surowce do wyrobu cementu portlandzkiego
- wapie i glina
- lub margle czyli ska y b
ce mieszanin tych dwóch sk adników
- dla uzupe nienia ewentualnego niedoboru SiO
2
w postaci piasku kwarcowego
- Fe
2
O
3
w postaci rudy elaza i (lub)
li hutniczych
Bo zmieleniu i mieszaniu otrzymuje si tzw.
czki surowej
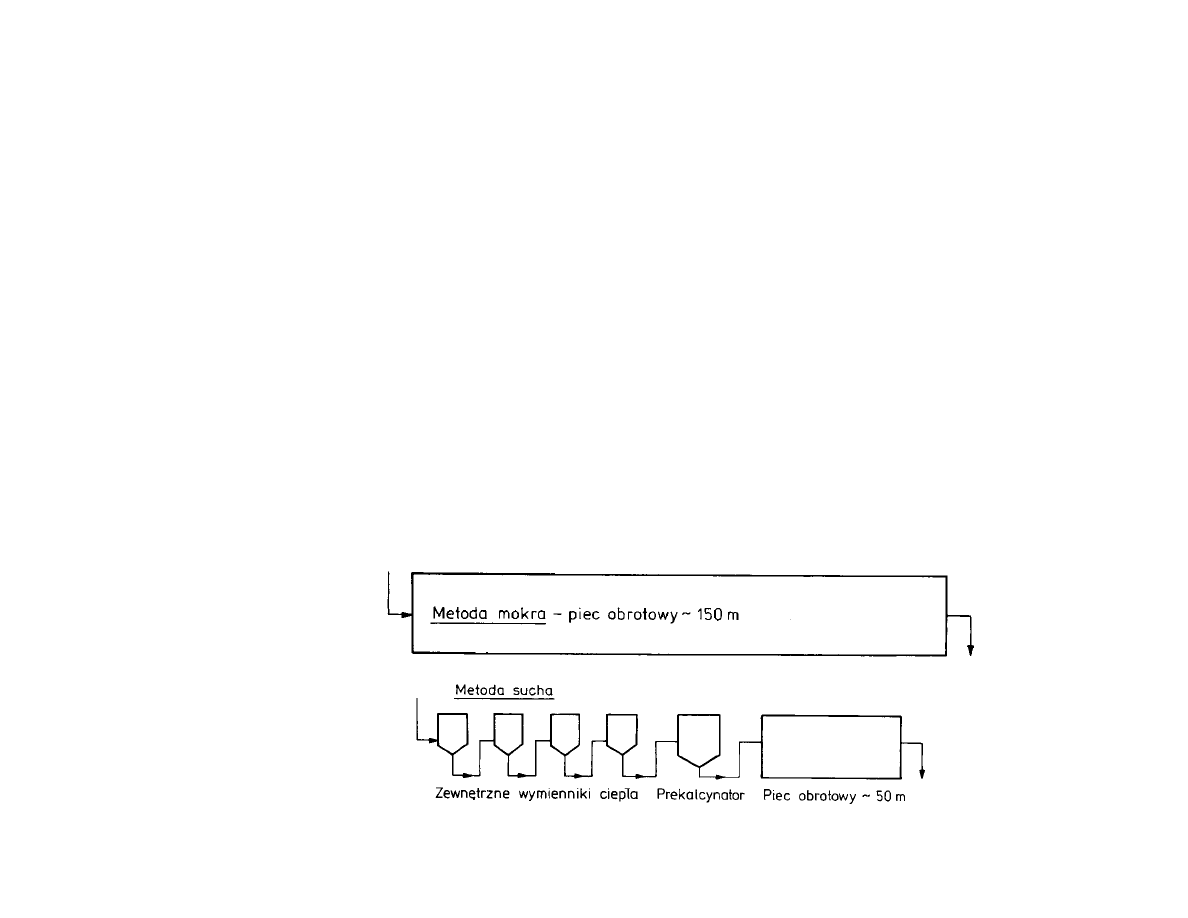
Metody otrzymywania cementu:
- metoda sucha
- metoda mokra
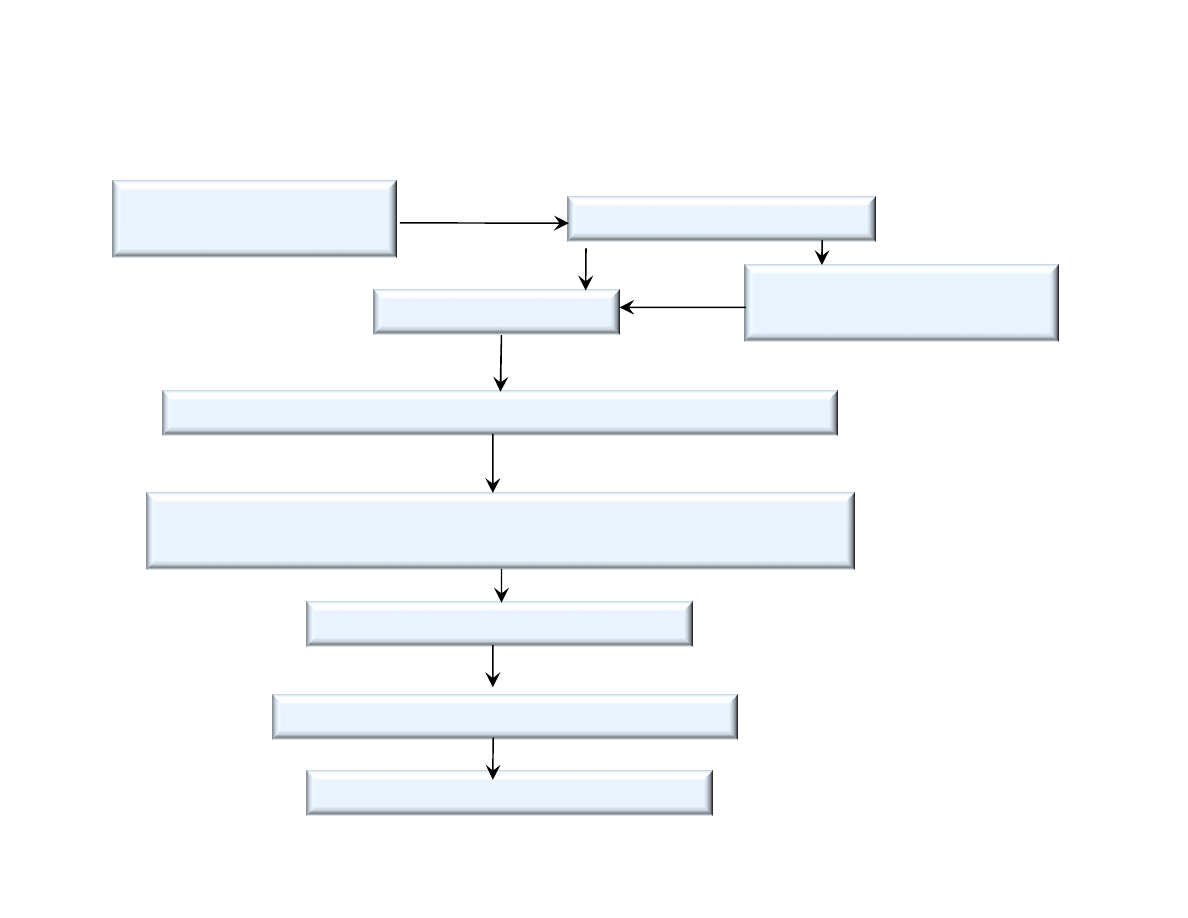
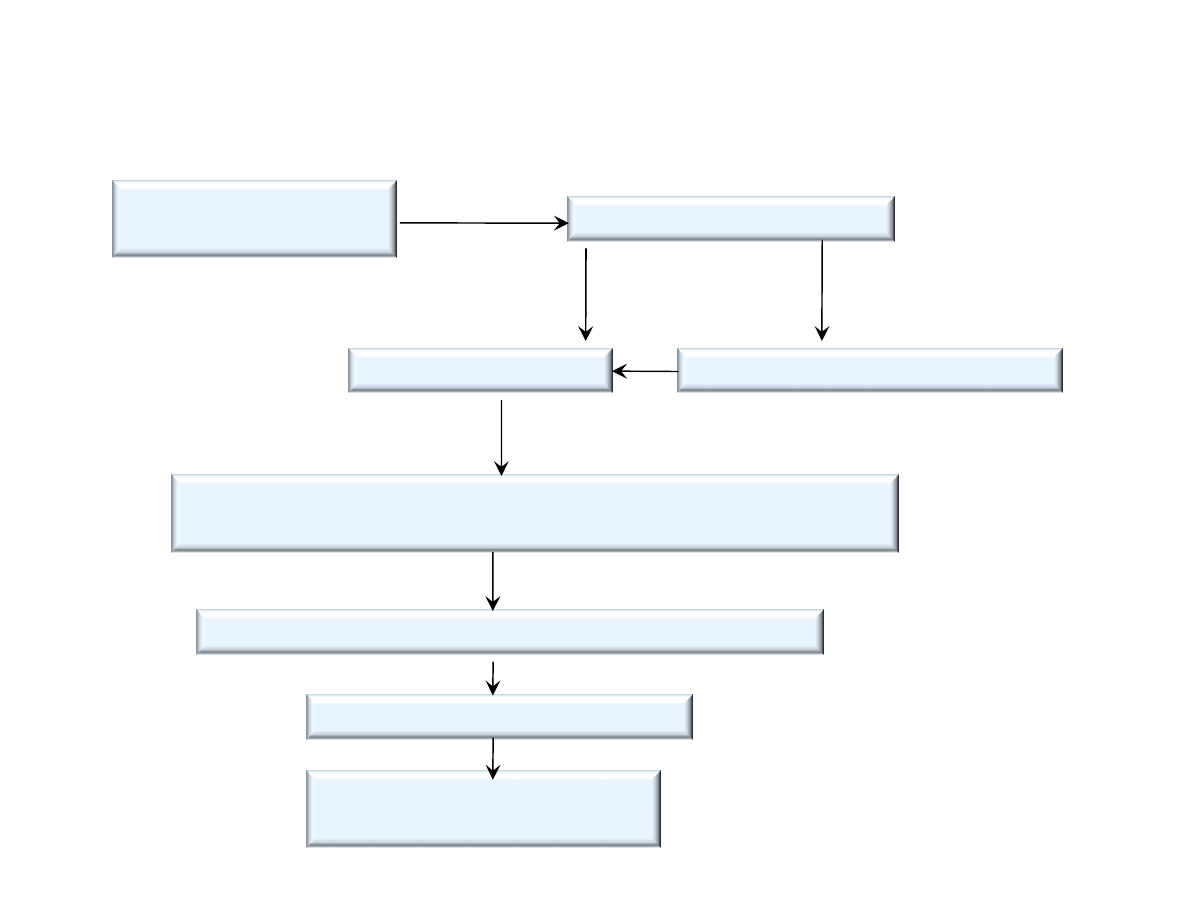
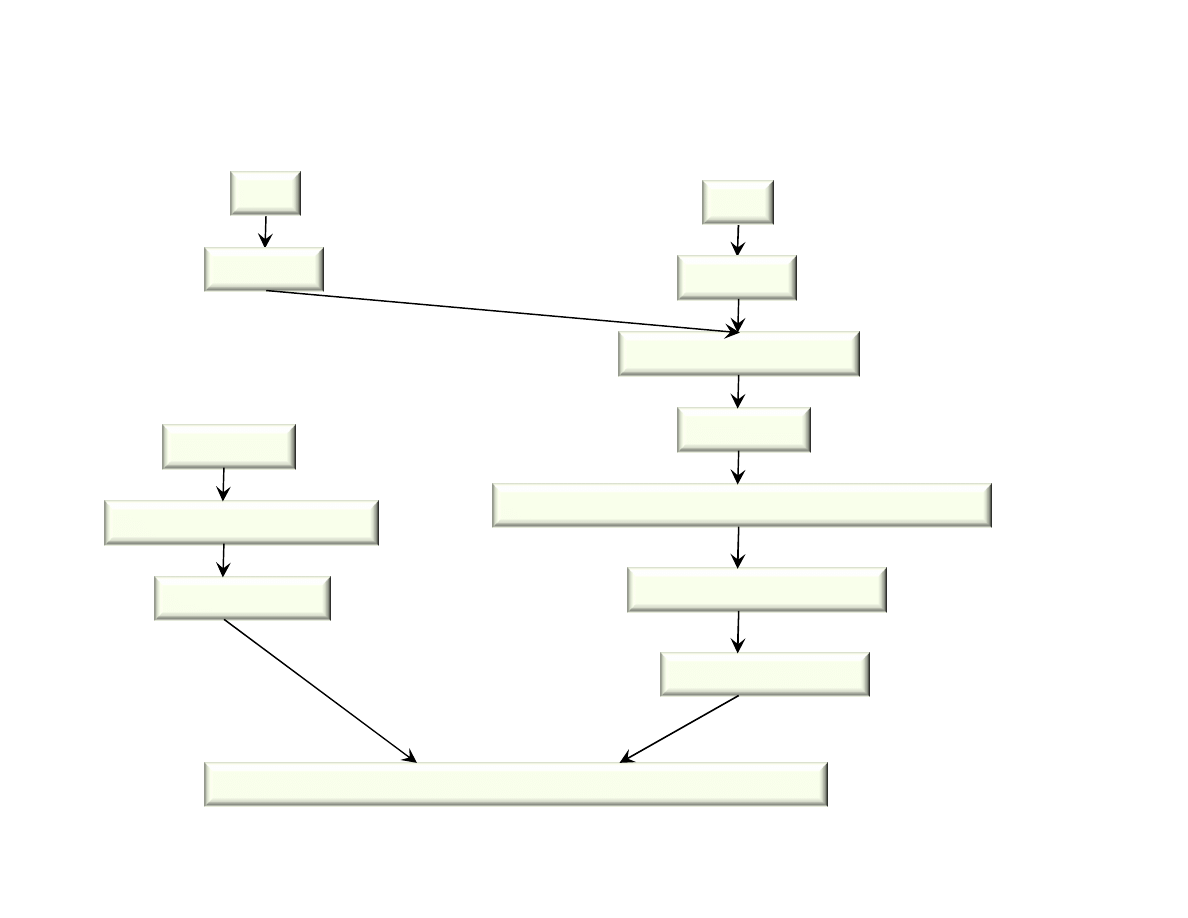
Schemat produkcji cementu portlandzkiego metod mokr
Wydobycie i transport
surowców
Rozdrabnianie wst pne
Sk adowanie – homogenizowanie szlamu w basenach
Wypalanie – klinkieryzacja
w piecach obrotowych, o rednicy ok. 5 m, d ugo ci 180 .
Mielenie klinkieru z dodatkami
Pakowanie w worki, ekspedycja
Mielenie na mokro
Szlamowanie surowców
(ok. 40% wody)
Magazynowanie cementu w silosach
Schemat produkcji cementu portlandzkiego metod such
Wydobycie i transport
surowców
Rozdrabnianie surowców
Magazynowanie m czki z homogenizacj (pneumatyczn )
Korekta sk adu, ew. granulowanie wsadu do pieca
Wypalanie, piec o rednicy 4,5 – 5 m, d . 70-90 m.
Mielenie klinkieru z dodatkami
Ekspedycja cementu luzem
i/lub pakowanie
Mielenie na m czk
Suszenie do wilgotno ci 1-2%

Cementownia O arów

Szkodliwe s :
-
zwi zki siarki i magnezu
, powoduj zmiany obj to ci i p kanie betonów
-
zwi zki manganu
, obni aj wytrzyma
zapraw i betonów
-
zwi zki fosforu
zmniejszaj szybko wi zania i twardnienia spoiw
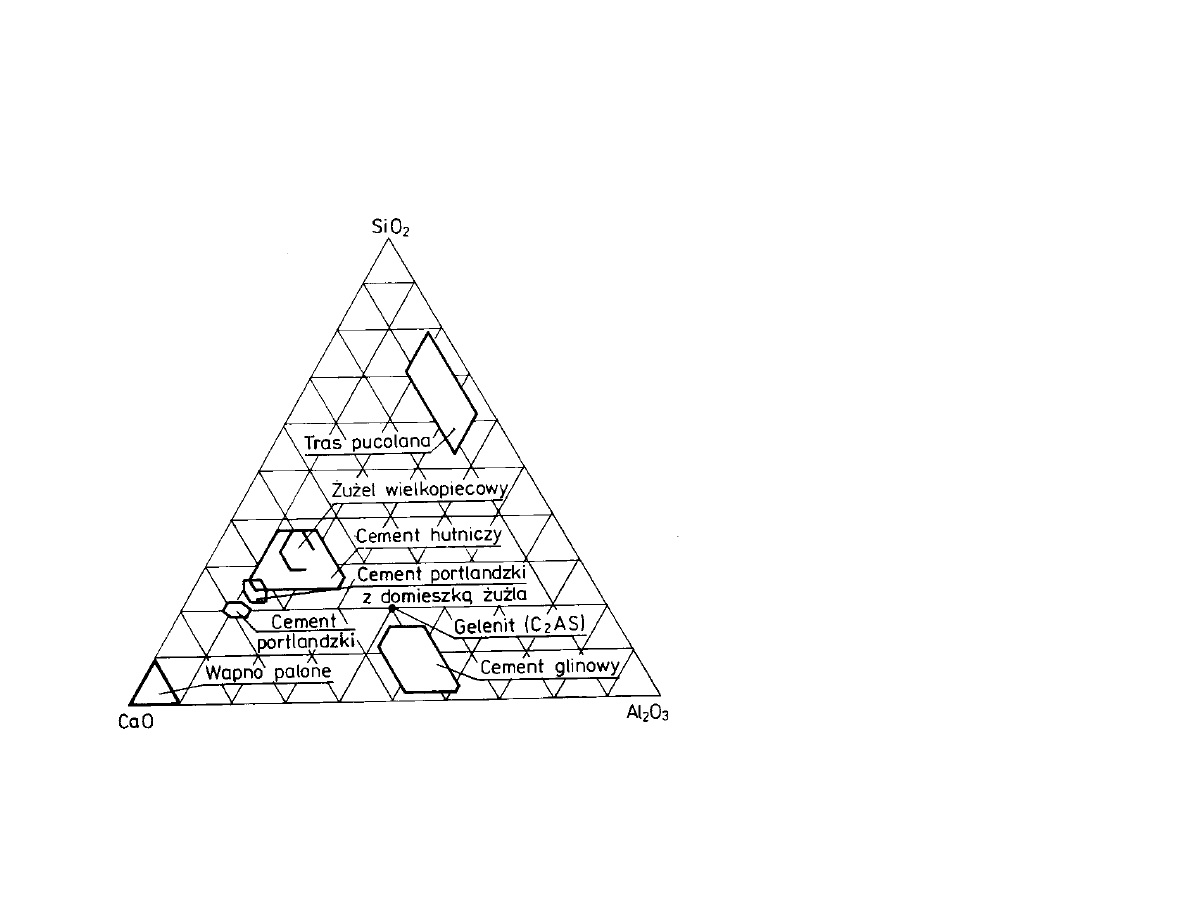
Dopuszczalna zmienno sk adu materia owego jest stosunkowo
niewielka, okre lona przez równowag fazow : CaO – Al
2
O
3
– SiO
2
Uk ad CaO-Al
2
O
3
-SiO
2
diagram Rankina-Fereta

Sk adniki naturalne
Sk ad chemiczny
Sk adnik
% wag.
sk adnik
% wag.
Kamie wapienny
80-85
CaO
58-67
Glina
10-20
Al
2
O
3
16-26
Piasek kwarcowy
< 10
SiO
2
4-8
Ruda elaza (
le hutnicze)
< 5
Fe
2
O
3
2-4
Sk ad surowej m czki cementowej
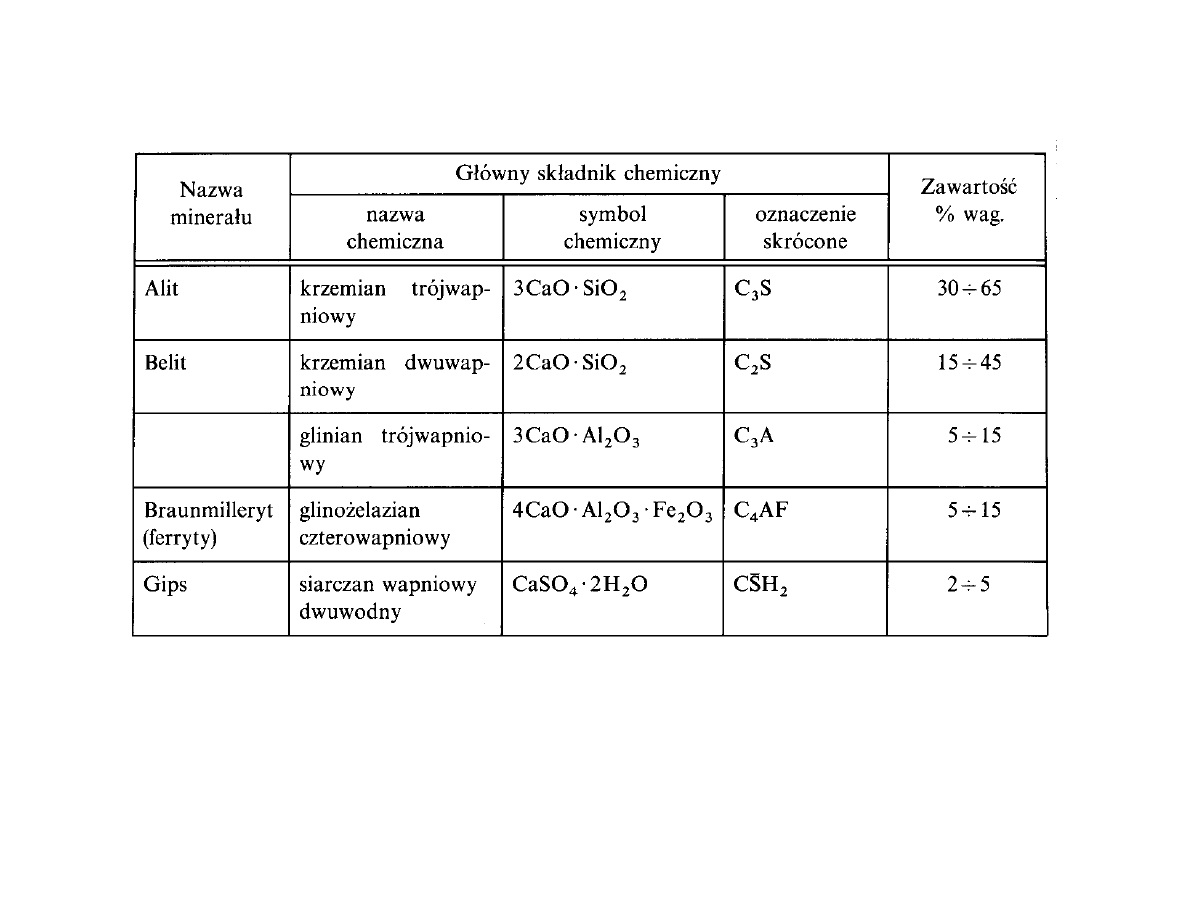
Sk ad mineralogiczny cementu portlandzkiego
Najwa niejszym minera em klinkieru jest krzemian trójwapniowy C
3
S – alit, nadaj cy najwy sz
wytrzyma
pocz tkow kompozytom cementowym.
Krzemian dwuwapniowy C
2
S – belit ma wp yw na pó niejsze narastanie wytrzyma
ci.
Substancja mi dzyziarnowa wype niaj ca przestrzenie mi dzy kryszta ami alitu i belitu sk ada
si z C
3
A (substancja ciemniejsza) i C
4
AF (substancja ja niejsza)
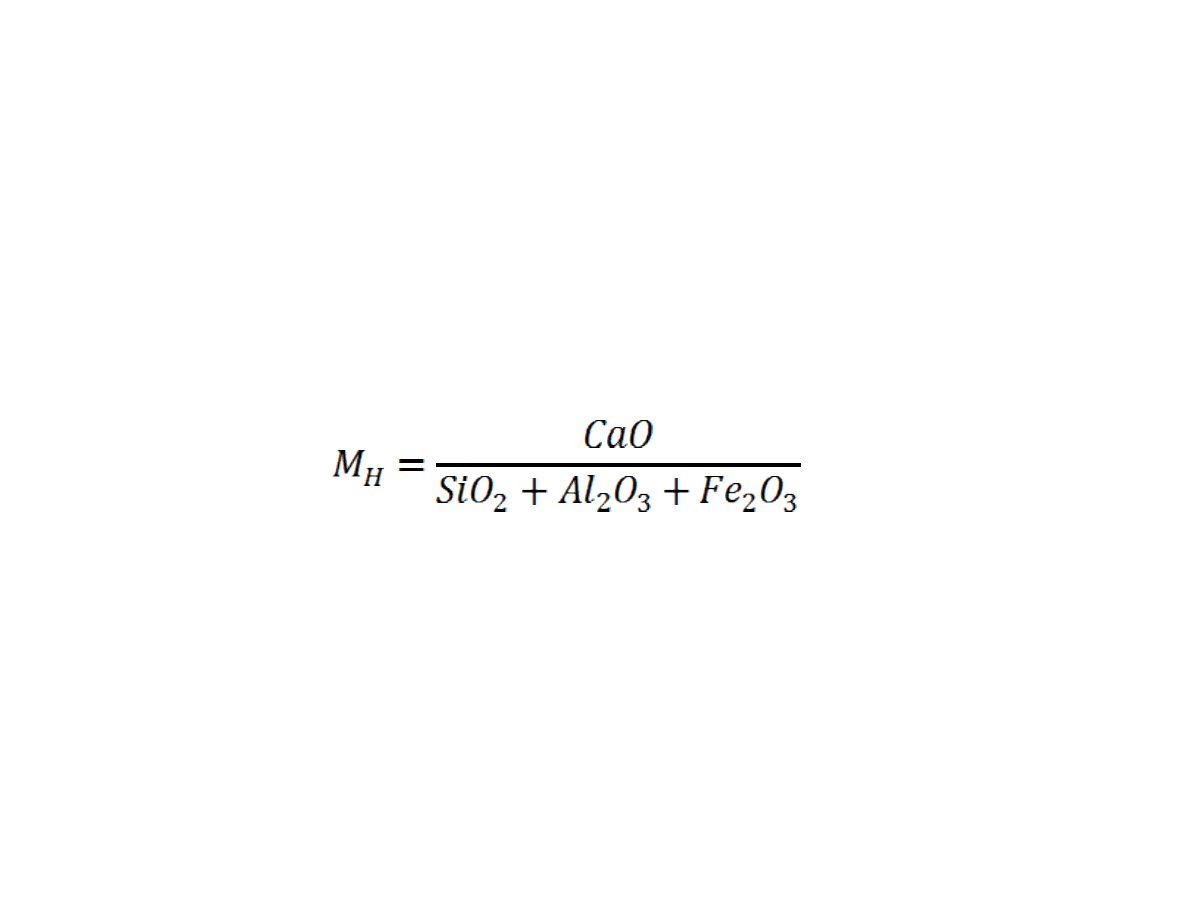
Znaj c sk ad chemiczny cementu, mo na obliczy stosunek ilo ci tlenku
wapniowego do sumy tlenków krzemu, glinu i elaza. Stosunek ten
nazywamy
modu em hydraulicznym
Cement o M
H
poni ej 1,7 wykazuj niedostateczn wytrzyma
mechaniczn , za cement o M
H
powy ej 2,3 maj niedostateczn sta
obj to ci. Ze wzrostem M
H
wzrasta wytrzyma
, zw aszcza pocz tkowa, ale
ro nie te ilo ciep a potrzebna do wypa u, a z kolei zmniejsza si odporno
na agresj chemiczn . Wszystkie spoiwa o M
H
<4,5 nale do materia ów
hydraulicznych.
Dla charakterystyki cementu (klinkieru), jego w
ciwo ci i przydatno ci, istotne
znaczenie maj stosunki ilo ciowe pomi dzy chemicznymi sk adnikami klinkieu,
ustalone na podstawie analizy chemicznej, wyra one wspó czynnikami tzw.
modu ami.
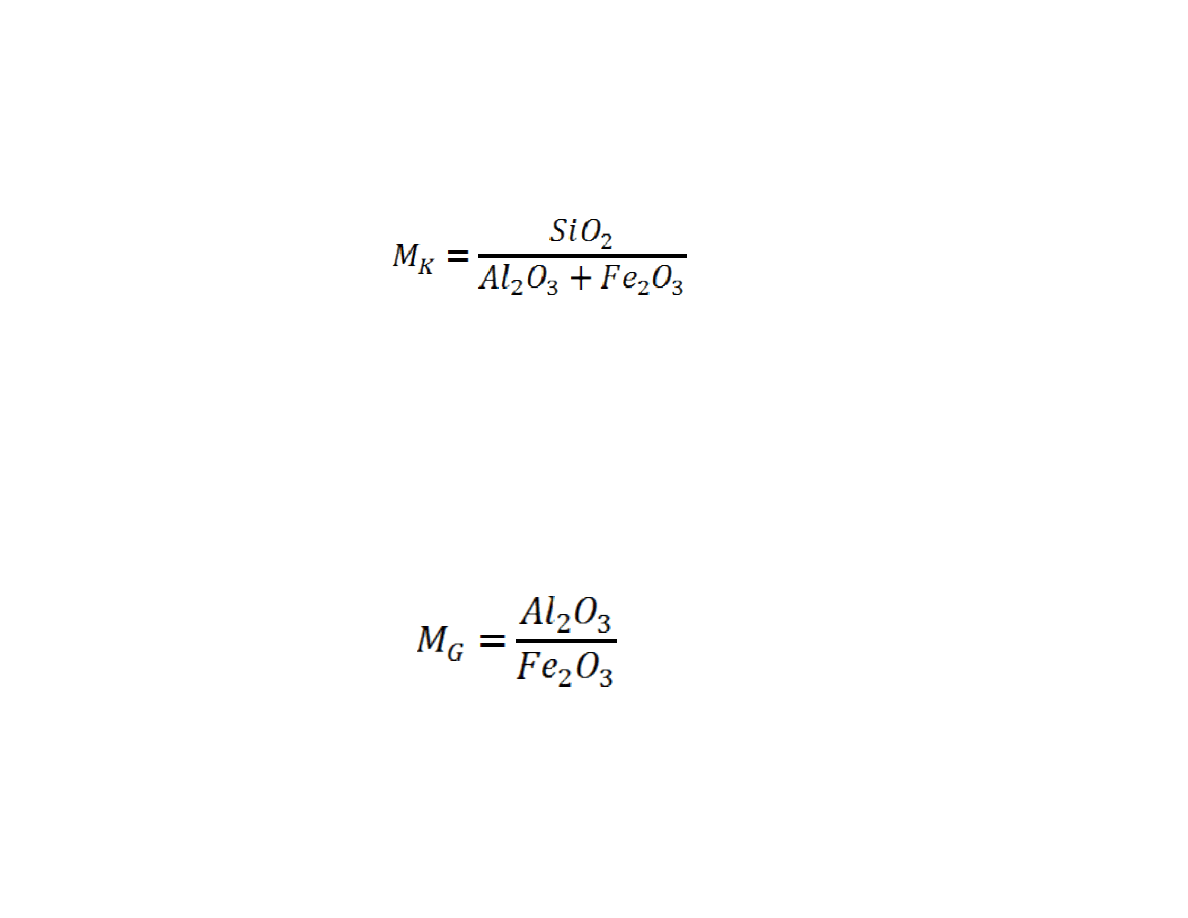
Modu krzemianowy
oblicza si na podstawie wzoru
W podanym wzorze SiO
2
, Al
2
O
3
i Fe
2
O
3
, oznaczaj procentow zawarto
tych tlenków w cemencie. Warto modu u hydraulicznego powinna by
zawarta w granicach od 2.1 do 3,5.
Modu glinowy
oblicza si na podstawie wzoru
Gdzie Al
2
O
3
i Fe
2
O
3
oznaczaj procentow zawarto tlenków. Warto
modu u glinowego powinna by zawarta w granicach 1,0-2,8
Schemat procesu hydratacji cementu portladzkiego (wg. Lea)
C
3
S
C
3
S
· aq
el. C-S-H + Ca(OH)
2
C
2
S
C
2
S
· aq
el. C-S-H
Krystaliczne produkty wi kszych rozmiarów
C
4
AF + gips + Ca(OH)
2
C
3
AF · CaSO
4
· aq
C
3
A + gips
trójsiarczan (entryngit)
monosiarczan
Krystaliczne produkty o wymiarach ponadkoloidalnych

Do czynników wp ywaj cych na kinetyk hydratacji cementu nale
:
a) Klasa wytrzyma
ci cementu - kszta towana sk adem mineralnym, stopniem
rozdrobnienia, zawarto ci gipsu. Cement bogaty w C
3
S szybciej ulega
hydratacji i osi ga wi ksz wytrzyma
, ani eli cement o du ej zawarto ci
C
2
S.
b) Sole zawarte w wodzie zarobowej – reaguj c ze sk adnikami zaczynu
cementowego mog przy piesza lub opó nia reakcje, wp ywaj c te na
jako
betonu.
c) Domieszki reguluj ce czas wi zania – wprowadzane celowo do cementów,
dla wymaganej wzgl dami praktycznymi modyfikacji szybko ci hydratacji
oddzia uj chemicznie na jeden lub wi cej sk adników cementu.
d) Temperatura – wzrost temperatury przy piesza reakcje hydratacji, jej spadek
natomiast je wyd
a. W temperaturze -10
C reakcje chemiczne nie zachodz .

Poszczególne sk adniki cementu reaguj z wod z ró
szybko ci . G ówny
sk adnik cementu – alit, reaguje z wod energicznie, natychmiast po
zarobieniu cementu wod . Im wi ksza jest zawarto alitu w cemencie, tym
proces wi zania spoiwa zachodzi szybciej. Reakcja hydrolizy alitu przebiega
zgodnie równaniem:
3CaO · SiO
2
+ nH
2
2 CaO· SiO
2
· (n-1)H
2
O + Ca(OH)
2
Szybko wi zania cementu mo na regulowa stosuj c odpowiednie dodatki.
Opó niacze
: gips, siarczan glinowy,
Przy pieszacze
: w glany sodu lub potasu, chlorki i azotany wapniowe lub
magnezowe
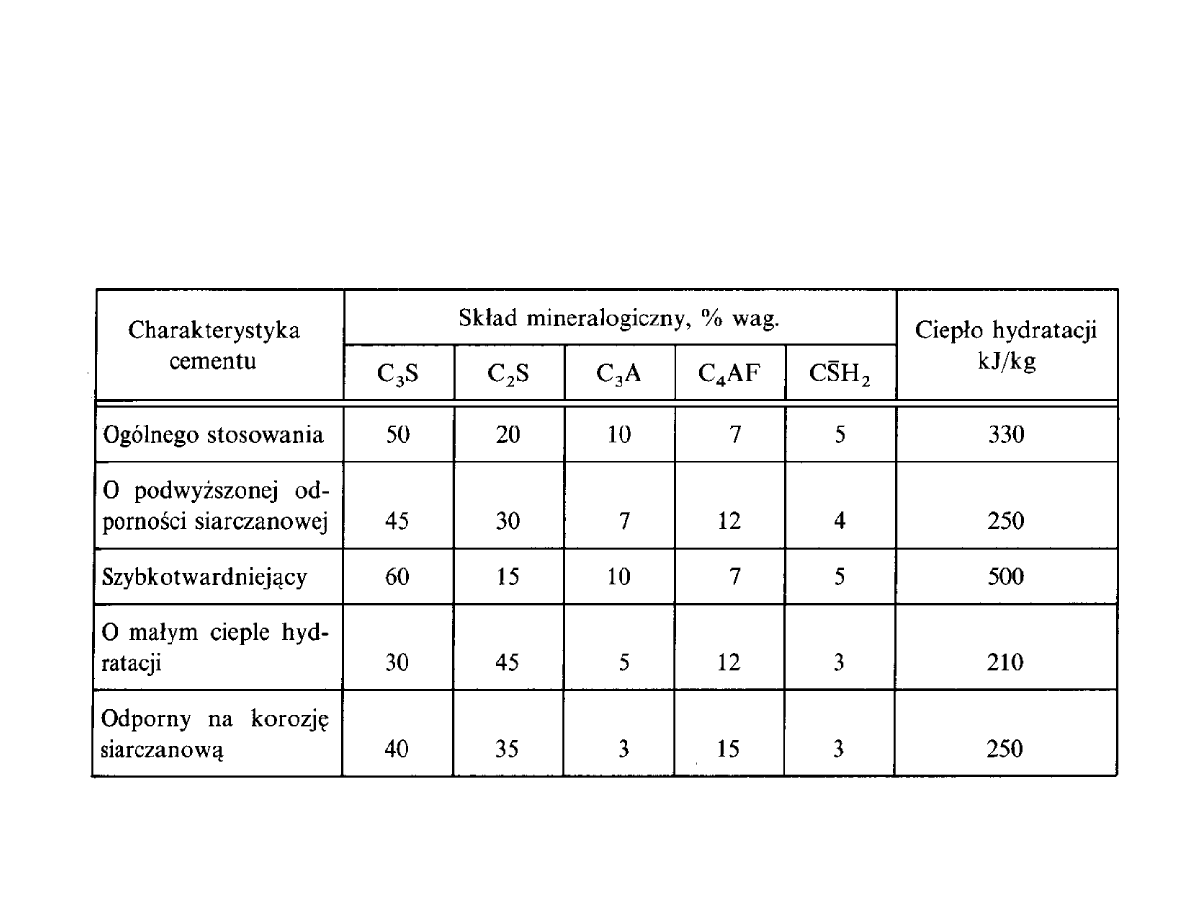
Podstawowe odmiany cementów portlandzkich i ich sk ad
mineralogiczny

Odmiany cementu portlandzkiego:
Cement portlandzki bia y
: nale y stosowa surowce zawieraj ce minimaln
ilo zwi zków elaza, chromu i manganu
Cementy kolorowe
:
1) Dodaj c do mieszaniny wypalonych surowców dodatków barwi cych
takich jak : tlenek chromu, manganu lub kobaltu
2) Nale y przemieli bia y klinkier z barwnikami mineralnymi: tlenki elaza
nadaj kolor czerwony, br zowy lub ty, tlenek manganu – kolor
fioletowy, natomiast tlenek chromu – kolor zielony
Cement ekspansywny
– zwi kszaj cy obj to w procesie twardnienia.

Inne rodzaje cementów:
Cement glinowy
jest spoiwem hydraulicznym o przybli onym sk adzie: 40%
Al
2
O
3
, 40% CaO, 10% SiO
2
i 10% Fe
2
O
3
. do produkcji cementu glinowego u ywa
si wapieni wysokoprocentowych i boksytu lub innych bogatych w tlenek glinu
Al
2
O
3
. Cement glinowy jest odporny na korozj wód kwa nych, szczególnie
siarczanowych, ulega korozji pod wp ywem roztworów alkalicznych. Wynika to
z amfoterycznych w ciwo ci wodorotlenku glinu.
Cement hutniczy
ma przybli on
zawarto
ównych sk adników
li
wielkopiecowych SiO
2
27-40%; Al
2
O
3
10-25%, CaO powy ej 40%. Otrzymany
jest przez przemielenie
la wielkopiecowego (20-80%) z klinkierem cementu
portlandzkiego (15-75%) i gipsem (do 5%). Cement hutniczy charakteryzuje si
dobr odporno ci chemiczn i dlatego stosowany jest do produkcji betonów i
zapraw nara onych na dzia anie wód agresywnych np. wody morskiej.

Cement wapienno-
lowy
produkuje si przez zmielenie granulowanego
zasadowego
la wielkopiecowego i wapna palonego lub hydratyzowanego
i gipsu.
Cement gipsowo-
lowy
otrzymuje si przez przemielenie
la
granulowanego i gipsu lub anhydrytu z kilkuprocentowym dodatkiem
wapna lub klinkieru portlandzkiego. Stosowany jest do budowy du ych
obiektów ze wzgl du na ma e zmiany obj to ci.

Spoiwa wapienne i magnezjowe

Spoiwa wapienne i magnezjowe
Spoiwa wapienne
otrzymuje si przez pra enie wapieni
CaCO
3
CaO + CO
2
T = 800-1200 C
a
spoiwa magnezjowe
przez pra enie magnezytu
MgCO
3
MgO + CO
2
T = 750-950 C
lub dolomitu
CaCO
3
· MgCO
3
CaCO
3
+ MgO + CO
2
T > 600
CaCO
3
· MgO CaO + MgO + CO
2
T = 900

WAWEL
CHI SKI MUR
Zaprawa wapienna

Surowcem do produkcji spoiw wapiennych jest wapie . Najcz
ciej spotykane
odmiany wapieni to: margle, kreda, wapienie zbite, marmur.
W Polsce marmur wydobywany jest
wy cznie w Sudetach, przede wszystkim
w Masywie nie nika, gdzie wyst puje w
dwóch odmianach kolorystycznych, jako
"Bia a Marianna" (na górze Krzy nik) i
"Zielona Marianna"
Du e z
a kredy wyst puj w
Polsce w okolicach Che ma,
Zamo cia i Siedlec.

Wapienie nale do najbardziej
rozpowszechnionych ska na wiecie. W
Polsce wyst puj m.in.: na Wy ynie
Krakowsko-Cz stochowskiej, w Górach
wi tokrzyskich, Tatrach, Pieninach i
Sudetach (Góry Kaczawskie).
Miejsca wyst powania: Na
Ba kanach - od Bo ni do Grecji -
Eubea, Austria, W ochy - Elba i
Piemont Lombardia, Rosja - Ural,
Chiny – Mand uria, Szwajcaria,
Demokratyczna Republika Konga,
Czechy, Niemcy.
W Polsce - Masyw Sobótki,
Gogo ów - Jordanów, Szklary.
MAGNEZYT

Wypalanie wapieni polega na reakcji rozk adu w glanu wapniowego:
2
3
CO
CaO
CaCO
Podczas otrzymywania wapna zachodzi jeszcze wiele innych reakcji (na
skutek zanieczyszcze ):
- rozk ad w glanu magnezowego
- rozk ad dolomitu
- powstawanie krzemianów wapniowych
- powstawanie glinianów wapniowych
2
3
CO
MgO
MgCO
3
2
3
3
CaCO
CO
MgO
MgCO
CaCO
2
2
SiO
xCaO
xCaO
SiO
3
2
3
2
O
Al
xCaO
xCaO
O
Al
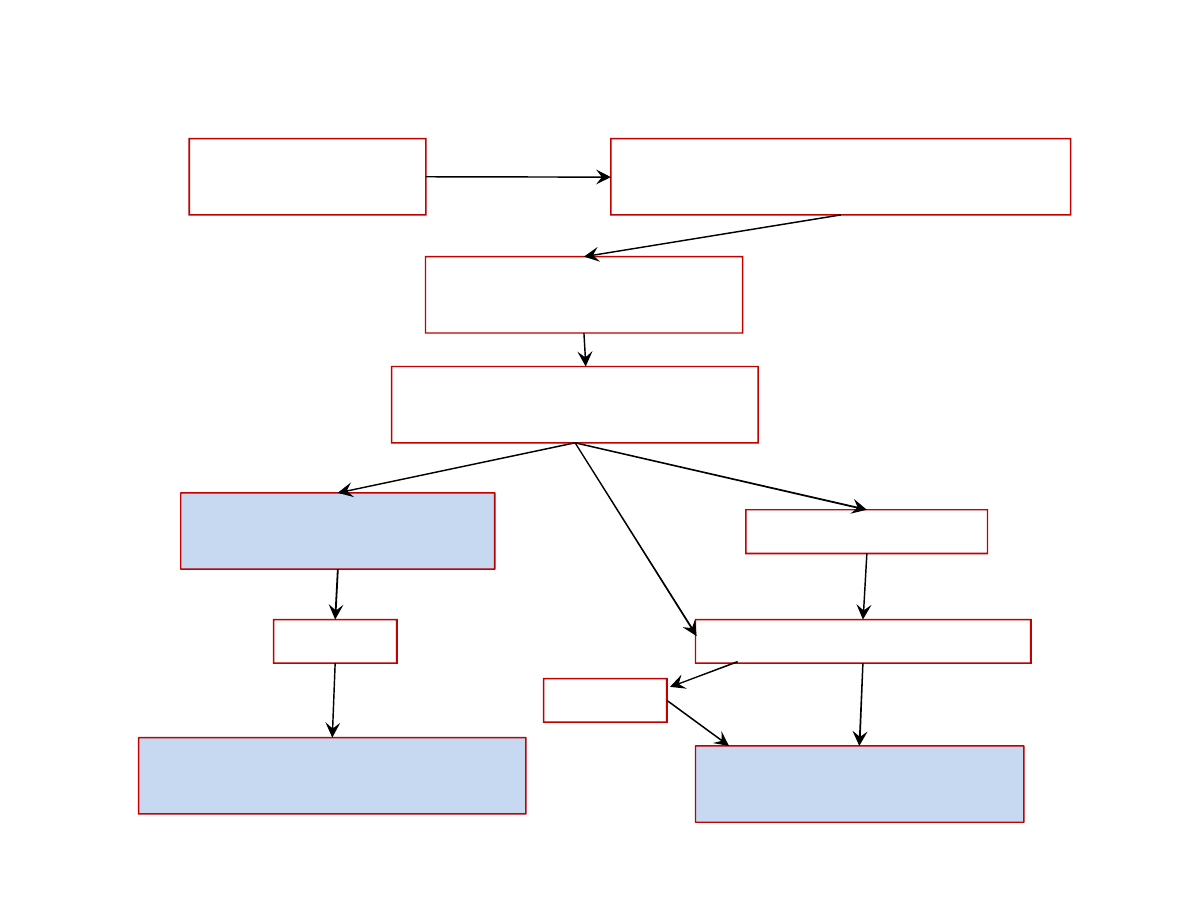
Transport urobku
wapienia ze z
a
Rozdrabnianie kamienia 60-200 mm
(kruszarki szcz kowe)
Przesiewanie na frakcje
(sita wibracyjne)
WYPALANIE (piec szybowy)
na CaO
Sk adowanie wapna
niegaszonego w bry ach
Wapno niegaszone mielone –
magazynowanie
mielenie
Przemia w m ynie
Gaszenie rozpylon wod
Wapno hydratyzowane –
magazynowanie
mielenie
Schemat ideowy produkcji spoiw wapiennych

Wyró nia si wapno:
- abopalone
, T = 1000 C, wielko kryszta ów CaO ok. 1-2 m
- redniopalone
, T = 1150 C, 3-6 m
- wysokopalone
, T = 1300 C, > 10 m
W zale no ci od sk adu chemicznego rozró nia si wapno:
- powietrzne (> 94 % CaO)
- hydrauliczne (> 90 % CaO oraz min. 3 % SiO
2
i 3% [Al
2
O
3
+ Fe
2
O
3
])
- wysokohydrauliczne (> 80 % CaO oraz min. 6 % SiO
2
i 5% [Al
2
O
3
+ Fe
2
O
3
])

Wi zanie spoiw wapiennych rozpoczyna reakcja czenia si tlenku
wapniowego z wod , czyli reakcja hydratacji, zwana w technice budowlanej
gaszeniem wapna lub lasowaniem. Reakcja ta jest egzotermiczna:
CaO + H
2
O Ca(OH)
2
+ 1100 kJ/kg CaO
W zale no ci od ilo ci wody u ytej do gaszenia otrzymuje si :
-
wapno hydratyzowane
(suchogaszone); jest to wodorotlenek wapnia w
postaci proszku, otrzymany przy u yciu minimalnej (stechiometrycznej) ilo ci
wody (1 kg CaO wi e 0,32 kg H
2
O, wydzielaj ce si ciep o zmienia jednak w
par ok. 0,43 kg wody i st d najmniejsza ilo wody potrzebna do gaszenia na
sucho 1 kg CaO wynosi 0,75 kg; jest wi c oko o dwa razy wi ksza od
teoretycznej)
-
ciasto wapienne
; jest to mieszanina wodorotlenku wapniowego i jego
nasyconego roztworu (zwykle 50% wody)
-
mleko wapienne
; jest to zawiesina wodorotlenku wapniowego w wodzie.

Proces wi zania spoiw wapiennych nast puje w wyniku:
a) Zag szczania koloidalnego Ca(OH)
2
przy wysychaniu, np. zaprawy
b) Wydzielanie si z przesyconego roztworu wodorotlenku wapniowego
kryszta ków uwodnionego Ca(OH)
2
2H
2
O, ich powolnego wzrostu i zrastania
si – tworzenia si szkieletu krystalicznego
c) Dysocjacja cz
ci wodorotlenku wapniowego na jony Ca
2+
i OH
-
i reakcji
jonów wapniowych z krzemionk (z piasku) z powstawaniem uwodnionych
krzemianów wapnia, które jako trudno rozpuszczalne wypadaj z roztworu
cz c ziarna piasku
d) Karbonizacja wodorotlenku wapniowego w rodowisku wilgotnym wg reakcji
Ca(OH)
2
+ H
2
O + CO
2
CaCO
3
+ 2H
2
O

Proces
wi zania zaprawy
przebiega w ci gu kilku godzin od jej wykonania,
natomiast
twardnienie
jest procesem powolnym, zachodz cym w ci gu
ugiego okresu czasu. Powstaj ce kryszta y Ca(OH)
2
i CaCO
3
rozrastaj si i
cz mi dzy sob , powoduj c twardnienie zaprawy.
- piasek nie bierze udzia u w reakcji, ale u atwia dost p dwutlenku w gla
przyspieszaj c proces karbonizacji
- sztuczne przy pieszanie procesu karbonizacji przez zwi kszenie ilo ci
dwutlenku w gla w powietrzu obni a wytrzyma
zaprawy, gdy
powstaj ce kryszta y w glanu wapnia s zbyt drobne
3
2
3
2
2
%
%
%
%
O
Fe
O
Al
SiO
CaO
M
H
Spoiwa wapienne – modu hydrauliczny lub modu zasadowo ci
Je eli warto
modu u jest wi ksza ni 4,5 spoiwo zaliczamy do grupy
powietrznych (wapno palone, wapno gaszone, wapno hydratyzowane). Je eli
warto
modu u jest mniejsza ni
4,5 spoiwo zaliczamy do grupy
hydraulicznych (wapno hydrauliczne).

Beton komórkowy
Otrzymuje si z wapna palonego, cementu portlandzkiego i(lub) popio ów
lotnych oraz piasku. Jako rodek spieniaj cy stosuje si past aluminiow
2 Al + 3 Ca(OH)
2
+ 6 H
2
O Ca
3
[Al(OH)
6
]
2
+ 3 H
2

W przypadku
spoiw magnezjowych
do wody zarobowej dodaje si MgCl
2
lub
MgSO
4
i wykorzystuje w ten sposób zjawisko diadochii dla uzyskania takich
produktów, jak np. MgCl
2
· 5 MgO · 17 H
2
O, tzw. cement Sorela, lub MgSO
4
· 5
Mg(OH)
2
· 8 H
2
O, o zwi kszonej wytrzyma ci mechanicznej, szczelno ci i
odporno ci na dzia anie wody.
Zdolno
do wzajemnego zast powania jonów, atomów lub cz steczek przez
inne o zbli onych wymiarach nazywa si diadochi . Mo e by :
- izowalentna, je li jony maj
sam warto ciowo , np. Mg
2+
Fe
2+
, F
-
Cl
-
,
F
-
OH
-
- heterowalentna dla ró nej warto ciowo ci jonów, np. Al
3+
Si
4+
, Al
3+
Mg
2+
spoiwa magnezjowe
otrzymuje si przez pra enie magnezytu
MgCO
3
MgO + CO
2
T = 750-950 C
lub dolomitu
CaCO
3
· MgCO
3
CaCO
3
+ MgO + CO
2
T > 600
CaCO
3
· MgO CaO + MgO + CO
2
T = 900

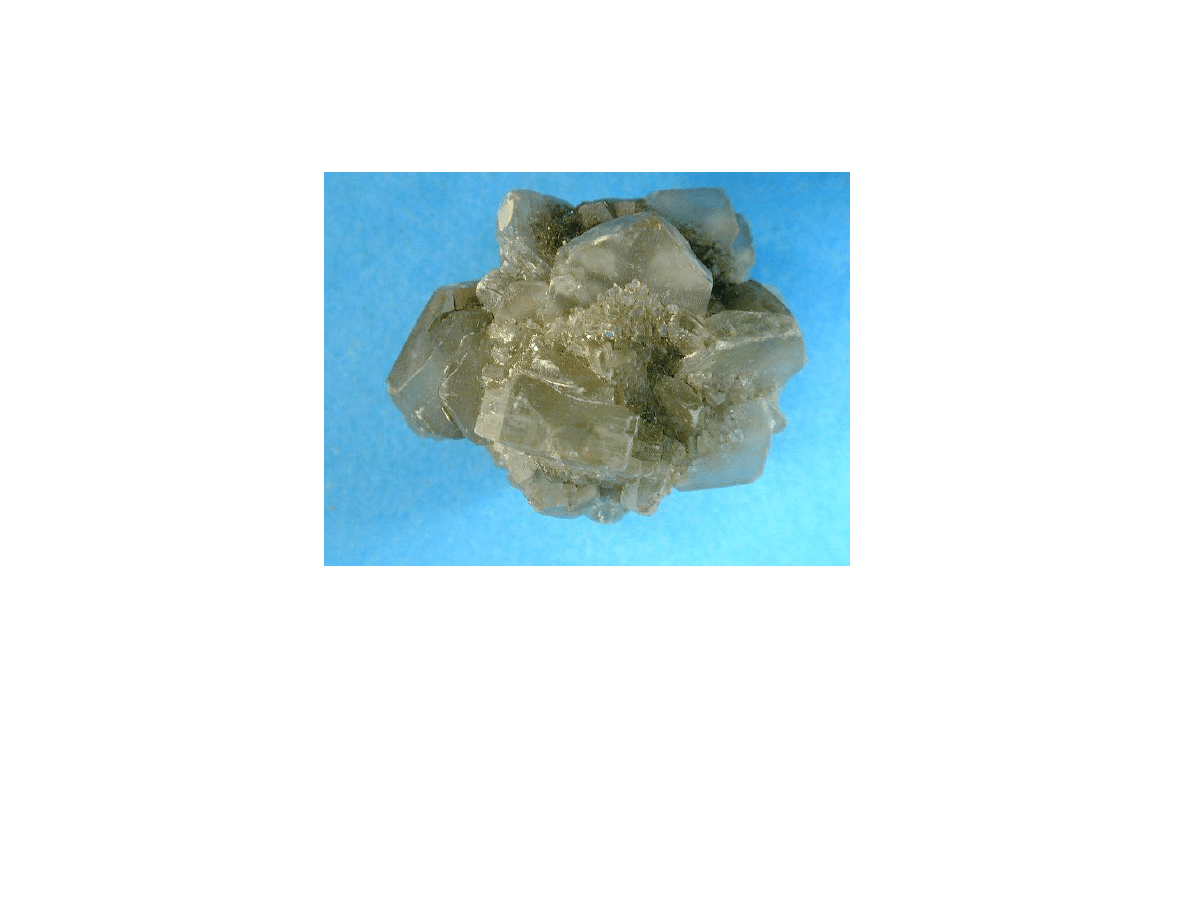
Spoiwa gipsowe i anhydrytowe
Spoiwa gipsowe i anhydrytowe zaliczane s do spoiw powietrznych
Surowcami do ich otrzymywania s ska y osadowe – gipsy i anhydryty
Uwodniony siarczan wapnia
, krystalizuje w uk adzie jednosko nym. W wyniku
ogrzewania traci cz ciowo wod , przechodz c w temperaturze 120-130 °C w
gips palony, b
cy materia em zaprawowym poniewa atwo pobiera wod i
twardnieje.
Gips budowlany (pó wodny) otrzymuje si w wyniku wypra ania gips w
temperaturze 150-185 °C.

Anhydryt (CaSO
4
)
Siarczan wapnia. Krystalizuje w uk adzie rombowym. Bezbarwny lub barwa
bia a, szarawa b
niebieskawa. Przezroczysty. Pospolity sk adnik
hydrotermalnych i z solnych. Powstaje g ównie wskutek odparowywania
wód morskich. W Polsce w du ych ilo ciach wyst puje ko o Lwówka
skiego i Lubania, tak e w z ach solnych K odawy i Inowroc awia.
Wykorzystywany w przemy le chemicznym, a tak e jako surowiec do
produkcji cementu i kwasu siarkowego.

W zale no ci od warunków procesu powstawa mog dwie odmiany gipsu
pó wodnego i , ró ni ce si od siebie kszta tem kryszta ów i w ciwo ciami
fizycznymi.
Odmiana
ma dobrze wykszta cone kryszta y i ma wi kszy ci ar w ciwy, spoiwo
otrzymane z odmiany ma wytrzyma
znacznie wi ksz ni odmiana .
Odmiana
jest w wodzie lepiej rozpuszczalna i energicznej reaguje z wod ni
odmiana
Kryszta gipsu
Odmiany gipsu pó wodnego

Odmiana o wi kszej powierzchni wewn trznej charakteryzuje si te wi ksz
reaktywno ci chemiczn . Jest ona wykorzystywana jako gips budowlany (gips
tynkarski i sztukatorski), a odmiana jako gips modelarski
Gips sztukatorski wi e w czasie 10-15 minut od zarobienia wod .
Spowalniaj ten proces
: klej, lateks, kwas cytrynowy, fosforany, NaF, cukier
Przy pieszaj proces
: drobno zmielony kamie gipsowy, NaCl, KOH, K
2
SO
4
lub
unu

Proces dehydratacji gipsu. Pra enie gipsu powoduje jego cz ciowe odwodnienie
CaSO
4
· 2 H
2
O
CaSO
4
· ½ H
2
O + 3/2 H
2
O
Gips pó wodny
Dla otrzymywania spoiw gipsowych podstawowe znaczenie ma przemiana
dwuwodnego siarczanu wapniowego w pó hydrat, zachodz ca w procesie
pra enia gipsu.
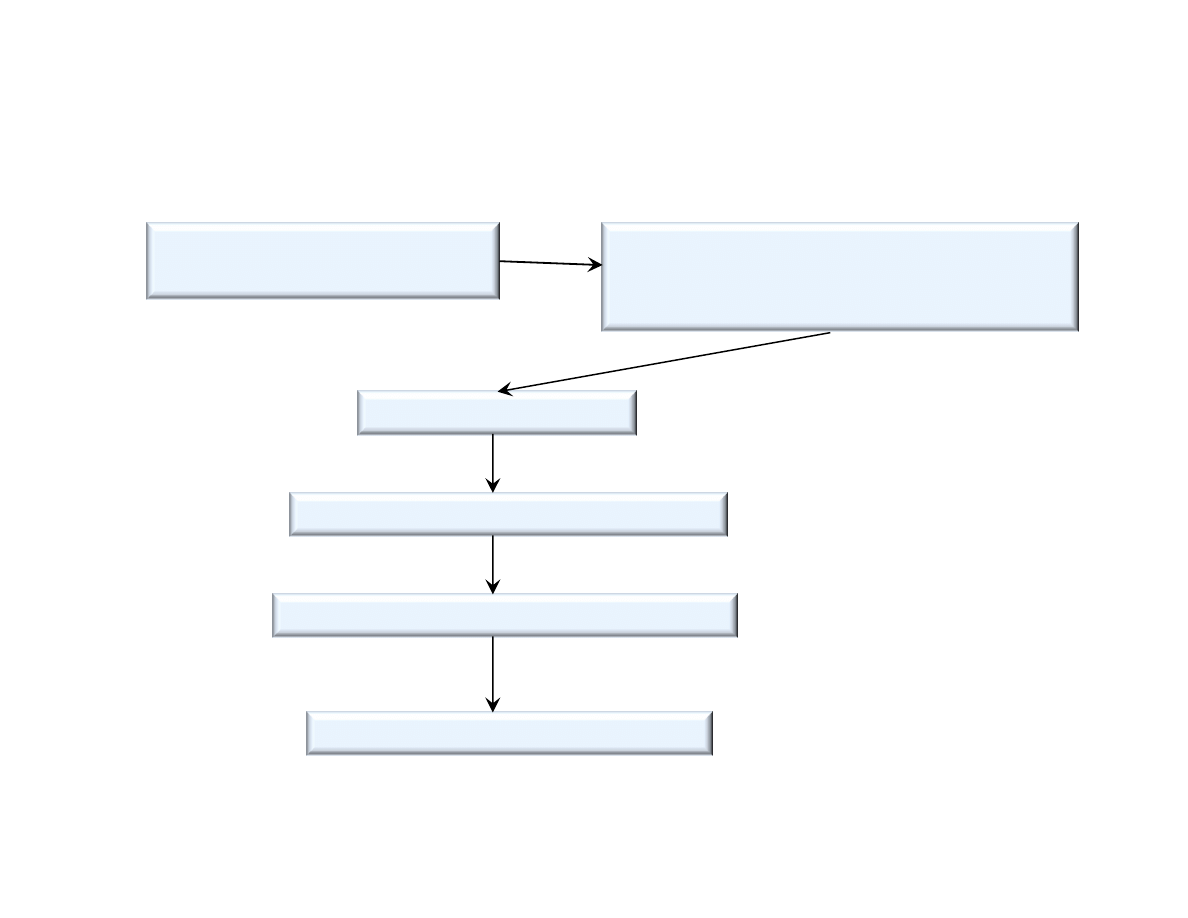
Schemat ideowy produkcji gipsu budowlanego
Transport urobku kamienia
gipsowego ze z
a
Rozdrabnianie,
klasyfikacja (przesiewanie)
przygotowanie wsadu surowcowego
Wypalanie (pra enie)
Studzenie, dojrzewanie w silosach
Mielenie, ew. mieszanie z dodatkami
Pakowanie w worki, ekspedycja

Podstawowy sk adnik budowlanych spoiw gipsowych – pó wodny siarczan
wapniowy – po dodaniu wody przechodzi szybko w posta dwuwodn . Zjawisko
to, któremu towarzyszy znaczne wydzielenie si ciep a, znane jest powszechnie
jako wi zanie gipsu. Pierwsze próby wyja nienia mechanizmu wi zania gipsu
pó wodnego, opartego na ró nicy rozpuszczalno ci pó hydratu (oko o 9 g/l) i
dwuhydratu (oko o 2 g/l), zawdzi cza nauka g ównie pracom francuskich badaczy
Lavoisiera (1768 r.) i Le Chateliera (1887 r.)
Teoria Le Chateliera
Pó hydrat rozpuszcza si w wodzie zarobowej, wytwarzaj c roztwór przesycony
wzgl dem gipsu, od którego ma znacznie wi ksz rozpuszczalno . Z roztworu
przesyconego krystalizuje zatem CaSO
4
· 2H
2
O, umo liwiaj c rozpuszczenie
nowych ilo ci pó hydratów. Proces ten nast puje a do ca kowitej przemiany
pó hydratu w gips.

Substancje maj ce wp yw na szybko
wi zania spoiw gipsowych;
Opó niacze – klej kostny, kazeina, krochmal, bia ko, elatyna, kwas borny i
borany, kwas winowy, cytrynowy i cytryniany, kwas fosforowy i fosforany, w glany
wapnia i magnezu.
dzia anie opó niaczy polega na:
- obni eniu rozpuszczalno ci pó hydratu w wodzie (kwasy)
- hamowaniu krystalizacji dwuhydratu w wyniku tworzenia na ziarnach gipsu trudno
rozpuszczalnych otoczek (borany, fosforany, w glany) lub koloidalnej warstewki
ochronnej utrudniaj cej dost p wody do ziarn gipsu (kleje, elatyna, krochmal)
dodatek opó niacza wynosi na ogó 0,1-0,5% masy gipsu, co przesuwa pocz tek
wi zania do 25-35 minut.
Przyspieszenie procesu wi zania jest stosowane rzadziej i polega na
wprowadzeniu domieszek zwi kszaj cych rozpuszczalno
pó hydratu lub
zmniejszaj cych rozpuszczalno
dwuhydratu albo na wprowadzeniu do zaczynu
zarodków krystalizacji. Substancje zmniejszaj ce rozpuszczalno
dwuhydratu to:
siarczan potasu, chlorki sodu, wapnia, magnezu.

Wi zanie i twardnienie spoiw anhydrytowych
Spoiwa anhydrytowe otrzymuje si przez wysuszenie i rozdrobnienie
anhydrytu naturalnego lub przez pra enie gipsu w temperaturze powy ej
600 C. Podstawowym procesem, na którym oparte jest dzia anie tych
spoiw jest reakcja uwodnienia anhydrytu II:
CaSO
4
+ 2H
2
O
CaSO
4
· 2H
2
O

Proces uwodnienia anhydrytu zachodzi w dwóch etapach:
1) anhydryt rozpuszcza si w wodzie w temperaturze poni ej 42 C, dzi ki czemu
powstaje roztwór przesycony w stosunku do CaSO
4
· 2H
2
O
2) z roztworu wykrystalizowuje CaSO
4
· 2H
2
O jako faza trwa a w tych warunkach
W celu zwi kszenia szybko ci zachodz cych przemian, stosuje si wi kszy stopie
rozdrobnienia spoiwa i katalizatory, jak np. sole, które po rozpuszczeniu
wytwarzaj jony Ca
2+
lub SO
4
2-
i u atwiaj przesycenie roztworu i wytworzenie
zarodników krystalizacji.

Ró nice pomi dzy spoiwem gipsowym a anhydrytowym
- Pó hydrat przechodzi w gips ca kowicie, natomiast anhydryt zostaje uwodniony
jedynie cz ciowo. Obecno w stwardnia ym spoiwie anhydrytowym – oprócz
kryszta ów gipsu – równie kryszta ów anhydrytu, jest powodem znacznie
wi kszej wytrzyma ci tych spoiw w porównaniu ze spoiwem z gipsu
pó wodnego. Jednak e w przypadku dop ywu wilgoci do spoiwa anhydrytowego
nast puje dalszy proces uwadniania, prowadz cy w konsekwencji do zwi kszenia
obj to ci. Proces ten jest przyczyn kruszenia i p kania materia u.

Spoiwa krzemianowe

SPOIWA KRZEMIANOWE
W kompozytach krzemianowych – silikatowych (kity, zaprawy, farby) – jako
spoiwo stosuje si szk o wodne sodowe i potasowe
Na
2
SiO
3
+ 2H
2
O
H
2
SiO
3
+ 2NaOH
Wi zanie tego spoiwa
Na
2
SiO
3
+ CO
2
+ 2H
2
O Na
2
CO
3
+ H
4
SiO
4
W sk ad spoiw krzemianowych wchodz : mineralne m czki kwasoodporne
(granitowe, bazaltowe, kwarcytowe i inne), szk o wodne oraz koagulanty,
przy pieszaj c proces wi zania i twardnienia.
Rol
ciwego spoiwa spe nia szk o wodne. Ogólny wzór szk a wodnego
R
2
O · nSiO
2
· mH
2
O
R
2
O oznacza tlenek sodu lub potasu

Przy pieszenie wi zania nast puje po dodatku fluorokrzemianu sodu
2Na
2
SiO
3
+ Na
2
SiF
6
+ 3 H
2
O 3 H
2
SiO
3
+6NaF
Zestawy szk o wodne-fluorokrzemian i wype niacz kwarcowy s stosowane jako
kity i zaprawy do wykonywania kwasoodpornych posadzek. Kompozyty s
odporne na suche rodowisko kwa ne (np. gazy kominowe). W rodowisku
wodnym s nietrwa e.

Materia y ogniotrwa e – to materia y z których wyroby w temperaturze powy ej
1500 C nie ulegaj odkszta ceniu
nazwa
wzór
Temperatura
topnienia [ C]
krystobalit
SiO
2
1700
korund
Al
2
O
3
2050
mulit
3Al
2
O
3
·2SiO
2
1800
magnezja
MgO
2800
fosteryt
Mg
2
SiO
4
1890
tlenek cyrkonu
ZrO
2
2700
spinel
MgAl
2
O
4
2135
chromit
FeCr
2
O
4
2180

Szk o jest ciecz sztywn sk adaj
si z mieszaniny SiO
2
i innych tlenków
metali. Powstaje w wyniku stopienia (ok. 1500 C) i ostudzenia bez krystalizacji
mieszaniny piasku kwarcowego (> 70%) i innych dodatków.
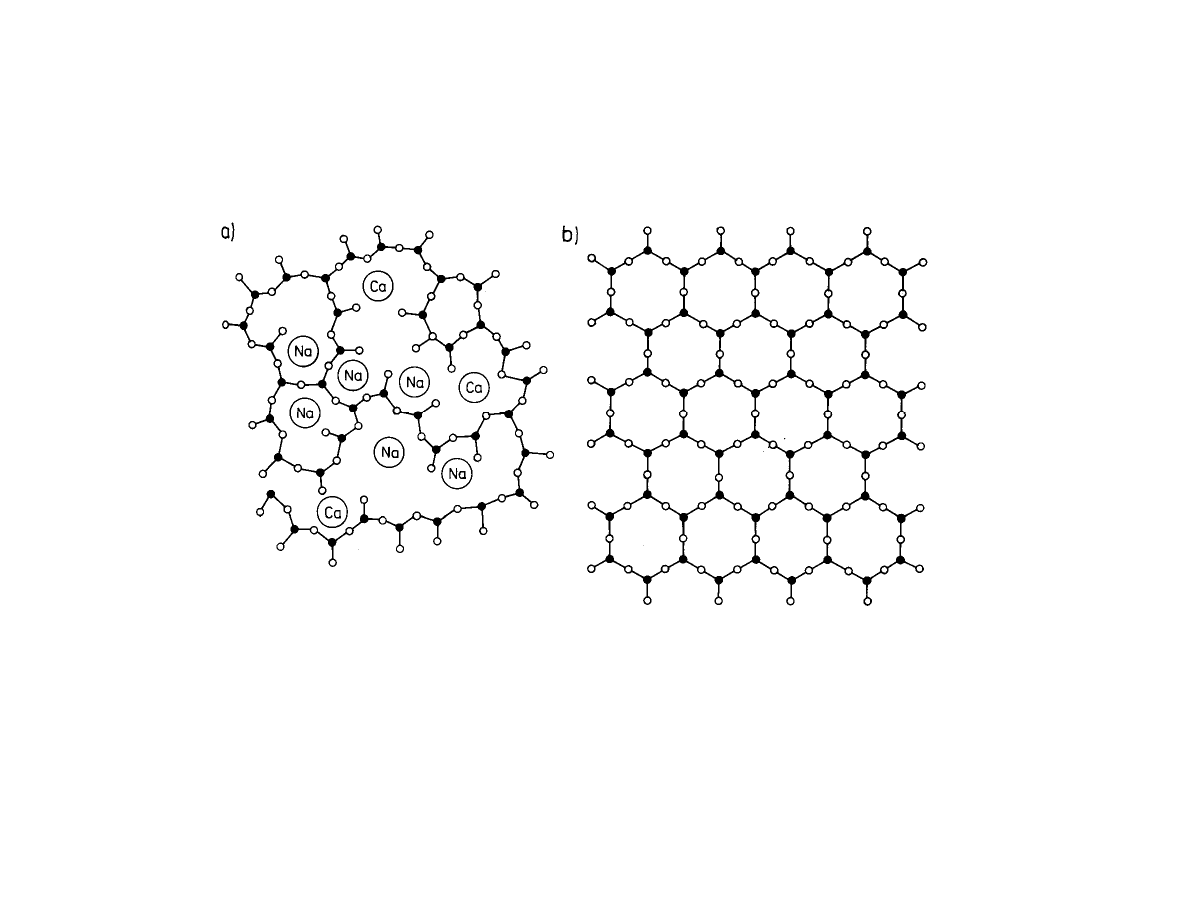
Schemat budowy sieciowej szk a (a) w porównaniu ze struktur krystalicznej
krzemionki (b)

Najcz
ciej stosowanymi tlenkami w produkcji szk a s :
Tlenek glinowy (w postaci skaleni sodowo-wapniowych, glin ogniotrwa ych,
kaolinu, odpadów zawieraj cych glin) dodawany w ilo ci do 8%; zast puje cz
krzemionki powoduje wzrost odporno ci szk a na dzia anie wody, zwi ksza
twardo
i wytrzyma
mechaniczn szk a oraz odporno
termiczn , utrudnia
jednak topienie.
Tlenek borowy (w postaci boraksu lub kwasu borowego), zast puje cz
krzemionki i topniki, zmniejsza lepko
w wysokich temperaturach, zwi ksza
twardo
i odporno
chemiczn szk a, obni a wspó czynnik rozszerzalno ci
termicznej
Tlenek magnezowy (wprowadzany w postaci dolomitu) zast puje cz
tlenku
wapniowego, stabilizuje szk o, zwi ksza lepko
masy szklanej, powoduje wzrost
odporno ci chemicznej zw aszcza przy jednoczesnym dodatku tlenku glinowego
Tlenek o owiowy (minia), zast puje najcz
ciej tlenek wapniowy, zmniejsza
lepko
, ale i odporno
chemiczn szk a, zw aszcza wspó czynnik za amania
wiat a, nadaje pi kny po ysk (kryszta y) i d wi k.

ciwo ci szk a:
- ma a przepuszczalno ciep a
- ma e przewodnictwo elektryczne
- odporno na dzia anie wody, powietrza i wielu substancji, kwasów, zasad i soli
- ze szk em reaguj : fluorowodór i fluorki oraz st one roztwory zasady sodowej
W budownictwie stosuje si g ównie szk o sodowo-wapniowe („szk o zwyk e”) o
zawarto ci SiO
2
> 70%, Na
2
O 15-17% oraz CaO 0,5-8%

Szk o zwyk e – szk o sodowo-wapniowo-potasowe Na
2
CaO SiO
2
Surowce do produkcji szk a zwyk ego:
- krzemionka SiO
2
(piasek kwarcowy) w ilo ci 68-74% - cia o szkliste
-
glan wapnia CaCO
3
w ilo ci 7-14% sk adnik stabilizuj cy, utwardzaj cy
szk o, zwi kszaj cy odporno
chemiczn , nadaj cy po ysk
- soda NaCO
3
w ilo ci 12-16% obni a temperatur topnienia mieszaniny do ok.
1400
C
Dodatkowo:
- glin i magnez (2-3%) u atwiaj obróbk na gor co i zwi kszaj odporno chemiczn
oraz wytrzyma
szk a
-tlenki arsenu, antymonu, zwi zki fluoru jako domieszki u atwiaj ce klarowanie szk a

SZK O O INNYM SK ADZIE NI SZK O ZWYK E
Szk o o owiowe (kryszta owe)
. W szkle tym zamiast wapna wprowadza si tlenek
owiu w ilo ci ok. 20%, a do 60% w szk ach przeznaczonych do ochrony przed
promieniowaniem radioaktywnym lub rentgenowskim. Jest ok. 600 kg/m
3
ci
sze
od zwyk ego. S
y do wyrobu szkie optycznych, szk a artystycznego, do produkcji
rur neonowych.
Szk o glinowo-krzemowe
. Jest to szk o zawieraj ce ok. 20% glinu i niewielk ilo
tlenku borowego (ok. 4%). Jest odporne na wysokie temperatury, wytwarza si z
niego rury spalania, okienka pojazdów kosmicznych, cz
ci aparatury pracuj cej w
wysokiej temperaturze.

Szk o borowo-krzemowe (borowe).
Najbardziej znane jest szk o o nazwie pyrex o
zawarto ci tlenku boru ok. 12%. Szk o to ma wi ksz odporno
chemiczn , ale
przede wszystkim jest niewra liwe na nag e zmiany temperatury.

Szk o krzemowe (kwarcowe). Otrzymywane jest przez stopienie kwarcu, lub
bardzo czystego piasku: zawiera ok. 99% SiO
2
. Jest bardzo trudne w produkcji i
obróbce, o wiele bardziej kosztowne od innych szkie . Szk o krzemowe ma
bardzo ma y wspó czynnik rozszerzalno ci cieplnej i jest w zwi zku z tym ma o
wra liwe na gwa towne zmiany temperatury. Stosowane jest w przypadkach,
gdzie wymagana jest odporno
chemiczna w wysokiej temperaturze do 800
C.
szk o fotochromowe. Jest to szk o o zmiennej przepuszczalno ci optycznej,
zmieniaj ce s barw pod wp ywem promieniowania ultrafioletowego, a po jego
usuni ciu powracaj ce do barwy pierwotnej. Elewacje budynków z tego szk a
ciany os onowe) o zmiennej przepuszczalno ci s rozwi zaniem domów
inteligentnych kontrolowanych przez sensory kilmatyczne.

Rodzaje szk a budowlanego:
Szk o ceramiczne
ma du wytrzyma
mechaniczn , du twardo i trwa
,
doskona przyczepno do metali oraz odporno na dzia anie kwasów.
Otrzymuje si go po wtórnej obróbce tworzywa szklanego z odpowiednimi
katalizatorami.
Szk o p askie
charakteryzuje si przepuszczalno ci promieni widzialnych i
podczerwonych, a nie przepuszcza promieni nadfioletowych
Szk o zbrojone
jest to szk o z wtopion siatk chroni
przed rozpryskiwaniem
przy st uczeniu
Szk o hartowane
. Nagrzan tafl szk a ch odzi si strumieniem powietrza,
powstaj trwa e napr enia
Mozaika szklana
Kszta tki szklane

ókna szklane:
rednica 1-6 m
- dobre w ciwo ci izoluj ce,
- k t zwil ania 90
Zbli ona do we ny szklanej jest we na mineralna, otrzymywana z bazaltu
(diabazyt) o nast puj cym sk adzie chemicznym: 43 % SiO
2
, 16,5 % Al
2
O
3
, 11 %
FeO i Fe
2
O
3
, 1,5% MnO
2
, 18% CaO, 8% MgO i inne 2%.

Spoiwa wi
ce organiczne – lepiszcza bitumiczne
Bitumy s to substancje sta e, ciek e lub gazowe, w których sk adzie przewa aj
glowodory
Do lepiszczy bitumicznych zaliczamy: asfalty naturalne i ponaftowe oraz smo y i
paki
Asfalty
to substancje pó sta e, które po ogrzaniu przechodz w stan ciek y.
Asfalty stanowi uk ad koloidalny, w którym faz rozpraszaj
jest olej o
du ej lepko ci, faz rozproszon asfalteny, ywice asfaltowe i karbeny.
Naturalne asfalty mog zawiera 2-12% siarki.

Asfalty naturalne
wydobywa si z jezior asfaltowych (Bermudy, Trynidad) lub ze
ska asfaltowych. Zawarto czystego asfaltu w z ach wynosi 60-99% w
ska ach bitumicznych – do 15%
Asfalty sztuczne
pozosta ci po przeróbce specjalnych gatunków ropy
naftowej
ywice asfaltowe
to sk adniki asfaltu które zwi ksz ich plastyczno i
ci gliwo .
Asfalteny
powstaj w wyniku polimeryzacji z ywic asfaltowych w wysokiej
temperaturze. S twarde i nietopliwe, o barwie szaro-br zowej i wiadcz o
przepaleniu asfaltu.
Emulsje asfaltowe
to ciecze koloru br zowego o zawarto ci oko o 50% wody.
Trwa
emulsji utrzymuje si dzi ki dodatkom soli kwasów t uszczowych, np.
C
17
H
35
COONa (emulsje anionowe) lub emulsje kationowe – dodatek pierwszo-,
drugi- i trzeciorz dowych amin. Zalet emulsji jest dobra przyczepno asfaltu
do mokrego materia u kamiennego.

Smo y
otrzymuje si w procesach rozk adowej destylacji, rozk adu
termicznego materia ów organicznych, przy pirolizie pó produktów
naftowych. Chemicznie jest to mieszanina zwi zków aromatycznych i
heterocyklicznych. Do najwa niejszych sk adników s omy, nale : benzen,
toluen, ksylen, fenol, krezol, naftalen, antracen, fenantren, pirydyna i inne.
W drodze destylacji usuwa si wod i lekkie sk adniki otrzymuj c smo
destylacyjn .
Ze smo y surowej po destylacji frakcyjnej zostaje pak. Znajduje zastosowanie
do sporz dzania masy kablowej, kitów kwasoodpornych, jako lepiszcze do
brykietów z mia u w glowego
Wyszukiwarka
Podobne podstrony:
Chemia budowlana Wykład 12
chemia egzaminy!!, Studia Budownictwo UZ, 1 semestr, Chemia budowlana, Wykłady, chemia
Chemia budowlana Wykład 13
UZ1 - chemia - wyklady-1, II semestr, Chemia budowlana, Wykłady, Całość
wykďz˝ad 7, PK, CHM -Chemia budowlana, wykład
chemia budowlana wykład 1, chemia politechnika białostocka
UZ1 - chemia - wyklady, Studia Budownictwo UZ, 1 semestr, Chemia budowlana, Wykłady
Chemia budowlana Wykład 11
Chemia budowlana Wykład 7
Chemia budowlana Wykład 10
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
pytania testowe i chemia budowlana -zestaw1, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
pytania testowe i chemia budowlana -zestaw2(2), Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
wyklad 1 2, PK, CHM -Chemia budowlana, chemia wyklady
więcej podobnych podstron