
Kinetyka i równowaga chemiczna,
termodynamika
Arkusz zawiera 20 zadań. Za ich rozwiązanie można otrzymać maksymalnie
47 punktów. Czas pracy – 120 minut.
1.
(1 p.)
Napisz, jaki wpływ na stan równowagi reakcji chemicznej ma dodanie katalizatora.
....................................................................................................................................................................................
2.
(4 p.)
Dla reakcji CO + Cl
2
→ COCl
2
równanie kinetyczne ma postać: v = k · [CO] · [Cl
2
]
1/2
. Określ
rząd reakcji, cząsteczkowość reakcji oraz oblicz, jak zmieni się jej szybkość, jeżeli stężenie chloru zwięk-
szy się czterokrotnie.
Rząd reakcji
.........................................................
Cząsteczkowość reakcji
...........................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
3.
(4 p.)
Wykonując odpowiednie obliczenia, ustal na podstawie podanej energii wiązań szacunkową
wartość entalpii całkowitego uwodornienia propynu.
C—C E = 338 kJ · mol
−1
H—H E = 432 kJ · mol
−1
C—H E = 412 kJ · mol
−1
C C E = 830 kJ · mol
−1
....................................................................................................................................................................................
....................................................................................................................................................................................
Określ, czy ta reakcja jest endo- czy egzotermiczna. ....................................................................................
4.
(1 p.)
Iloczyn rozpuszczalności węglanu baru w temperaturze 18°C wynosi 0,81 · 10
−8
. Stężenie jonów
Ba
2+
w nasyconym roztworze tej substancji wynosi:
a) 8,1 · 10
−2
mol · dm
-3
c)
0,9
·
10
−4
mol · dm
-3
b) 0,2 · 10
−2
mol · dm
-3
d) 0,81 · 10
−8
mol · dm
-3
5.
(3 p.)
. Reakcja rozkładu metanu na acetylen i wodór przebiega według równania:
2CH
4
C
2
H
2
+ 3H
2
Reakcja ta, prowadzona w fazie gazowej w temperaturze 1500 K i w stałej objętości, osiągnęła stan równowagi
przy następujących stężeniach reagentów: [CH
4
] = 1,1 mol · dm
−3
, [C
2
H
2
] = 0,5 mol · dm
−3
, [H
2
] = 1,5 mol · dm
−3
.
Zapisz wzór na stałą równowagi reakcji, oblicz jej wartość oraz początkowe stężenie metanu.
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
8
—
—
—

....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
6.
(1 p.)
Wskaż równanie reakcji, której stan równowagi pod wpływem zmniejszenia ciśnienia przesunie się
w prawo.
a) 2CO
(g)
+ O
2(g)
2CO
2(g)
c)
N
2
O
4(g)
2NO
2(g)
b) H
2(g)
+ Cl
2(g)
2HCl
(g)
d)
C
(s)
+ O
2(g)
CO
2(g)
....................
Informacja do zadania 7
Zależność stężenia substratu od czasu przebiegu reakcji dla reakcji zerowego rzędu przedstawia wzór
C = C
0
− k · t. Dla reakcji pierwszego rzędu wzór ten ma postać: C = C
0
· e
−kt
; czyli C = C
0
· 2,718
−kt
,
a dla reakcji drugiego rzędu: 1 = 1 + k · t.
C C
o
7.
(4 p.)
Reakcja bromoetanu z zasadą sodową w środowisku wodnym jest reakcją drugiego rzędu. War-
tość stałej szybkości tej reakcji w temperaturze 25°C wynosi 8,6 · 10
−5
dm
3
· mol
−1
· s
−1
. Zapisz w formie
jonowej skróconej równanie reakcji bromoetanu z zasadą oraz jej równanie kinetyczne. Oblicz stężenie
bromoetanu po 3,5 godzinach przebiegu tej reakcji, jeżeli początkowe stężenie bromoetanu wynosiło
0,2 mol · dm
−3
.
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
8.
(3 p.)
Podaj, jak na wydajność podanych reakcji wpłynie podwyższenie temperatury, a jak podwyższe-
nie ciśnienia.
1) 2H
2(g)
+ O
2(g)
2H
2
O
(g)
ΔH = – 484 kJ
2) C
3
H
6
O
(g)
+ 4O
2(g)
3CO
2(g)
+ 3H
2
O
(g)
ΔH = –1790 kJ
3) PCl
5(s)
PCl
3(c)
+ Cl
2(g)
ΔH = 92,6 kJ
Podwyższenie temperatury
Podwyższenie ciśnienia
1)
2)
3)
Kinetyka i równowaga chemiczna, termodynamika
41

42
Testy
9.
(1 p.)
Wskaż prawidłowe stwierdzenie:
a) Entalpia jest miarą uporządkowania układu.
b) Entalpia układu spada, gdy przybiega w nim reakcja egzotermiczna.
c) Energia wewnętrzna układu wzrasta, gdy układ wykonuje pracę na otoczeniu.
d) Układ zamknięty to taki, w którym nie następuje wymiana masy i energii z otoczeniem.
10.
(2 p.)
Oblicz entalpię reakcji: N
2
+ O
2
→ 2NO, wiedząc, że entalpia reakcji
N
2
+ 2O
2
→ 2NO
2
wynosi 68,4 kJ, a entalpia reakcji 2NO + O
2
→ 2NO
2
wynosi −114,1 kJ.
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
11.
(4 p.)
Oblicz rozpuszczalność TlCl w wodzie w temperaturze 20°C. Iloczyn rozpuszczalności tego
związku w podanej temperaturze wynosi 10
−4
. Przyjmij gęstość roztworu równą 1 g · cm
−3
. Rozpuszczal-
ność wyraź w g/100 g H
2
O.
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
12.
(2 p.)
Oblicz stałą równowagi reakcji CO
(g)
+ 2H
2(g)
→ CH
3
OH
(g)
, przebiegającej w temperaturze
400 K. Stężenia równowagowe substancji biorących udział w reakcji wynoszą:
[CO] = 0,4 mol · dm
–3
, [H
2
] = 0,8 mol · dm
–3
, [CH
3
OH] = 0,5 mol · dm
–3
.
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................

Kinetyka i równowaga chemiczna, termodynamika
43
Informacja do zadania 13 i 14
Entropia, jedna z funkcji stanu, oznaczana S, jest uważana za miarę nieuporządkowania układu. Im
wyższa entropia, tym nieuporządkowanie większe. Zmianę entropii układu po zajściu procesu fi zyczne-
go lub reakcji chemicznej można obliczyć, odejmując od sumy wartości entropii wszystkich produktów
sumę entropii wszystkich substratów, z uwzględnieniem liczby moli.
13.
(3 p.)
Korzystając z tabeli wartości entropii standardowej, oblicz zmianę standardowej entropii ukła-
du podczas otrzymywania 1 mola bromku sodu z pierwiastków.
Substancja
S
0
[J · mol
−1
· K
−1
]
Na
51,3
Br
2
152,2
NaBr
86,93
....................................................................................................................................................................................
....................................................................................................................................................................................
14.
(2 p.)
Podaj, jak zmieni się entropia lodu po jego stopieniu (wzrośnie, zmaleje czy nie zmieni się).
Odpowiedź uzasadnij.
.............................................................................................................................................
....................................................................................................................................................................................
15.
(5 p.)
Zmieszano 100 cm
3
roztworu AgNO
3
o stężeniu 0,002 mol · dm
–3
z 100 cm
3
roztworu K
2
CrO
4
o stężeniu 0,002 mol · dm
–3
.
Oblicz, czy w tej temperaturze wytrąci się osad Ag
2
CrO
4
. Iloczyn rozpusz-
czalności Ag
2
CrO
4
w temperaturze 25°C wynosi 4 · 10
−12
. Zapisz równanie reakcji.
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
16.
(2 p.)
Wymień dwa sposoby zwiększenia wydajności następującej reakcji:
2NO
(g)
+ O
2(g)
→ 2NO
2(g)
∆H = −114,1 kJ
....................................................................................................................................................................................
....................................................................................................................................................................................
17.
(1 p.)
Wraz ze wzrostem temperatury iloczyn rozpuszczalności z reguły:
a) nie zmienia się
b) maleje
c) wzrasta
d) nie można tego określić
18.
(1 p.)
Korzystając z tablicy wartości stałych dysocjacji K
a
dla kwasów chlorowego(III) i azotowego(III),
wybierz kwas o większej mocy. Podaj jego nazwę.
....................................................................................................................................................................................
19.
(1 p.)
Podaj, ile wyniesie entalpia reakcji rozkładu 1 mola tlenku rtęci(II), jeżeli entalpia tworzenia
tego związku ∆H = −90,78 kJ · mol
−1
.
....................................................................................................................................................................................
20.
(2 p.)
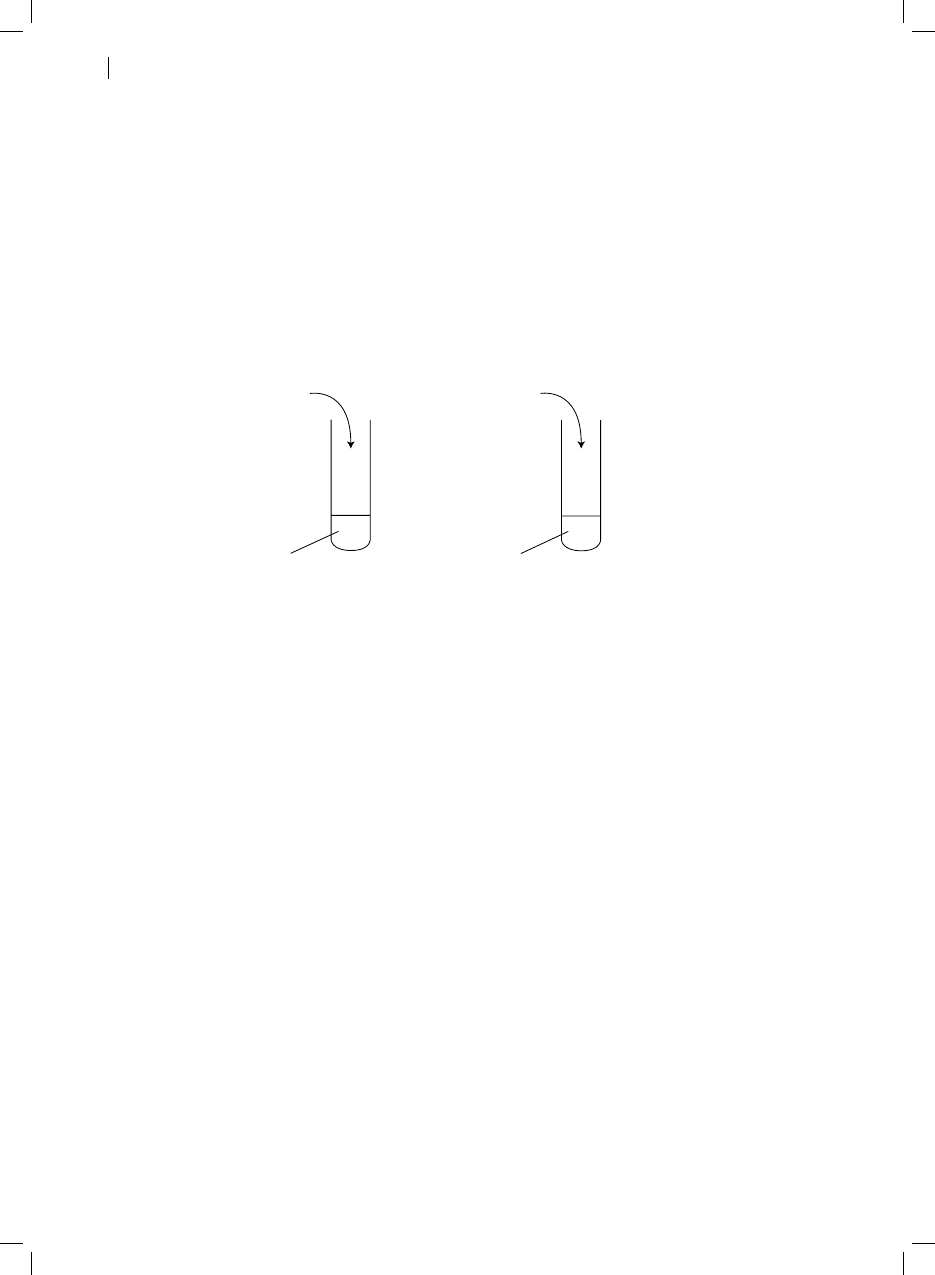
Przedstawione na rysunku doświadczenie przeprowadzono z roztworami wodnymi podanych
substancji. Określ, w której probówce reakcja zajdzie szybciej. Odpowiedź uzasadnij.
....................................................................................................................................................................................
....................................................................................................................................................................................
....................................................................................................................................................................................
KI
1)
Pb(NO
3
)
2
44
Testy
2)
HCl
Na
2
S
2
O
3
Wyszukiwarka
Podobne podstrony:
Klucz do testu Kinetyka i równowaga chemiczna, termodynamika
Laboratorium 5 Kinetyka i równowaga chemiczna
04 Kinetyka reakcji chemicznych i kataliza
7 równowaga chemiczna sprawozdanie
17 kinetyczna teoria gazów i termodynamika II
Lista 4 Równowagi chemiczne
Kinetyczna teoria gazów i termodynamika I
Równowaga chemiczna
Równowagi chemiczne
Wykład 2, Równowagi chemiczne, woda
Chemia IX Rownowagi Chemiczne id 112320
06 Równowaga Chemiczna
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
08 Równowagi chemiczneid 7495
więcej podobnych podstron