
Aminokwasy, peptydy, białka
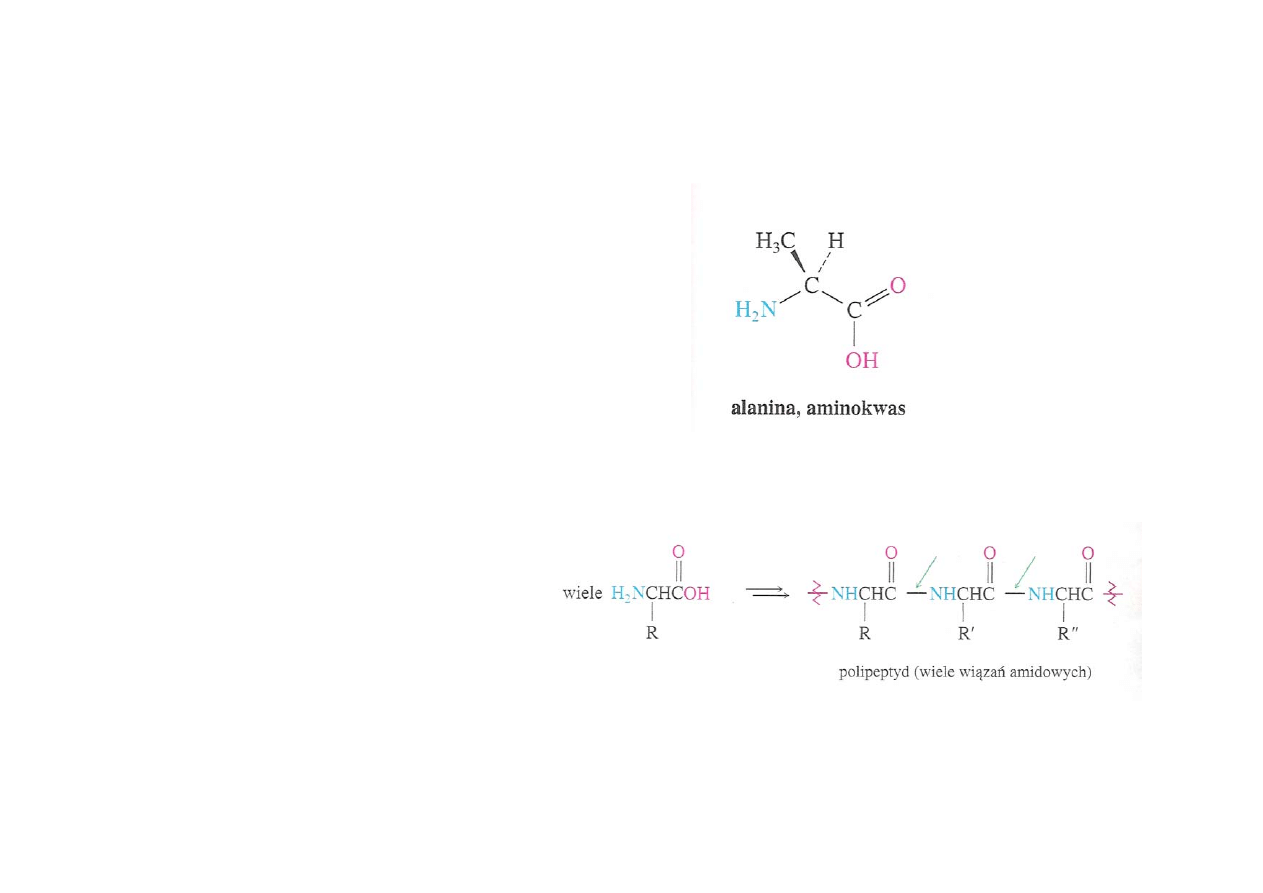
Aminokwasy
Aminokwasy – związki
dwufunkcyjne, zawierające
zasadową grupę aminową
oraz kwasową grupę
karboksylową
Mogą łączyć się ze sobą w
długie łańcuchy poprzez
tworzenie wiązań
peptydowych (wiązania
amidowe) pomiędzy grupą
aminową jednego
aminokwasu i
karboksylową drugiego
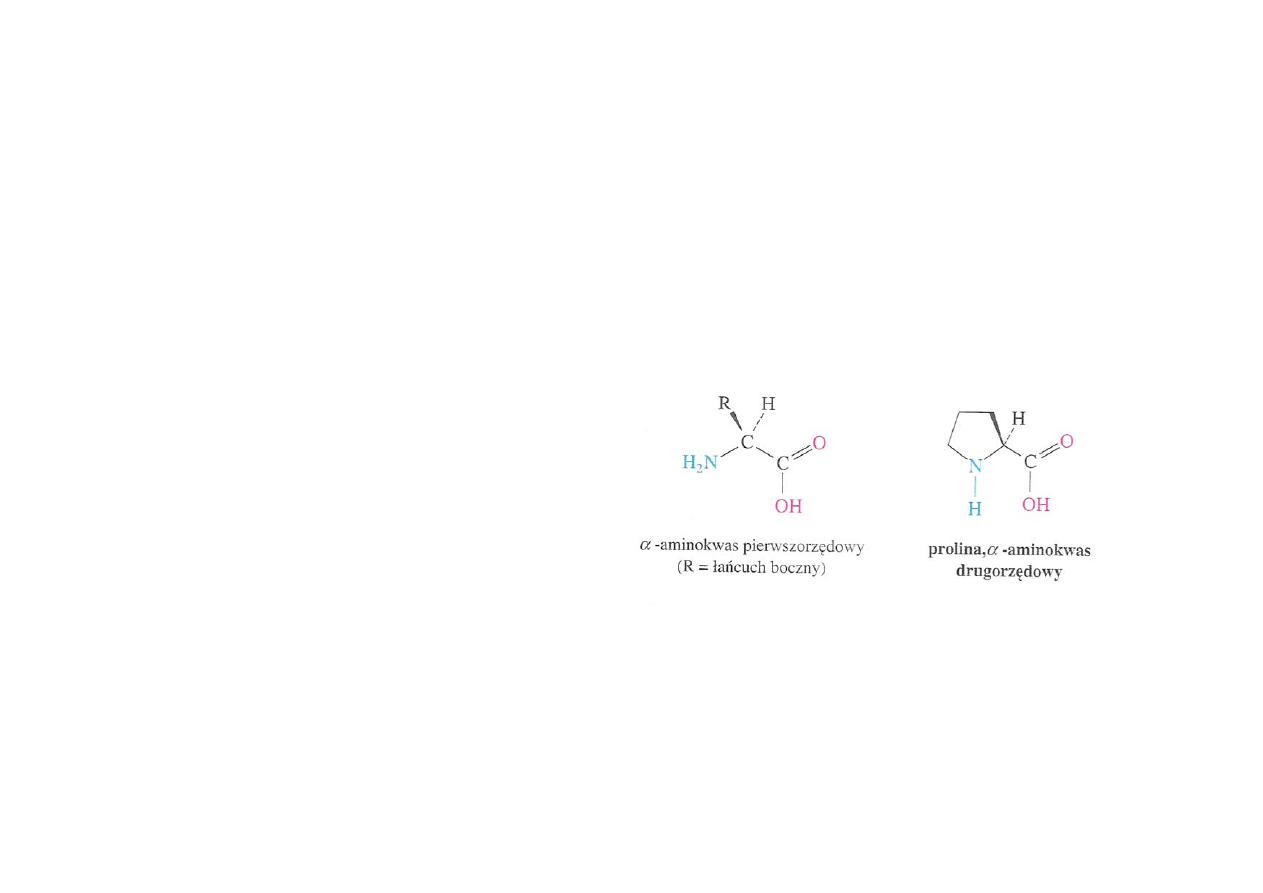
Struktura aminokwasów
Białka zbudowane są z 20
podstawowych aminokwasów –
wszystkie są
α-aminokwasami.
Oznacza to, iż grupa aminowa jest
podstawnikiem na atomie węgla
α
- czyli atomie sąsiadującym z
atomem węgla grupy
karboksylowej.
Ważne i pomocne – ten właśnie
fragment struktury aminokwasów
podstawowych jest niezmienny –
różnią się one jedynie łańcuchem
bocznym – jego strukturą oraz
podstawnikami.
19 spośród 20 aminokwasów
podstawowych to aminy
pierwszorzędowe – jedym
wyjątkiem jest prolina

Charakterystyka aminokwasów
Dla łatwiejszego zapisu wzorów polipeptydów i białek utworzono skróty
charakterystyczne dla nazw aminokwasów – dwa systemy skrótów –
trzyliterowe
(Ala – alanina) oraz jednoliterowe (alanina – A)
Ważne, choć trudne do wyjaśnienia przy tak ograniczonym czasie kursu chemii
organicznej☺
Atomu węgla
α aminokwasów budulcowych (z wyjątkiem glicyny) są centrami
stereogenicznymi. Oznacza to, iż wszystkie aminokwasy mogą wystepować
w dwóch izomerycznych formach (enancjomerach). Przyroda do budowania
struktur białkowychj wykorzystuje wyłącznie jedną z tych form.
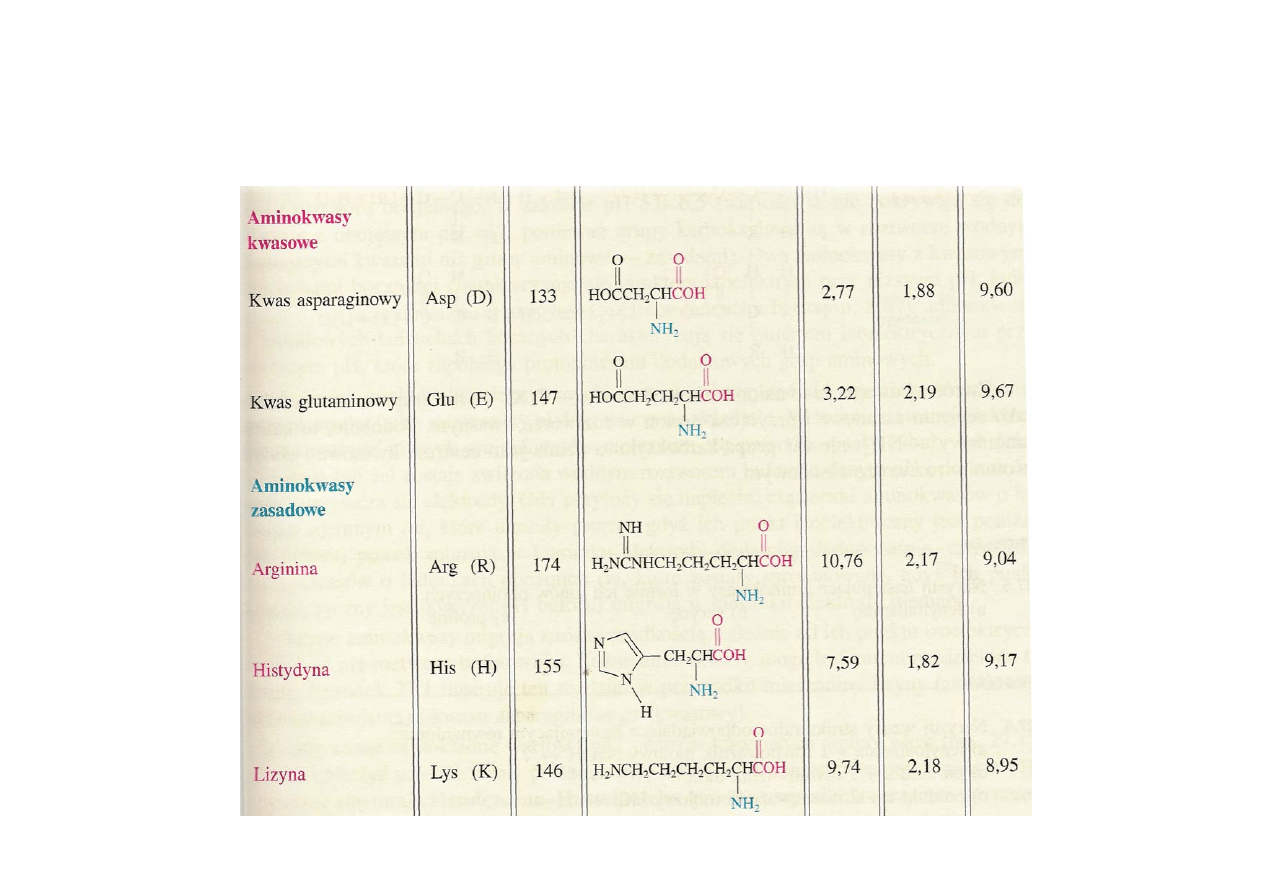
Aminokwasy budulcowe można podzielić na zasadowe, kwasowe i obojętne –
jest to zależne od występowania w łańcuchu bocznym grup o charakterze
kwasowym bądź zasadowym.
Ciekawe?? – organizm ludzki zdolny jest do syntezowania 10 spośród 20
niezbędnych do budowania białek aminokwasów – pozostałe 10 to
aminokwasy podstawowe – musimy pozyskiwać je wraz z pokarmem.
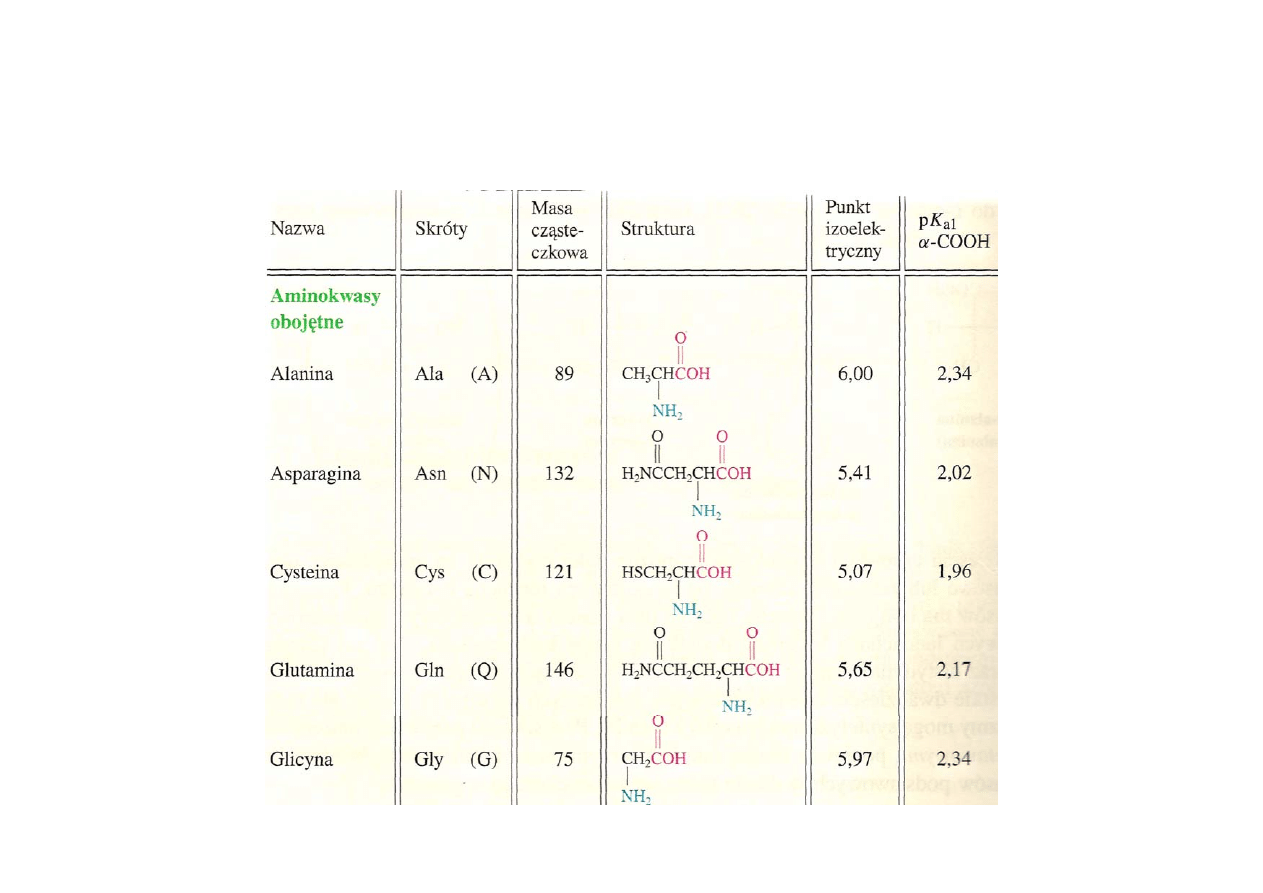
Aminokwasy – wzory, skróty, nazwy
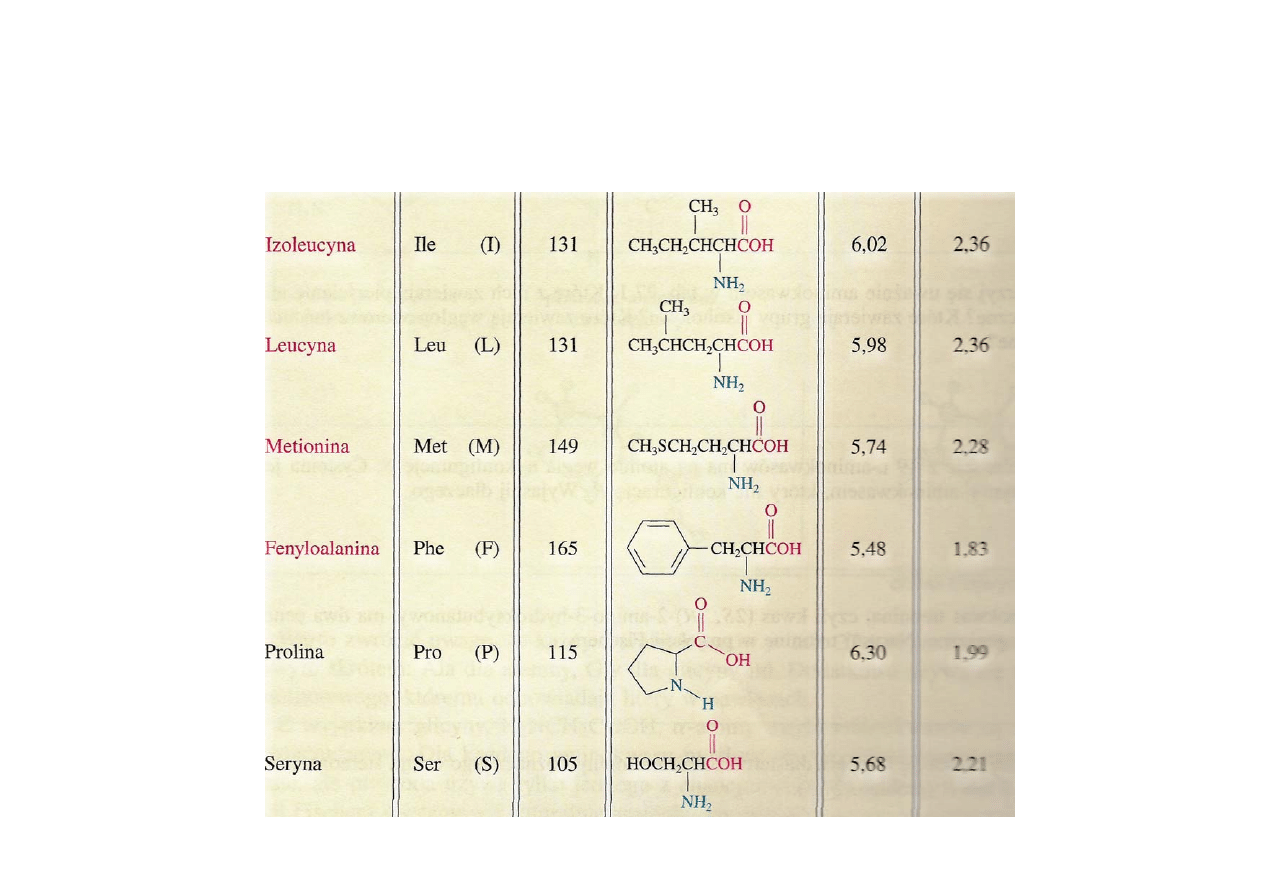
cd.
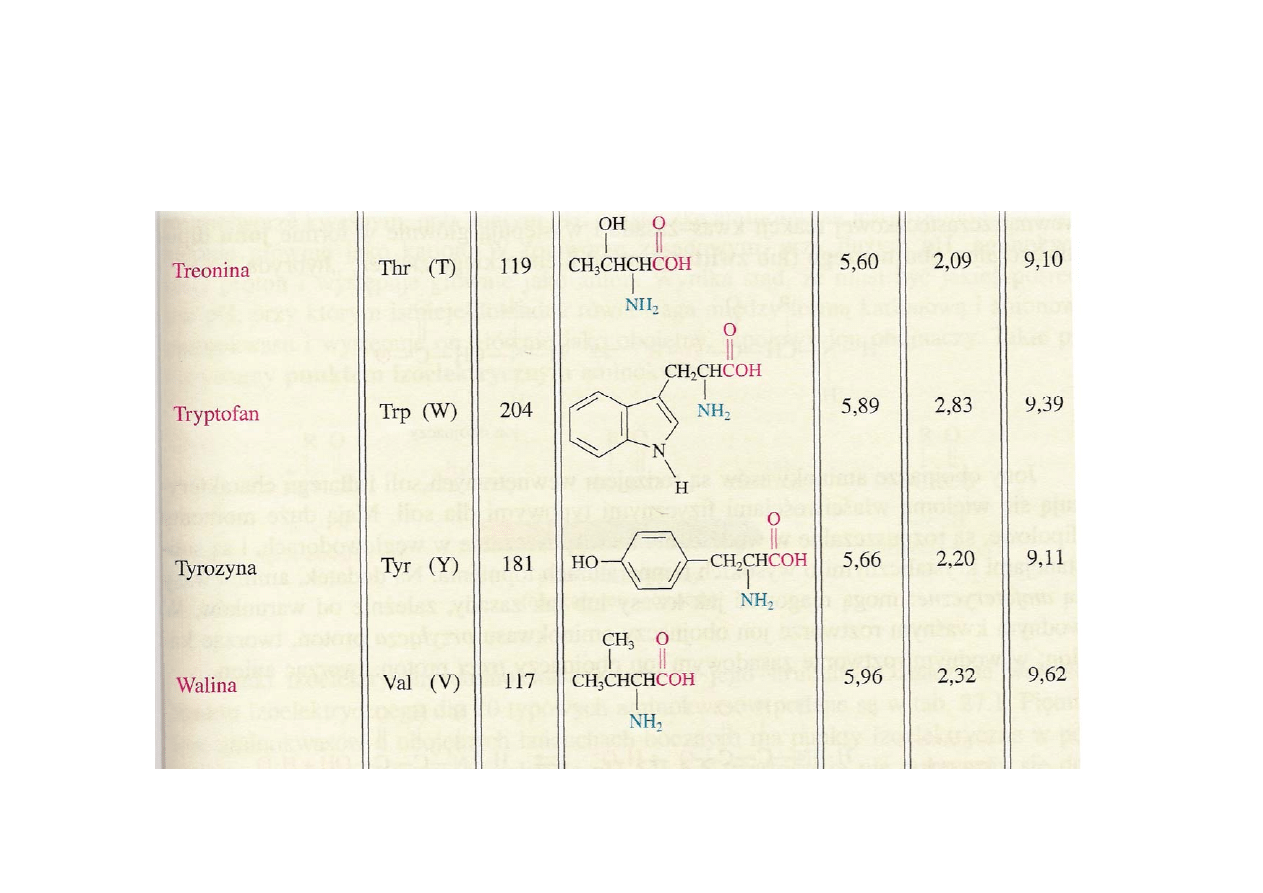
cd.
cd.
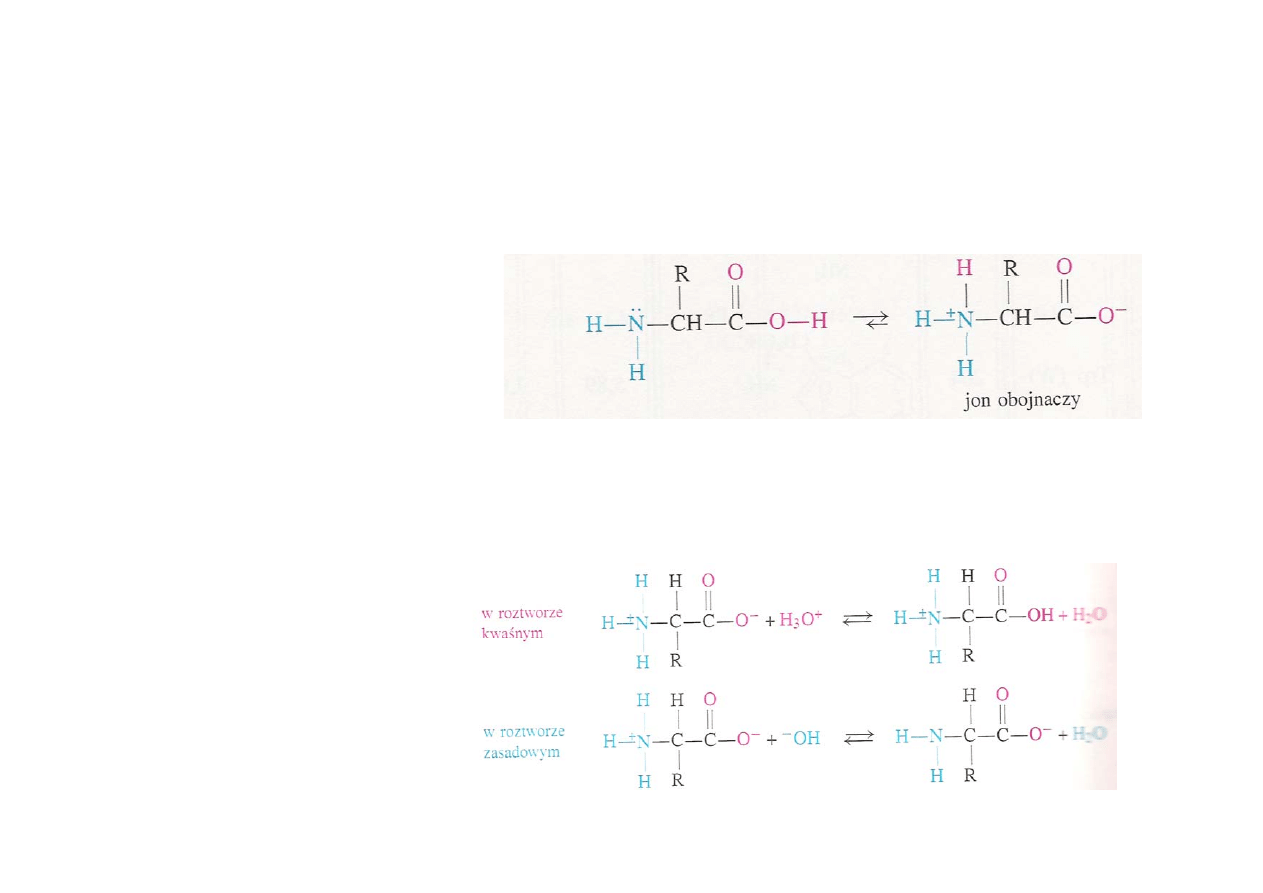
Dipolowa natura aminokwasów
Z uwagi na obecność w
aminokwasach zarówno
grupy aminowej jak
karboksylowej, ulegają
one
wewnątrzcząsteczkowej
reakcji kwas-zasada; w
związku z tym występują
w postaci zwitterjonu,
jonu obojnaczego
Aminokwasy są
amfoteryczne, w
zależności od
środowiska mogą
zachowywać się jak
kwasy bądź zasady
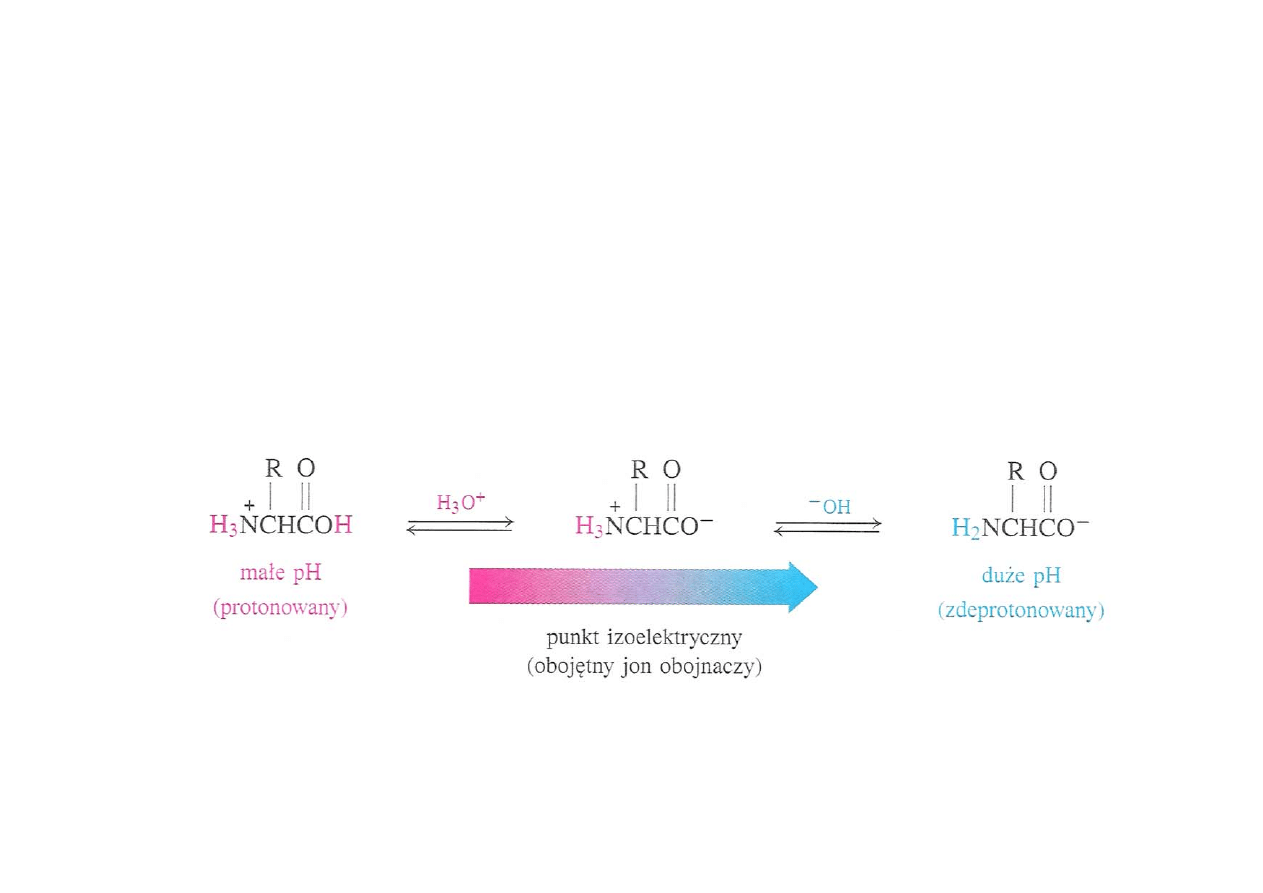
Punkt izoelektryczny
Punktem izoelektrycznym nazywamy takie pH roztworu, przy którym
istnieje równowaga między formą kationową i anionową aminokwasu
– stężenie jonu obojnaczego jest wtedy najwyższe.
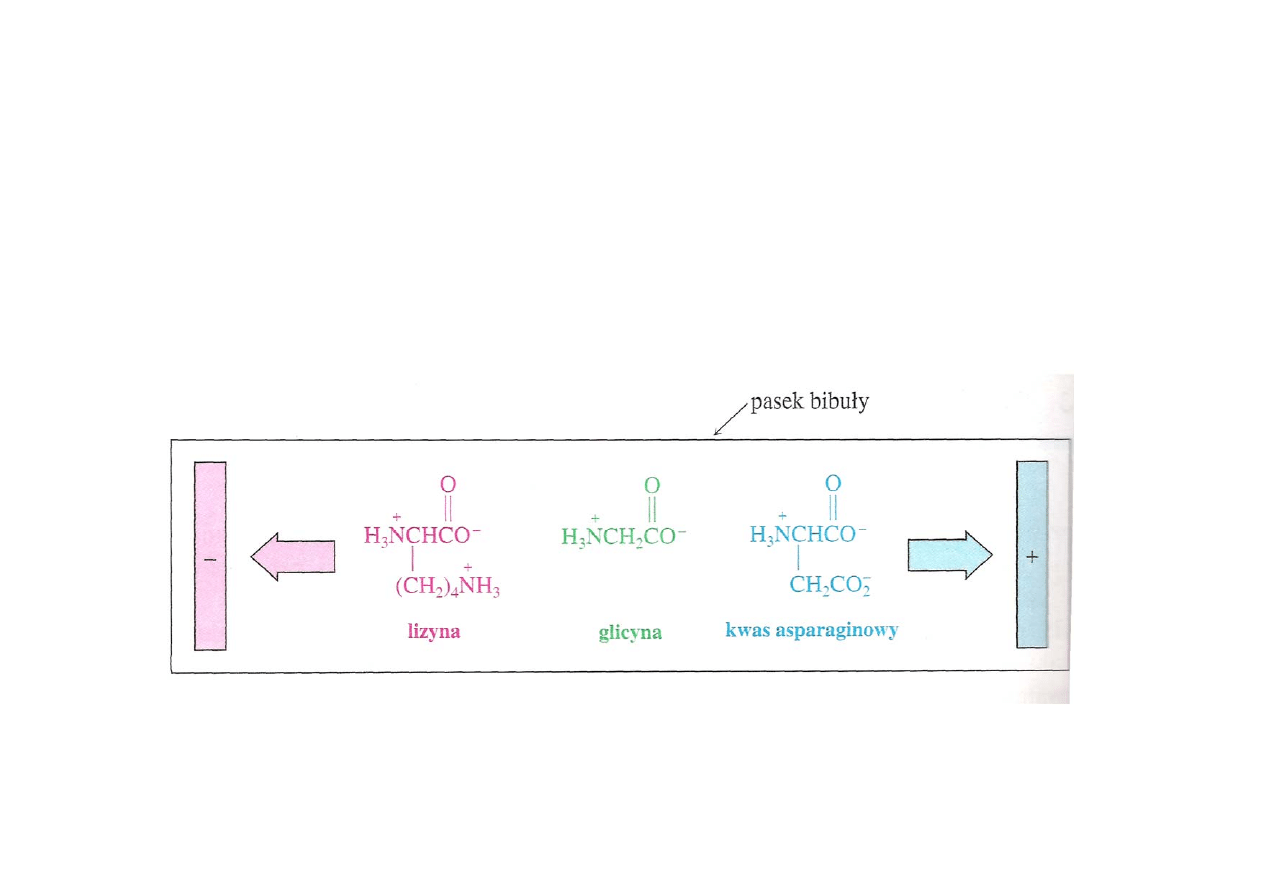
Elektroforeza
Elektroforeza – rozdział aminokwasów pod wpływem pola
elektrycznego
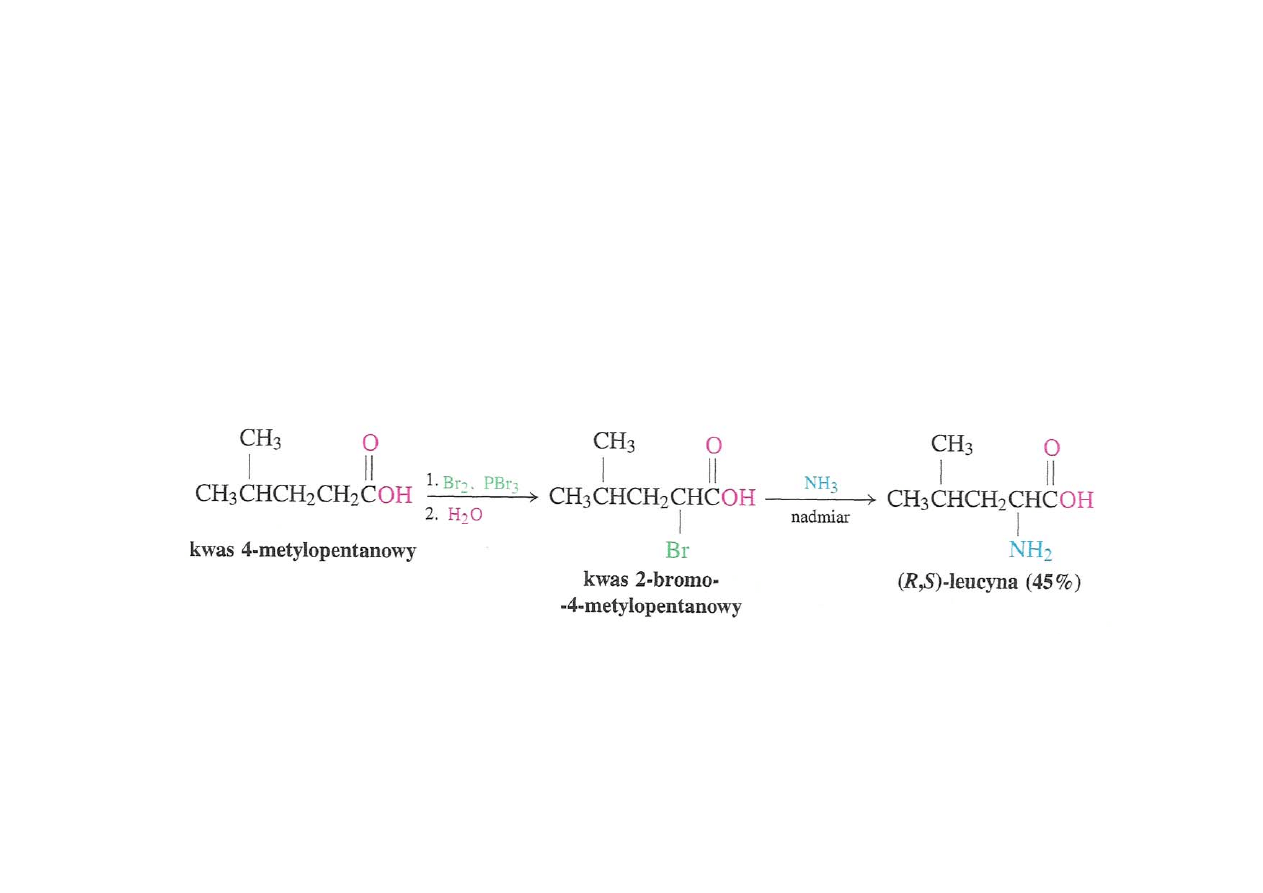
Synteza
α-aminokwasów
Podstawienie nukleofilowe
α-bromokwasu
amoniakiem (poprzedzone reakcją HVZ)
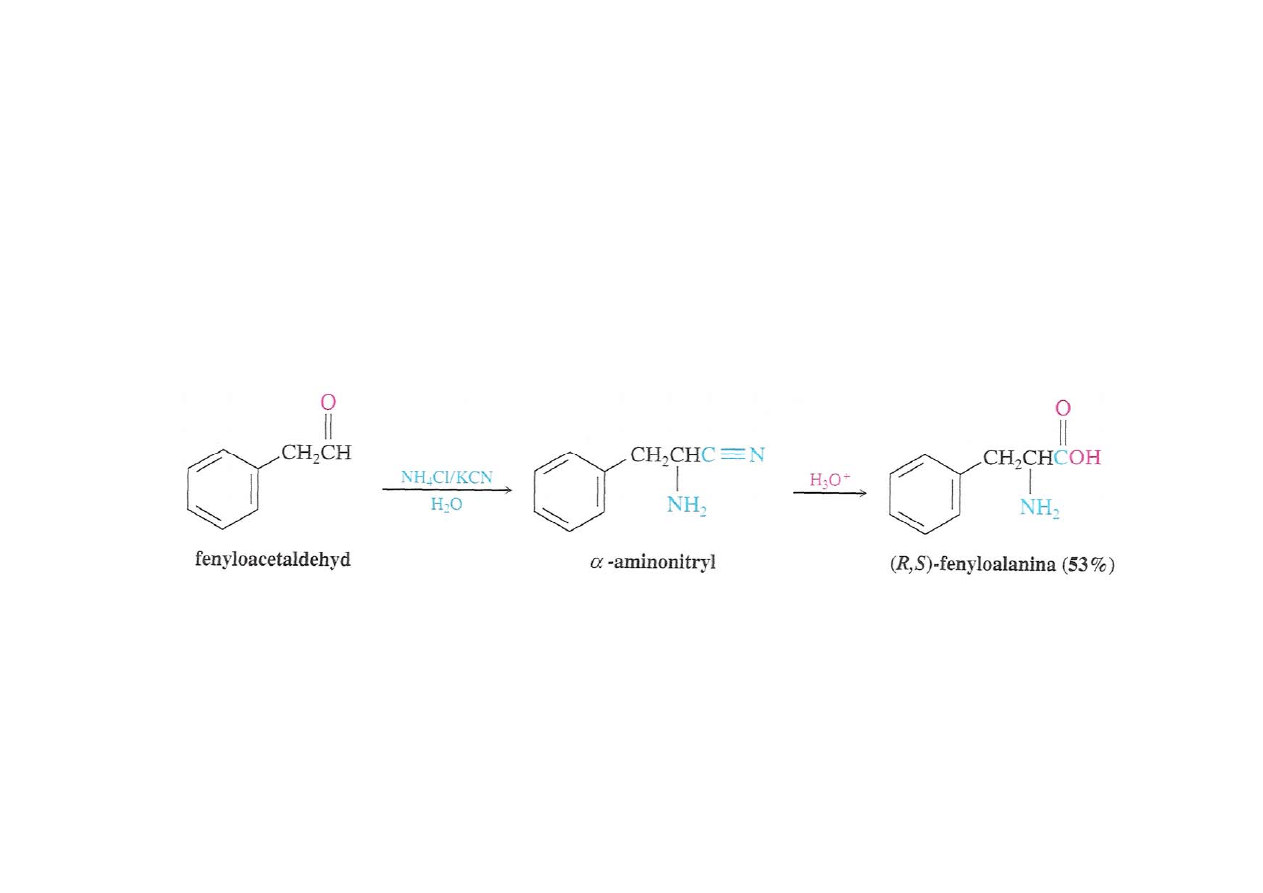
Synteza Streckera
Traktowanie aldehydu KCN i wodą amioniakalną – hydroliza
powstałego aminonitrylu prowadzi do aminokwasu
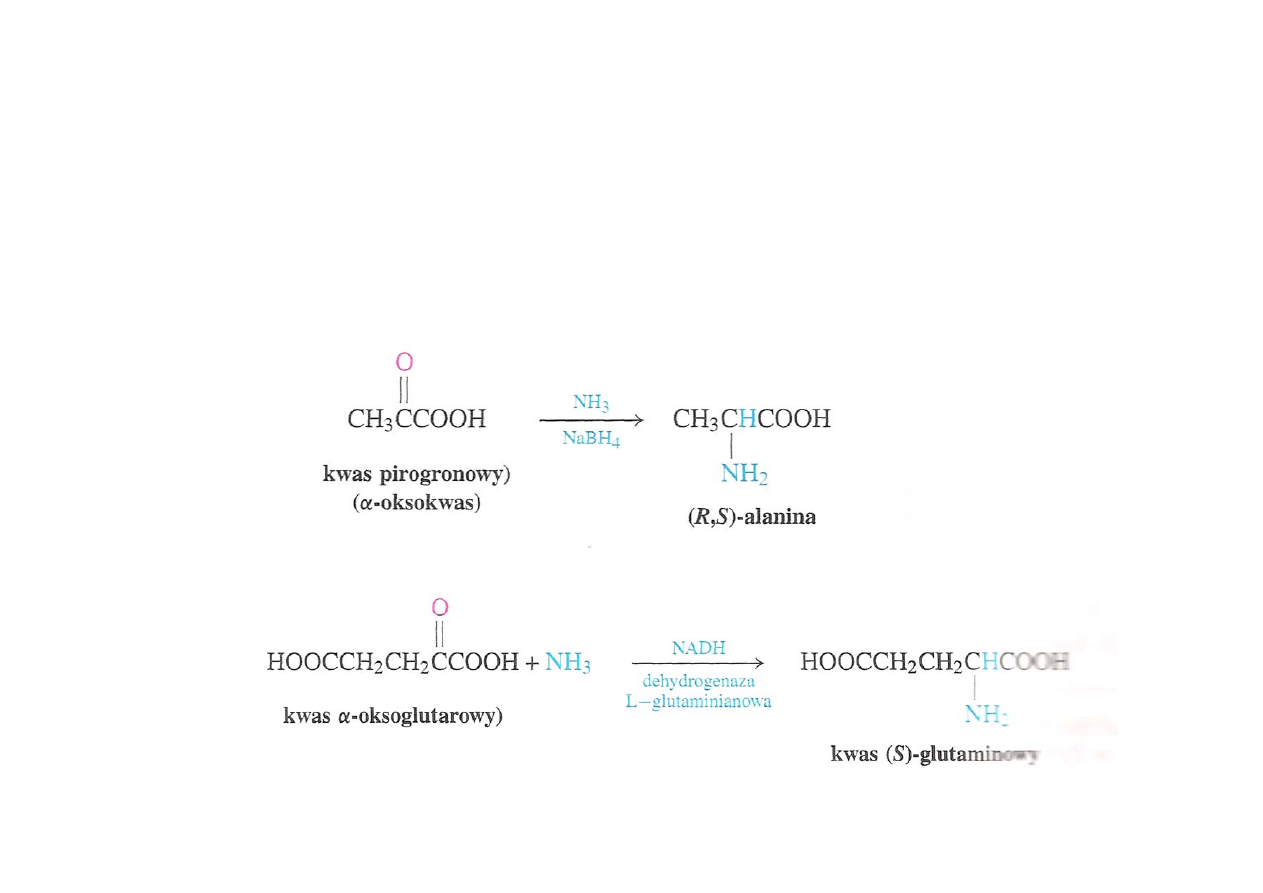
Redukcyjne aminowanie
α-oksokwasów
biosynteza
Redukcyjne aminowanie
α-oksokwasów za pomocą amoniaku i środka
redukującego – analogia do procesów biologicznych
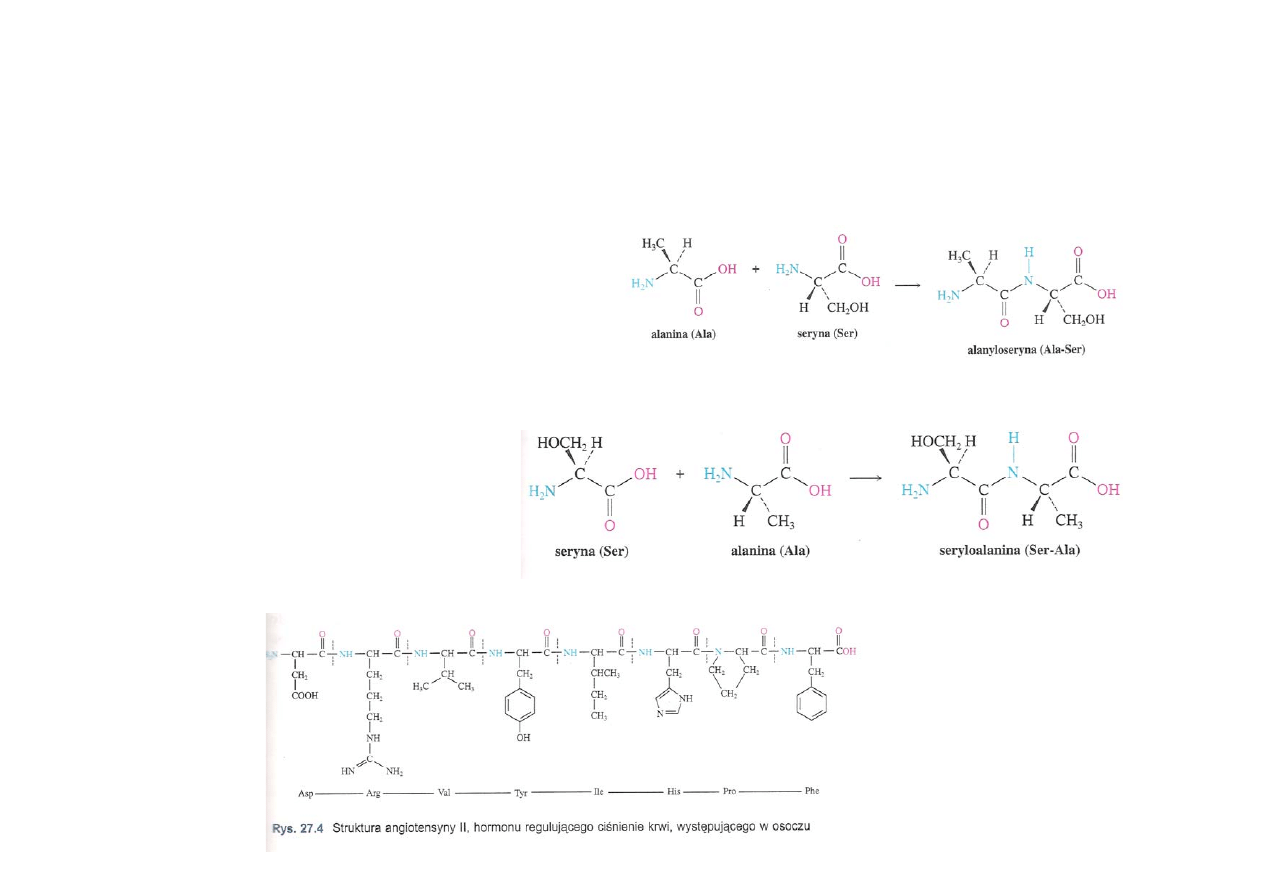
Peptydy
Peptydy – polimery
aminokwasów, w
których pojedyncze
jednostki
aminokwasowe zwane
resztami
aminokwasowymi są
połączone ze sobą
wiązaniami amidowymi
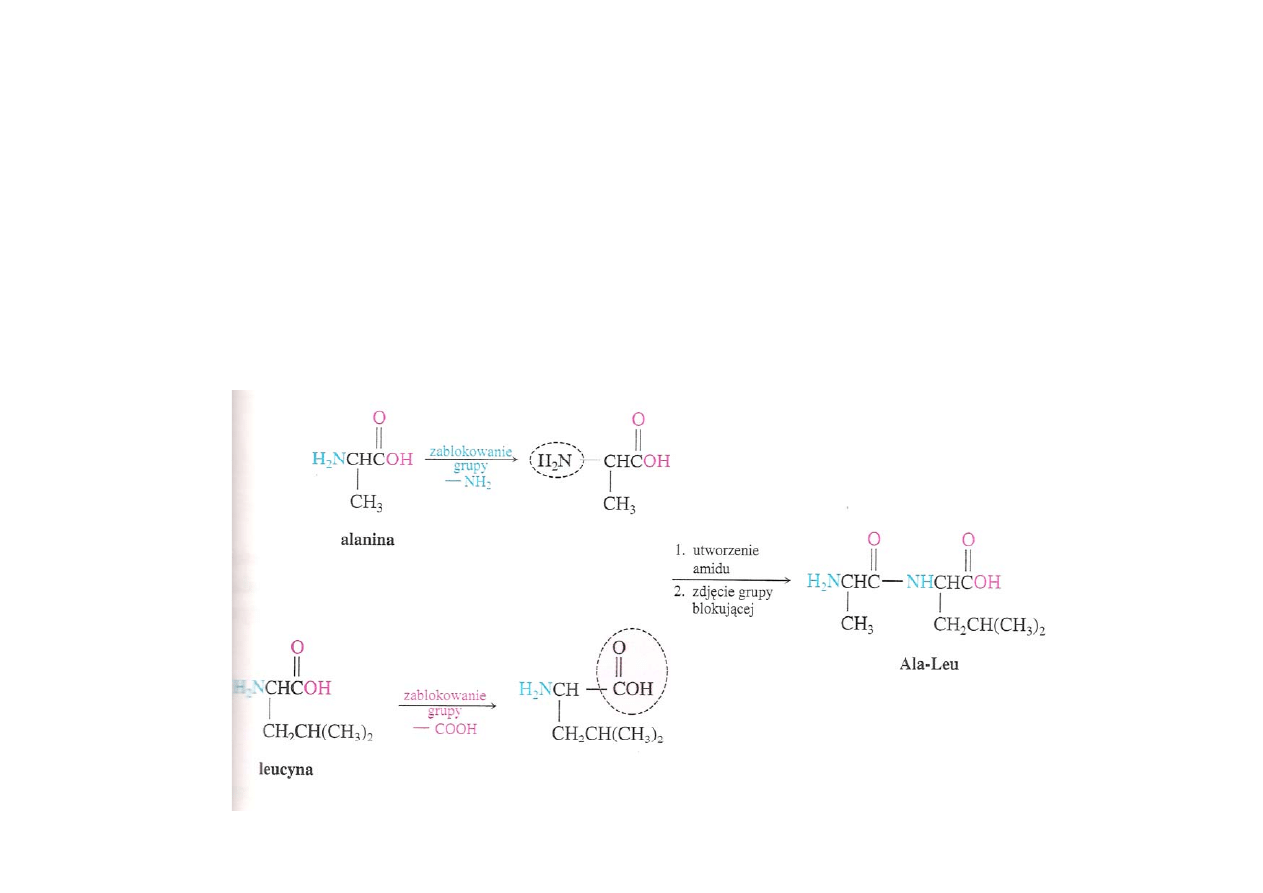
Synteza peptydów
Synteza peptydów wymaga zachowania ich sekwencji w łańcuchu
peptydowym. W tym celu konieczne jest blokowanie. Należy
zablokować wszystkie grupy aminowe i karboksylowe, które nie mają
ze sobą reagować
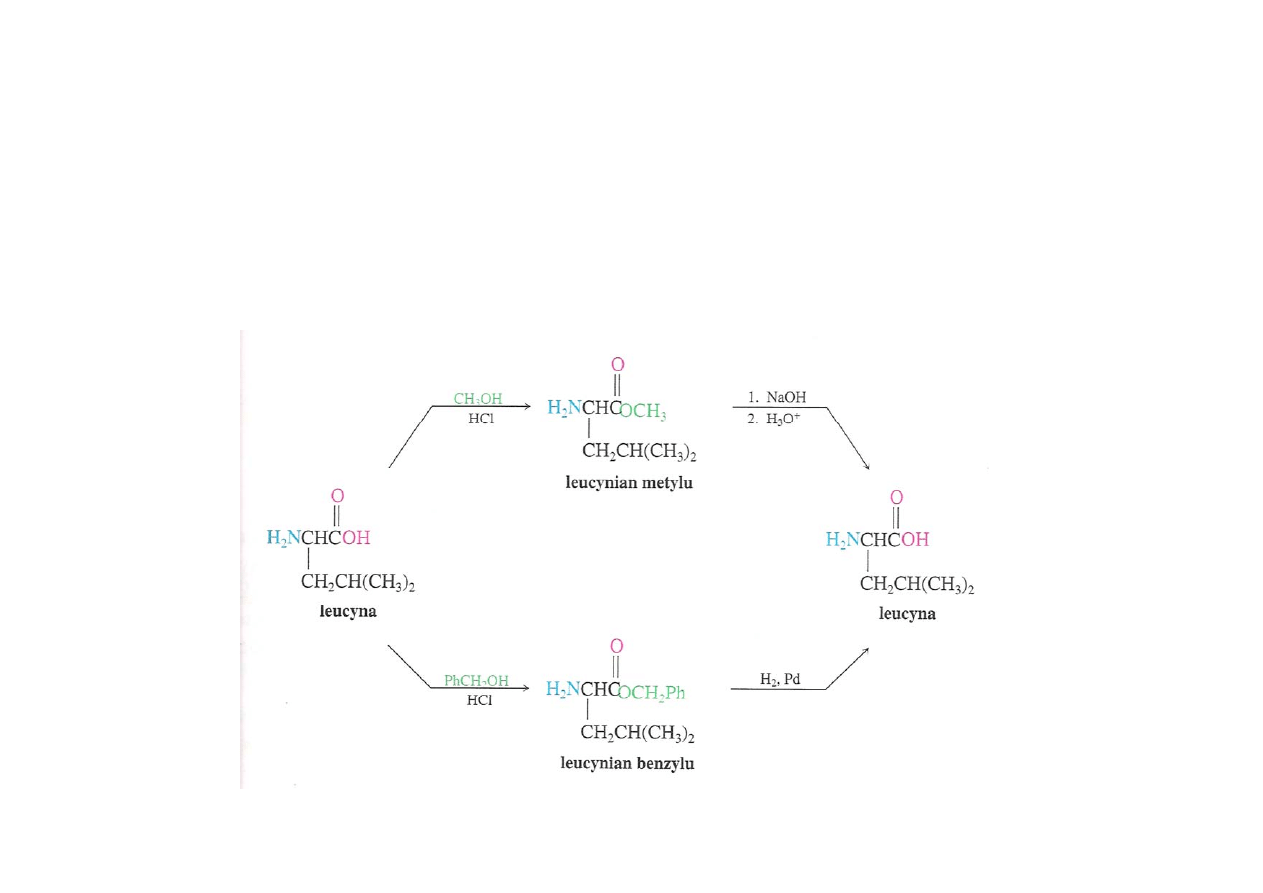
Blokowanie grupy karboksylowej
Najczęściej grupę karboksylową blokuje się poprzez przekształcenie
jej w ester (np. metylowy lub benzylowy)
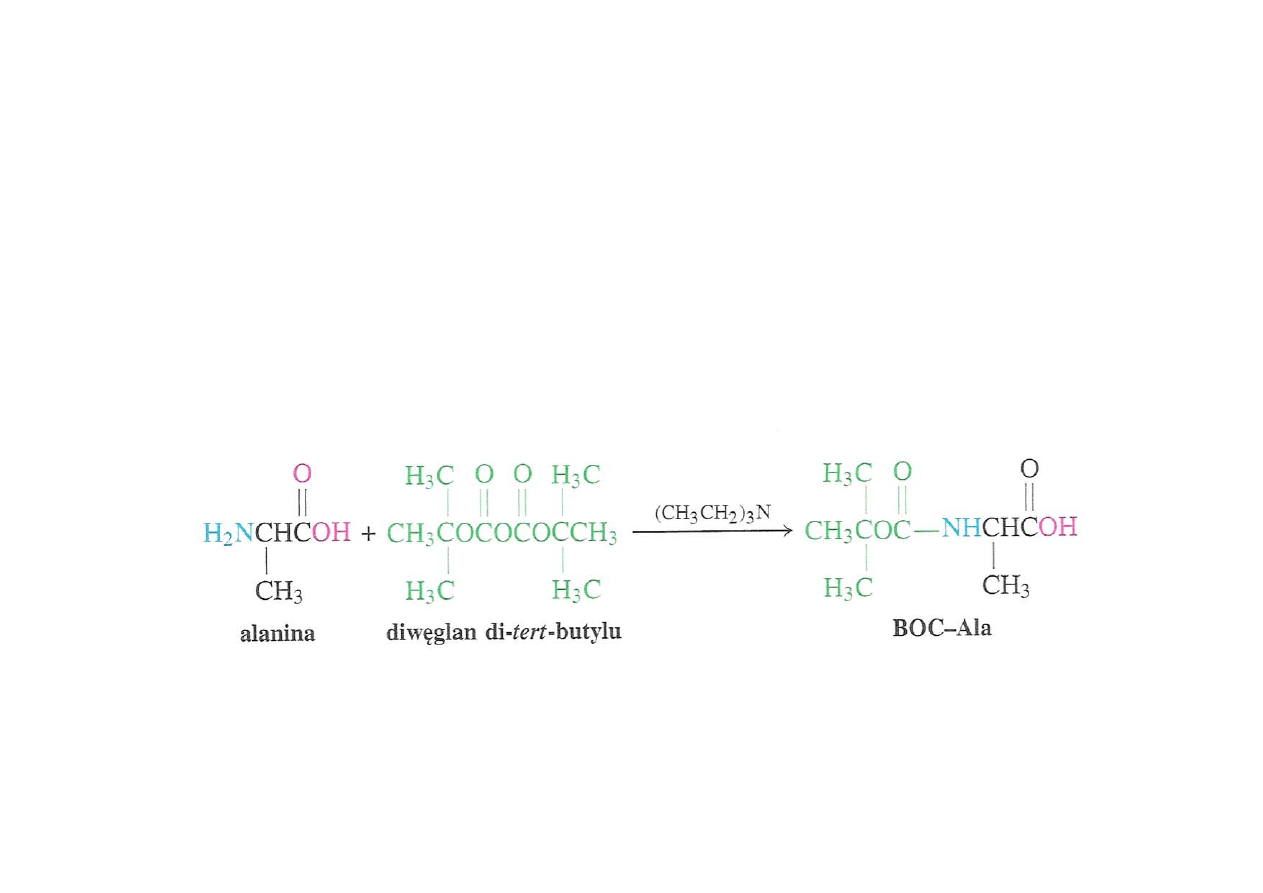
Blokowanie grupy aminowej
Grupy aminowe łatwo blokuje się na drodze reakcji z diwęglanem
di-tert-butylu otrzymując pochodne tert-butoksykarbonyloamidowe
(BOC)

Synteza dipeptydu
Wiązanie peptydowe zwykle tworzy się działając na mieszaninę
blokowanego kwasu i aminy dicykloheksylokarbodiimidem (DCC)

Klasyfikacja białek

Struktura białek
Struktura pierwszorzędowa – sekwencja aminokwasów w
łańcuchu peptydowym
Struktura drugorzędowa - odnosi się do tego, w jaki
sposób segmenty łańcucha polipeptydowego ułożone są
w przestrzeni
Struktura trzeciorzędowa – określa kształt zwinięcia się
całej cząsteczki białka
Struktura czwartorzędowa - opisuje sposób w jaki kilka
cząsteczek białka łączy się ze sobą w agregaty
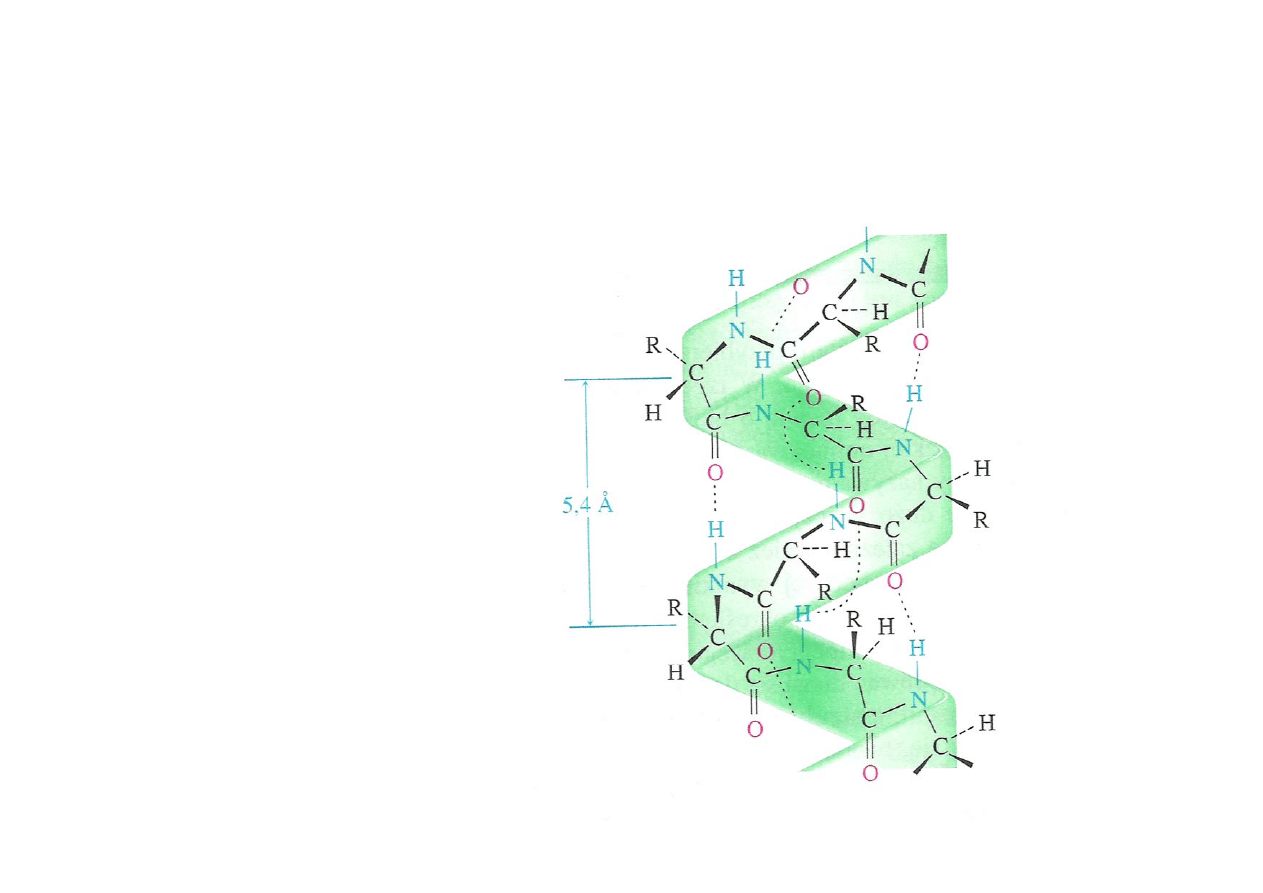
Struktura drugorzędowa
α-helisa stabilizowana
przez wiązania
wodorowe między
amidowymi grupami
N-H i grupami C=O
jednostek odległych
o 4 pozycje w
łańcuchu

Struktura drugorzędowa cd.
Harmonijka
β
(pofałdowany arkusz
β
) – łańcuchy układają się
równolegle do siebie i są utrzymywane w tym ułożeniu przez
wiązania wodorowe między sąsiednimi łańcuchami
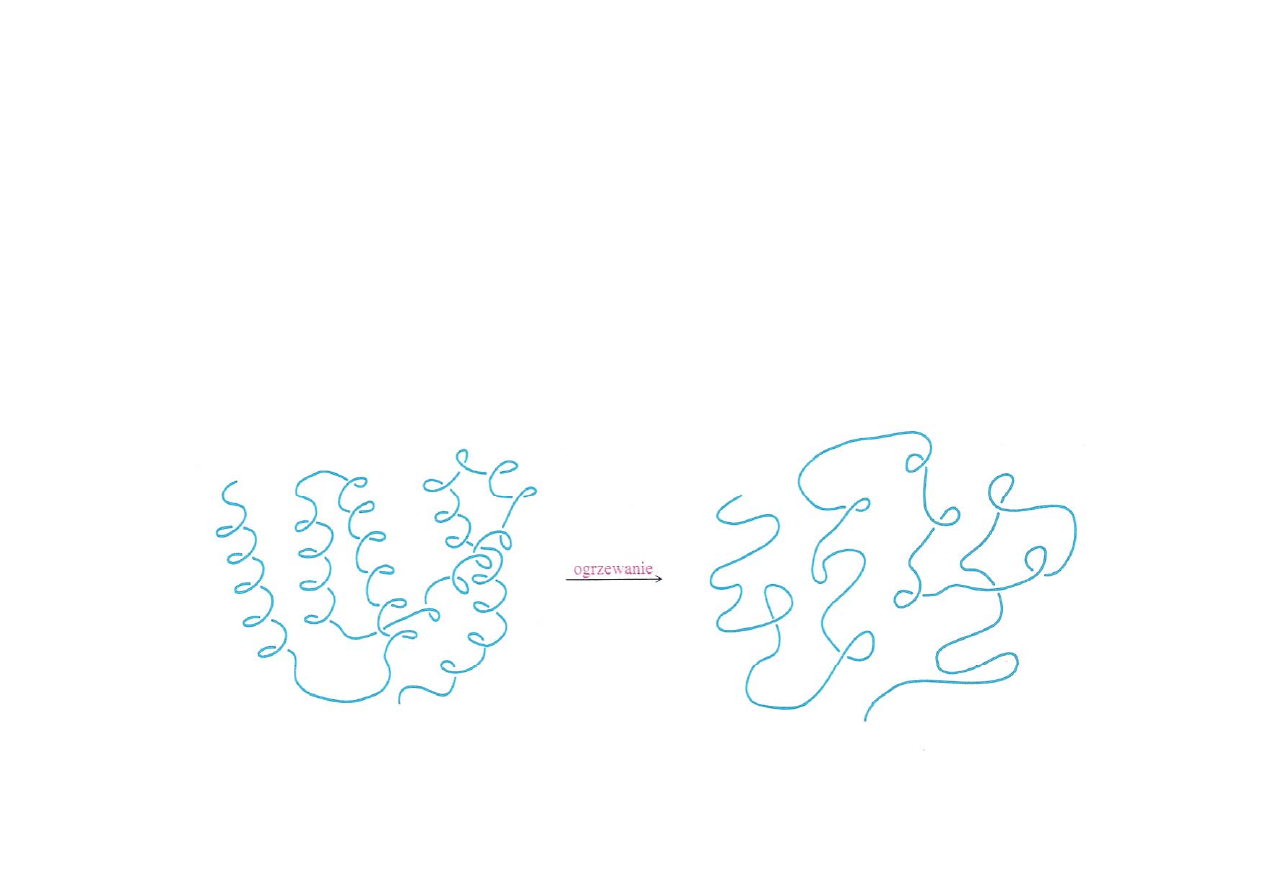
Denaturacja białek
Denaturacja – zniszczenie (zazwyczaj nieodwracalne) struktury
trzeciorzędowej białek pod wpływem zmiany temperatury lub pH. W
przypadku procesu odwrotnego (powrotu białka do właściwej
struktury trzeciorzędowej) mówimy o zjawisku renaturacji
Document Outline
- Aminokwasy, peptydy, białka
- Aminokwasy
- Struktura aminokwasów
- Charakterystyka aminokwasów
- Aminokwasy – wzory, skróty, nazwy
- cd.
- cd.
- cd.
- Dipolowa natura aminokwasów
- Punkt izoelektryczny
- Elektroforeza
- Synteza -aminokwasów
- Synteza Streckera
- Redukcyjne aminowanie -oksokwasów biosynteza
- Peptydy
- Synteza peptydów
- Blokowanie grupy karboksylowej
- Blokowanie grupy aminowej
- Synteza dipeptydu
- Klasyfikacja białek
- Struktura białek
- Struktura drugorzędowa
- Struktura drugorzędowa cd.
- Denaturacja białek
Wyszukiwarka
Podobne podstrony:
01 Aminokwasy, peptydy, białka, enzymyid 3054 ppt
68 Aminokwasy peptydy i bialka(1)
aminokwacy cd, białka wyklad2
68 Aminokwasy peptydy i bialka
BCH Aminokwasy, peptdy i bialka Nieznany (2)
Aminokwasy,peptydy,białka i inne
Aminokwasy, peptydy, białka
Chemia 6 Aminokwasy Peptydy i Białka
AMINOKWASY, PEPTYDY, BIAŁKA
AMINOKWASY BIAŁKOWE I BIAŁKA, MATURA !!!, CHEMIA, Chemia R, Różne zadania i testy
Aminokw,peptydy,białka,enzymy
01 Aminokwasy, peptydy, białka, enzymyid 3054 ppt
Aminokwasy, peptydy, białka
Chemia 6 Aminokwasy Peptydy i Białka
Aminokwasy, peptydy, białka
więcej podobnych podstron