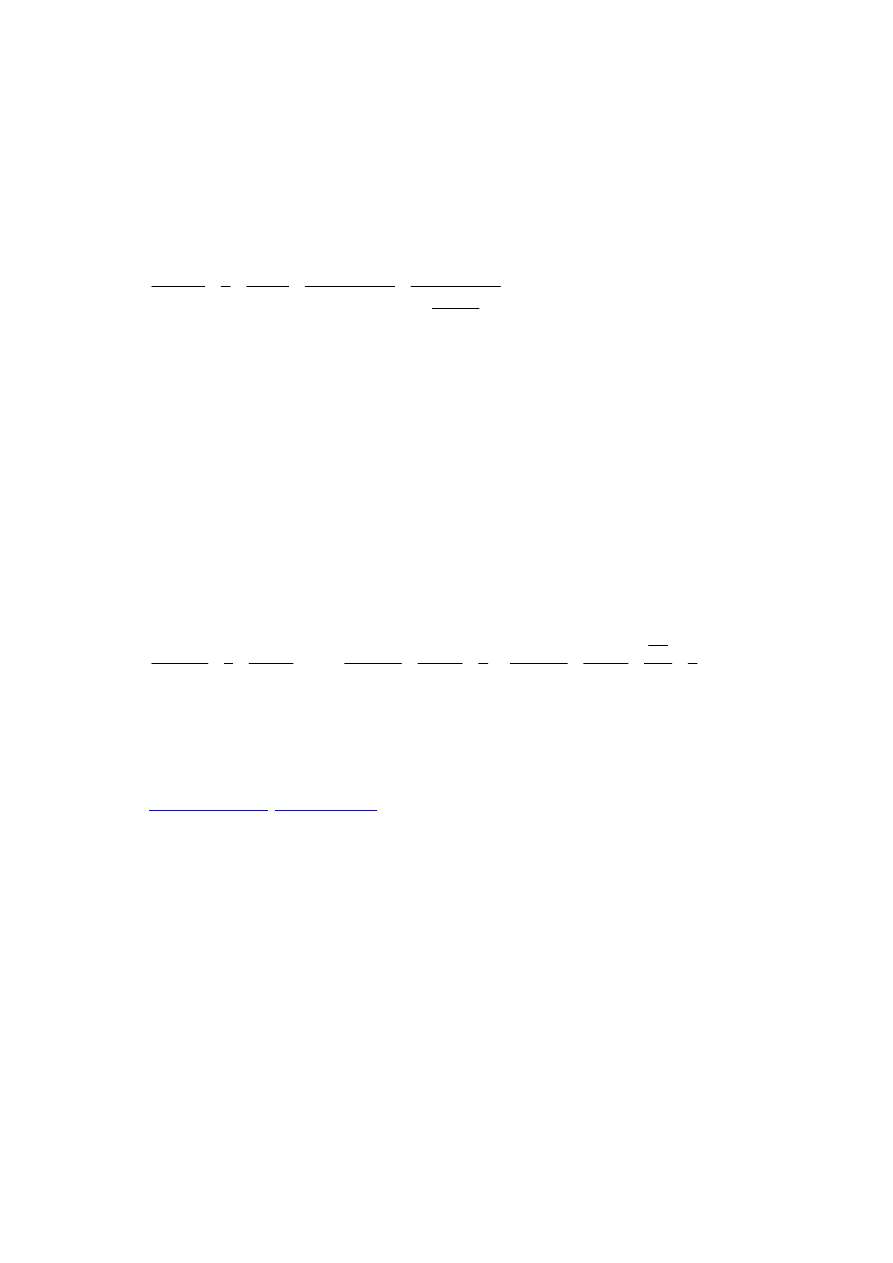
1. Reakcje KMnO
4
z: H
2
C
2
O
4
, H
2
O
2
, FeSO
4
, K
2
C
2
O
4
, Na
2
C
2
O
4
, K
2
O
2
, Na
2
O
2
,
Fe(NH
4
)
2
(SO
4
)
2
·6H
2
O (sól Mohra) w środowisku H
2
SO
4
(zapis jonowy lub
cząsteczkowy); trzeba uzgodnić równanie ‘redoks’, a potem napisać odpowiednią
proporcję wg poniższego wzoru, np.
5H
2
C
2
O
4
+ 2KMnO
4
+ 3H
2
SO
4
→ K
2
SO
4
+ 2MnSO
4
+ 10CO
2
+ 8H
2
O
;
2
5
4
4
4
2
2
4
2
2
4
4
4
2
2
4
2
2
4
4
2
2
4
4
2
2
KMnO
KMnO
O
H
C
O
H
C
KMnO
KMnO
O
H
C
O
H
C
KMnO
O
H
C
M
m
c
V
c
V
c
V
n
n
KMnO
O
C
H
⋅
=
⋅
⋅
=
=
=
Dodatkowo wskazać utleniacz i reduktor; substancję wzorcową i wskaźnik w
manganometrii, autokataliza.
2. Reakcje K
2
Cr
2
O
7
z: KI w środowisku H
2
SO
4
i HCl (zapis jonowy lub cząsteczkowy);
reakcje jodu cząsteczkowego z Na
2
S
2
O
3
; stopnie utlenienia siarki w Na
2
S
2
O
3
i Na
2
S
4
O
6
, i
wzory strukturalne tych soli; oznaczanie CuSO
4
, Fe
2
(SO
4
)
3
; trzeba uzgodnić równanie
‘redoks’, a potem napisać odpowiednią proporcję wg poniższego wzoru, np.
K
2
Cr
2
O
7
+ 6KI + 7H
2
SO
4
→ 4K
2
SO
4
+ Cr
2
(SO
4
)
3
+ 3I
2
+ 7H
2
O;
I
2
+ 2Na
2
S
2
O
3
→ 2NaI + Na
2
S
4
O
6
;
6
1
2
3
2
1
;
1
3
2
2
3
2
2
7
2
2
3
2
2
2
7
2
2
2
3
2
2
7
2
2
3
2
2
2
7
2
2
2
=
=
=
⇒
=
=
=
=
I
I
O
S
Na
O
Cr
K
O
S
Na
I
O
Cr
K
I
n
n
n
n
O
S
Na
O
Cr
K
n
n
O
S
Na
I
dalej
a
n
n
O
Cr
K
I
Dodatkowo wskazać utleniacz i reduktor; substancję wzorcową i wskaźnik w jodometrii.
Obliczanie zawartości procentowej miedzi w rudzie miedzi.
3.
towaryur@gmail.com
,
zywienieur@wp.pl
Wyszukiwarka
Podobne podstrony:
III KOLOKWIUM PYTANIA
III KOLOKWIUM PYTANIA
Kolokwium I pytaniaa, Semestr III, Petrografia, pytania na kolosy Petro
Kolokwium I pytania, Semestr III, Petrografia, pytania na kolosy Petro
Kolokwium III z histologii pytania 09 10
zagraniczni, HLP - KOLEGIUM 3 ROK - kolokwia+pytania do Pustego
WYKŁAD 8- c.d.7 i Zakażenia szpitalne, GUMed, Medycyna, Mikrobiologia, Mikrobiologia, III KOLOKWIUM
I KOLOKWIUM PYTANIA
Biologia kolokwium pytania 09r
Kolokwium pytania na pit
kolokwium1 pytania
penetracja ekspresywność plejotropia, genetyka, kolokwia pytania i odp
Kolokwium pytania
KOLOKWIUM PYTANIA 8
V KOLOKWIUM PYTANIA
kolokwia pytania kolos 3
fizjoterapia kolokwium pytania
II KOLOKWIUM PYTANIA
BIOCHEMIA - VII - 13.11.2000, materiały medycyna SUM, biochemia, Kolokwium III, wykłady do II
więcej podobnych podstron