Wykład z Chemii Fizycznej
Wykład z Chemii Fizycznej
wersja 2009
Katedra i Zakład Chemii Fizycznej
Katedra i Zakład Chemii Fizycznej
Collegium
Collegium Medicum
Medicum w Bydgoszczy
w Bydgoszczy
Uniwersytet Mikołaja Kopernika w Toruniu
Uniwersytet Mikołaja Kopernika w Toruniu
dr hab. Piotr Cysewski, prof.
dr hab. Piotr Cysewski, prof. nadzw
nadzw. UMK
. UMK
piotr.cysewski@cm.umk.pl
piotr.cysewski@cm.umk.pl
www.chemfiz.cm.umk.pl
www.chemfiz.cm.umk.pl/dydaktyka
/dydaktyka
1. Przedmiot i zadania chemii fizycznej
2. Chemia Fizyczna jako nauka eksperymentalna
3. Uzupełnienie z matematyki
Część 1
Część 1
Wprowadzenie i pojęcia podstawowe
pomiar → interpretacja → obliczenia (analiza)
Przedmiot i zadania chemii fizycznej
Zadania chemii Fizycznej:
Jakościowa oraz ilościowa charakterystyka podstawowych praw rządzących
organizacją cząsteczek oraz atomów w struktury makroskopowe takie jak:
- układy homogeniczne oraz heterogeniczne w stanach skupienia:
gazowym, ciekłym lub w postaci ciała stałego
- układy i agregaty układów:
żele, membrany, chromosomy, komórki, organizmy
Nazwę swą Chemia Fizyczna zyskała w XIX wieku,
kiedy to zaczęto do chemii przykładać rygory (i metodykę) fizyki.
Przemiany fizyczne i chemiczne materii (bez wyróżniana jej rodzaju) i
związane z nimi przepływy energii.
Metoda fenomenologiczna
Matematyczno-fizyczna: tworzenie modeli teoretycznych w oparciu o
obserwacje doświadczalne. Formułowanie hipotez, teorii oraz praw
Wykład z Chemii Fizycznej str. 1.1 / 2
1.1. Wprowadzenie
Model teoretyczny - pewien założony mechanizm zjawiska lub obraz i
zespół właściwości obiektu, najczęściej uproszczony, starający się
zawrzeć najistotniejsze jego cechy.
Hipotezą jest pewne założenie dotyczące istoty badanego zjawiska,
właściwie próba odgadnięcia modelu w oparciu o znane dotąd znane
pojęcia i prawa.
Teorią nazywamy hipotezę zweryfikowaną w wyniku dalszych badań, gdy
zyskuje ona potwierdzenie i stosuje się do większej liczby przypadków
(obiektów, zjawisk), często pokrewnych.
Prawo natury (prawo fizykochemiczne) to jasno sformułowany fragment
teorii dotyczący jednego konkretnego zjawiska, czyli powiązania między
różnymi, obserwowalnymi wielkościami uwikłanymi w to zjawisko.
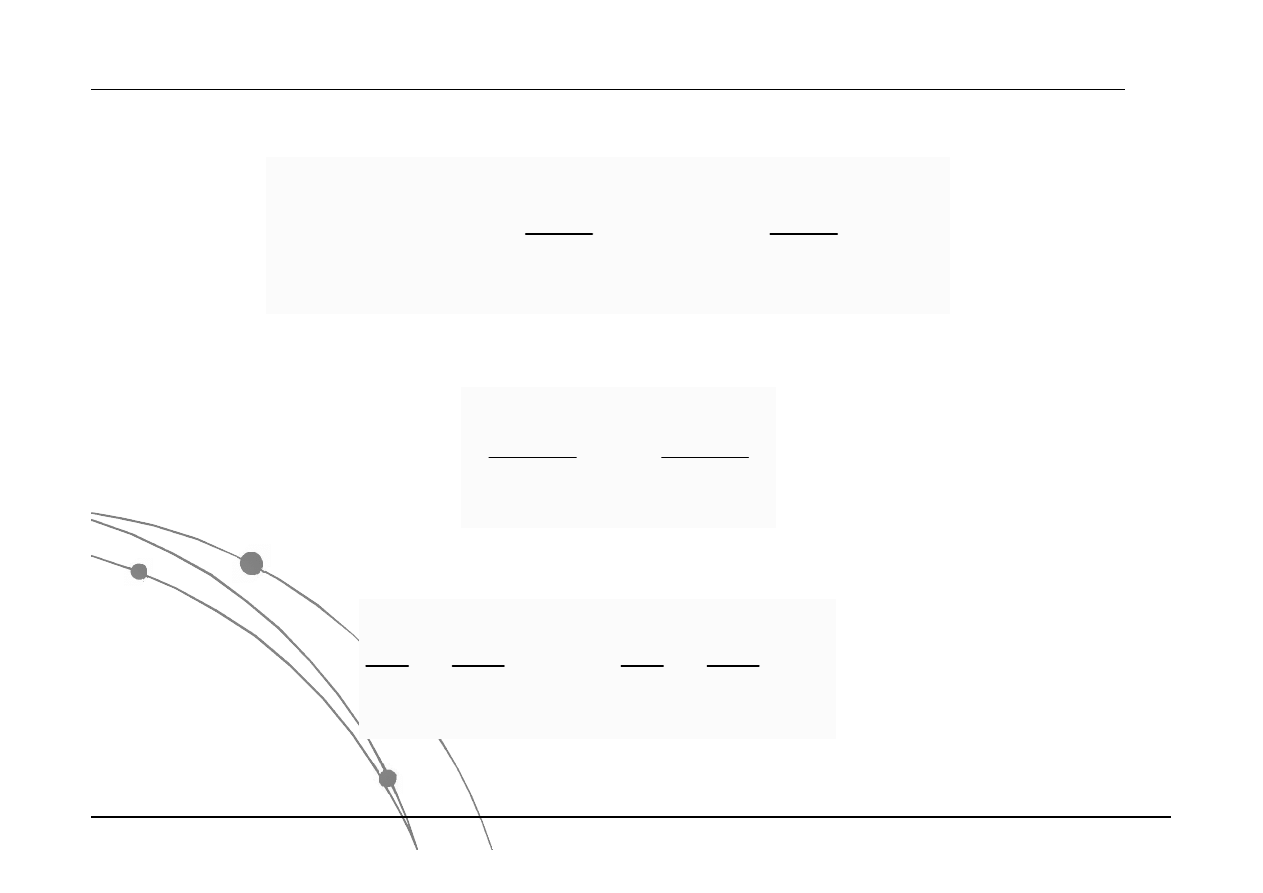
Sformułowanie werbalne:
Prawo Boyle’a-Mariotte’a: W stałej
temperaturze, objętość gazu zmienia się
odwrotnie proporcjonalnie do jego ciśnienia.
Sformułowanie matematyczne:
1
2
2
1
P
P
V
V
Przedmiot i zadania chemii fizycznej
Wykład z Chemii Fizycznej str. 1.1 / 3
1.1. Wprowadzenie
Chemia Fizyczna jako nauka eksperymentalna
Pomiar fizykochemiczny
Precyzja i dokładność
Nieprecyzyjny i
niedokładny
Precyzyjny, lecz
niedokładny
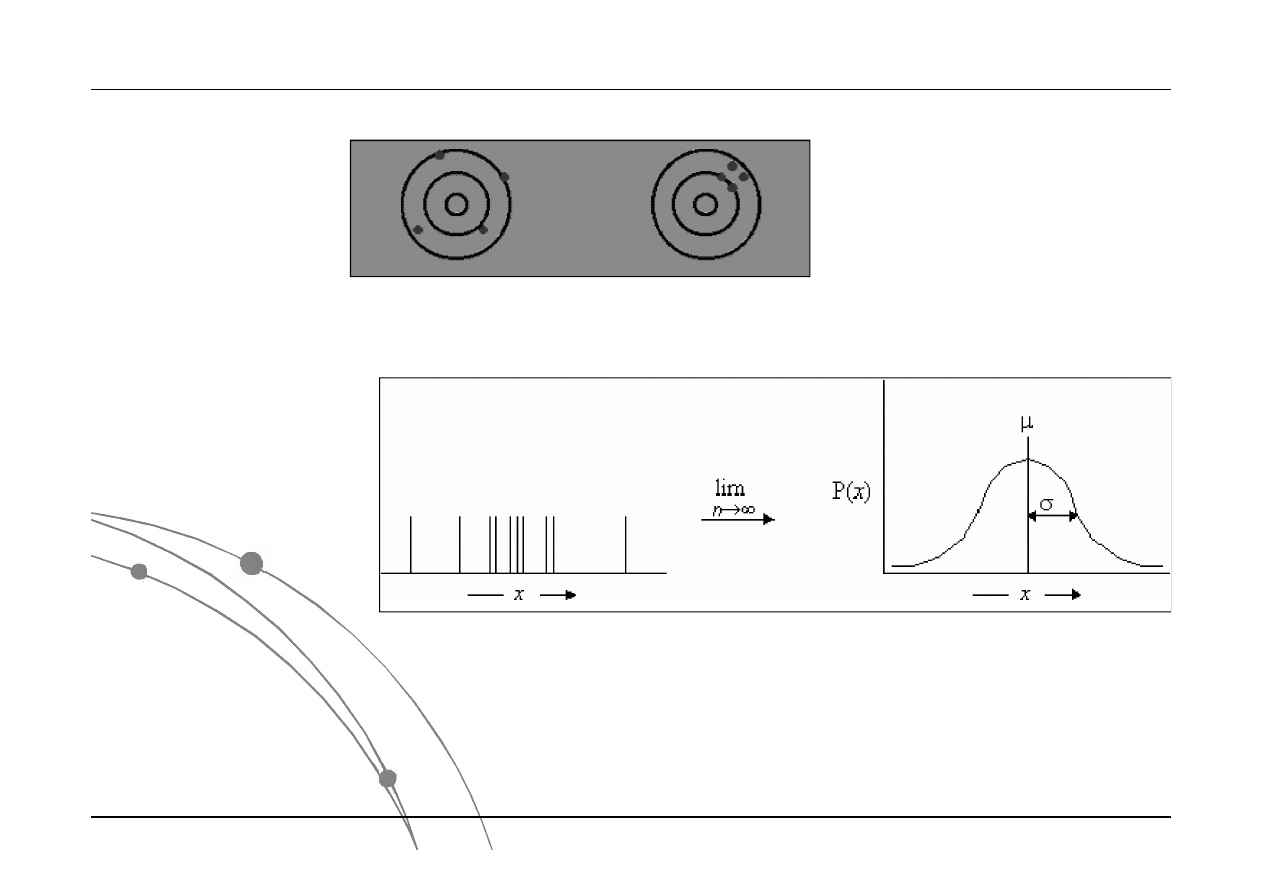
Dystrybucja błędów - Funkcja rozkładu błędów
Powtarzanie
doświadczeń
prowadzi do serii
pomiarów
zgrupowanych
względem wartości
średniej z
charakterystyczną
wartością rozkładu
(odchylenie
standardowe).
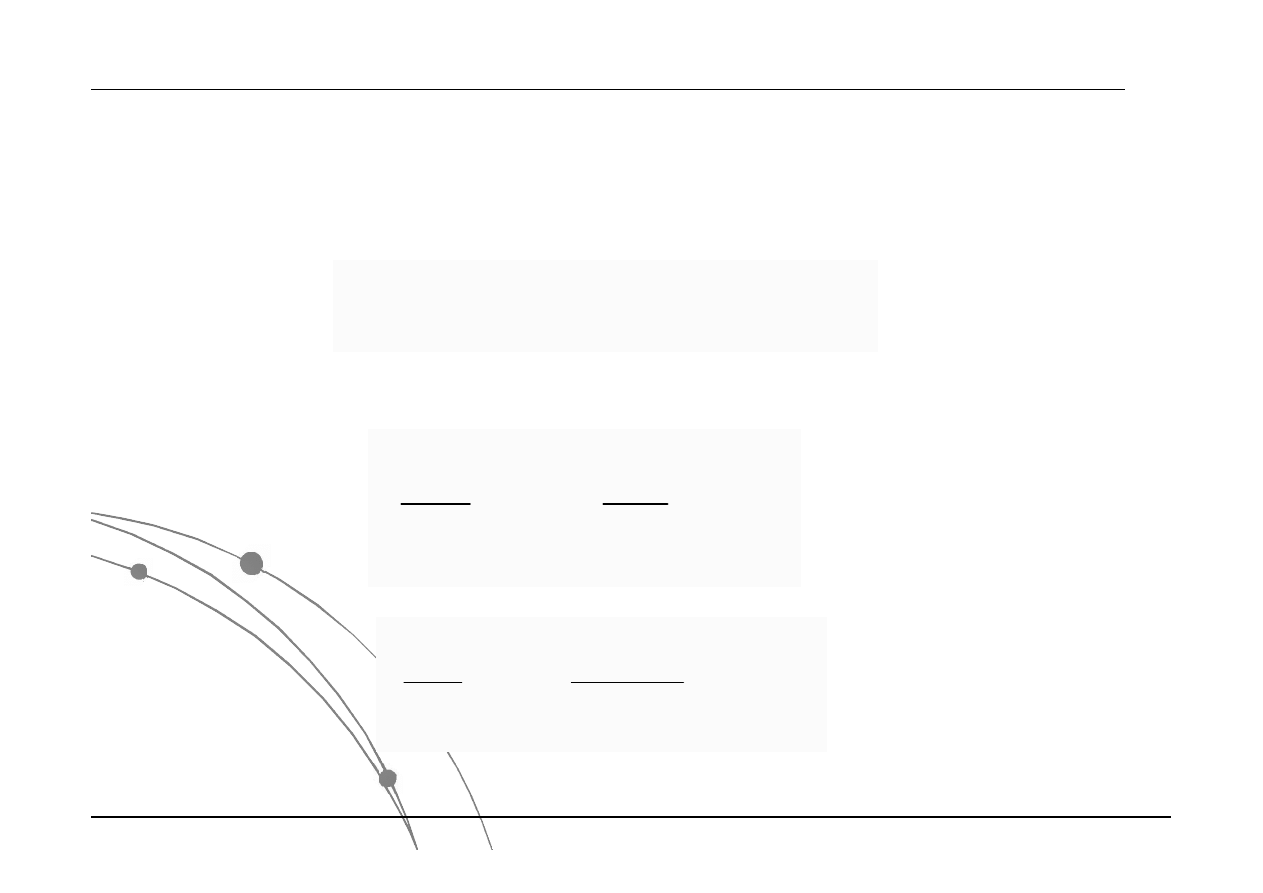
Rozkład normalny jest opisywany za pomocą wartości
średniej i odchylenia standardowego .
Przykładowa interpretacja:
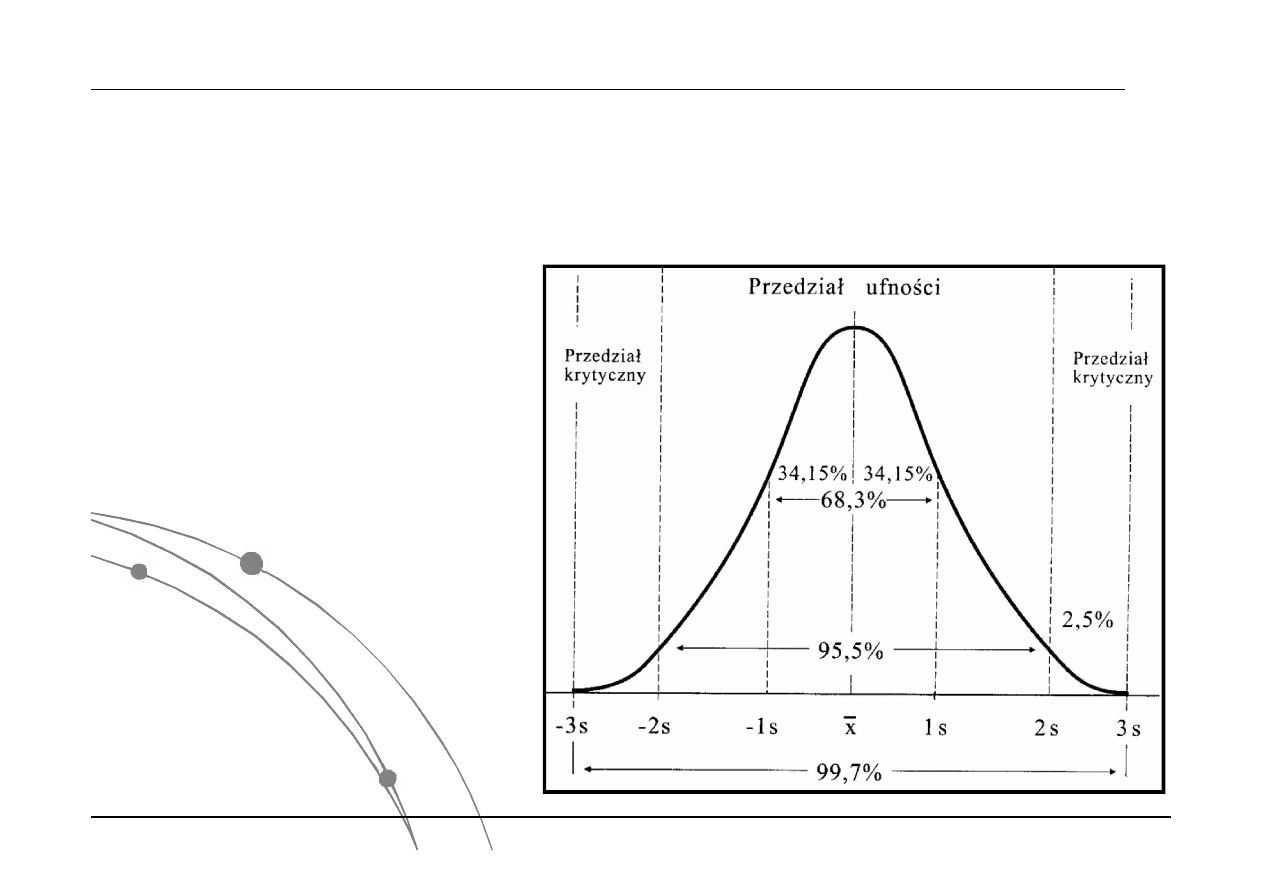
68% powierzchni pod krzywą Gaussa znajduje się w
przedziale ±1; natomiast 95% w przedziale ±2.
Wykład z Chemii Fizycznej str. 1.1 / 4
1.1. Wprowadzenie
)
( X
E
)
( X
V
i
p
i
x
X
E
i
1
)
(
dx
x
xf
X
E
D
.
)
(
.
2
)
(
)
(
dx
x
f
X
E
x
X
V
D
i
p
X
E
i
x
X
V
i
2
)
(
)
(
1
rozkład dyskretny
rozkład ciągły
Wartość oczekiwana
uśredniona wartość przyjmowana przez zmienną
losową.
Wariancja - charakteryzuje rozrzut wartości
zmiennej losowej; jest to średnia z kwadratu
odchylenia zmiennej X od wartości średniej
Rozkład normalny - rozkład Gaussa
2
2
2
/
)
(
2
1
)
(
x
e
x
p
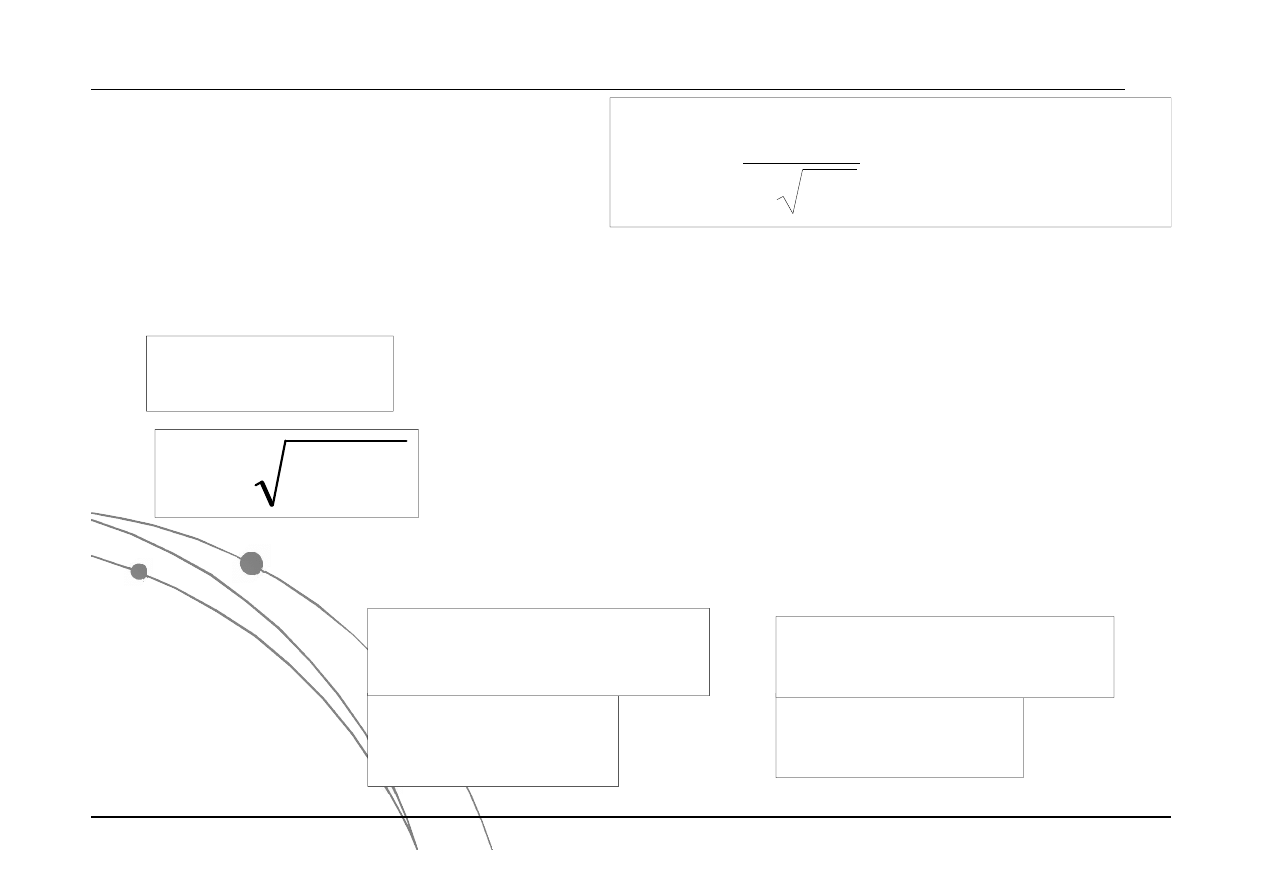
Prawdopodobieństwo, że pomiar wielkości x będzie różnił się od wartości
pewnej o wartości równą odchyleniu standardowemu
Chemia Fizyczna jako nauka eksperymentalna
Wykład z Chemii Fizycznej str. 1.1 / 5
1.1. Wprowadzenie
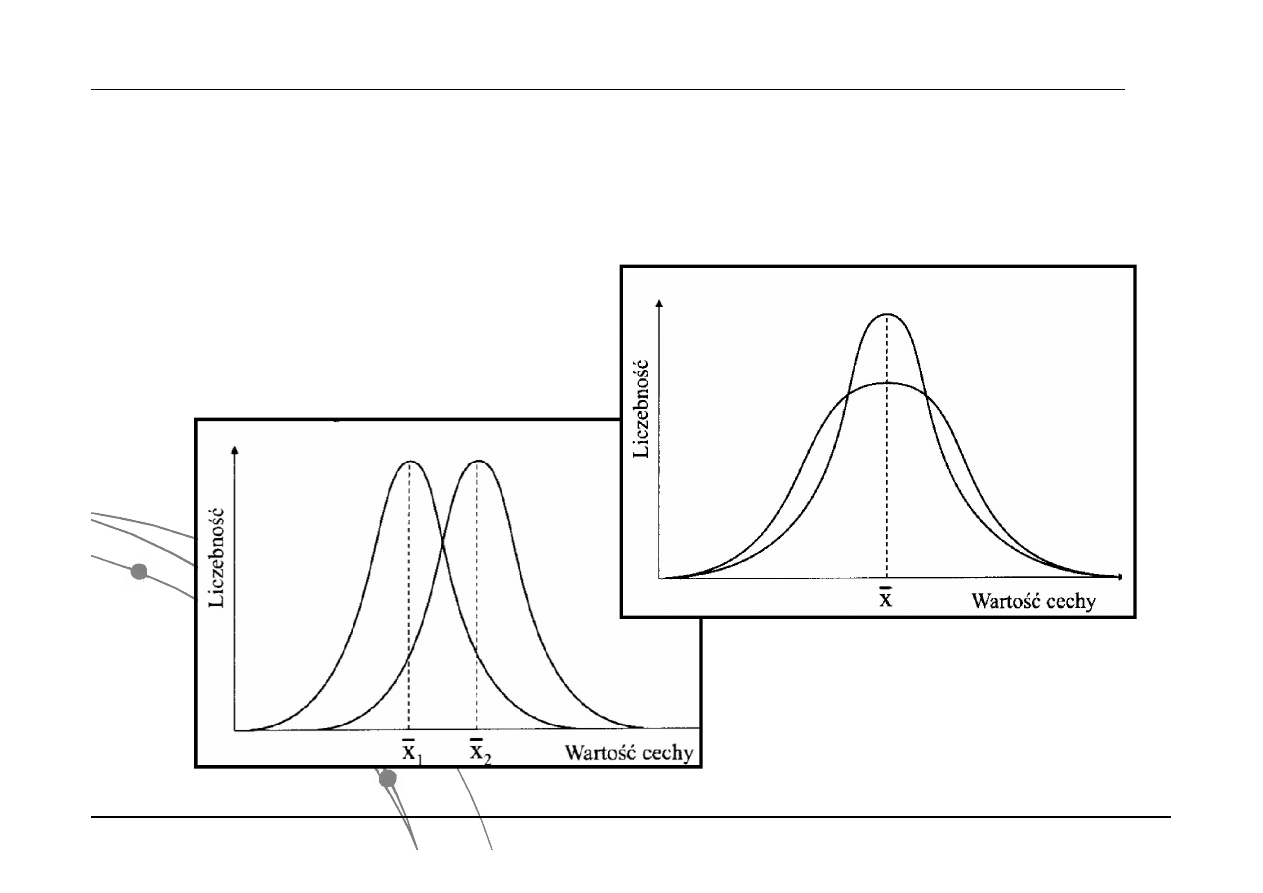
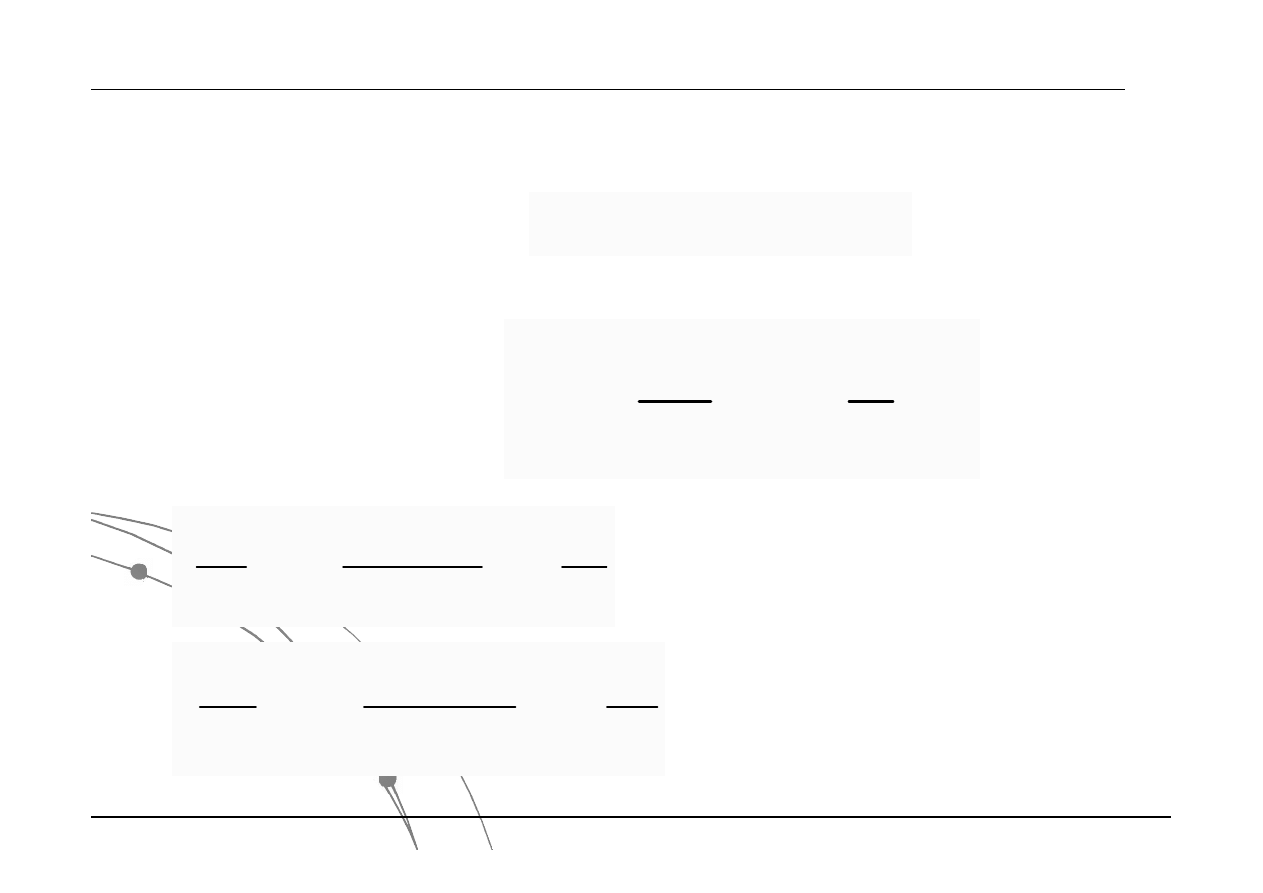
Rozkłady o różnych średnich, ale o tym
samym odchyleniu standardowym
Rozkłady z tą samą średnią, ale o
różnych odchyleniach standardowych
Interpretacja krzywej Gaussa
Chemia Fizyczna jako nauka eksperymentalna
Wykład z Chemii Fizycznej str. 1.1 / 6
1.1. Wprowadzenie
Chemia Fizyczna jako nauka eksperymentalna
Przykład:
Na podstawie pewnych wyników (np.
poziomu składników krwi) lekarz ma
dokonać rozróżnienia między stanem
zdrowia a choroby. Diagnostyka
powinna polegać na odniesienie do
„normalnego” składnika chemicznego
tj. rozkładem tego wskaźnika u osób
zdrowych. Wyniki oddalone od
wartości średniej więcej niż dwa
odchylenia standardowe, a mniej
niż trzy, znajdujące się w
przedziałach krytycznych należy
uważać za istotnie różne od
spodziewanych wyników. Wówczas
ryzyko błędu stanowi 5%. Wyniki
oddalone od średniej mniej niż jedno
odchylenie standardowe są w
granicach dopuszczalnego błędu
przypadkowego i należy uznać je za
wyniki wiarygodne (prawidłowe).
Określenie błędu przypadkowe odbywa się na
podstawie wartości odchylenia standardowego.
Wykład z Chemii Fizycznej str. 1.1 / 7
1.1. Wprowadzenie
Chemia Fizyczna jako nauka eksperymentalna
Opracowanie statystyczne wyników
- błędy pomiarów bezpośrednich
zmierz
rzecz
x
x
d
zmierz
x
d
Błąd bezwzględny
wyrażany w jednostkach
wielkości mierzonej
Błąd względny
wyrażany w procentach lub
jako liczba niemianowana
Błędy przypadkowe - wynikają z losowych fluktuacji warunków pomiarowych. Podlegają rozkładowi
normalnemu (w nielicznych przypadkach możliwe są inne rozkłady błędu). Są naturalnym składnikiem
mierzonych wielkości a oszacowaniem ich wielkości i ich wpływam na wynik analizy zajmują się metody
statystyczne.
Błędy skrajne - błędy przypadkowe o bardzo dużych wartościach i bardzo małym prawdopodobieństwie
wystąpienia. Ponieważ mogą wpłynąć w sposób istotny na wartość średnią wyniku powinny być odrzucane
przy interpretacji przy pomocy odpowiednich testów statystycznych (np. test Deana-Dixona).
Błędy grube - błędy o bardzo dużych wartościach spowodowane czynnikiem ludzkim. Ponieważ podobnie jak
błędy skrajne mogą wpłynąć w sposób istotny na wartość średnią wyniku powinny być odrzucane przy
interpretacji przy pomocy testów statystycznych (np. test Deana-Dixona).
Błędy systematyczne - błędy powodujące systematyczne odchylenie wartości średniej od wartości
rzeczywistej. Wyróżnia się błędy systematyczne proporcjonalne (o wielkości proporcjonalnej do mierzonej
wielkości) i stałe (ich wielkość nie zależy od wielkości mierzonej). Wynikają z czynników aparaturowych,
ludzkich lub odczynnikowych. Eliminowane są w procesie kalibracji.
Wykład z Chemii Fizycznej str. 1.1 / 8
1.1. Wprowadzenie
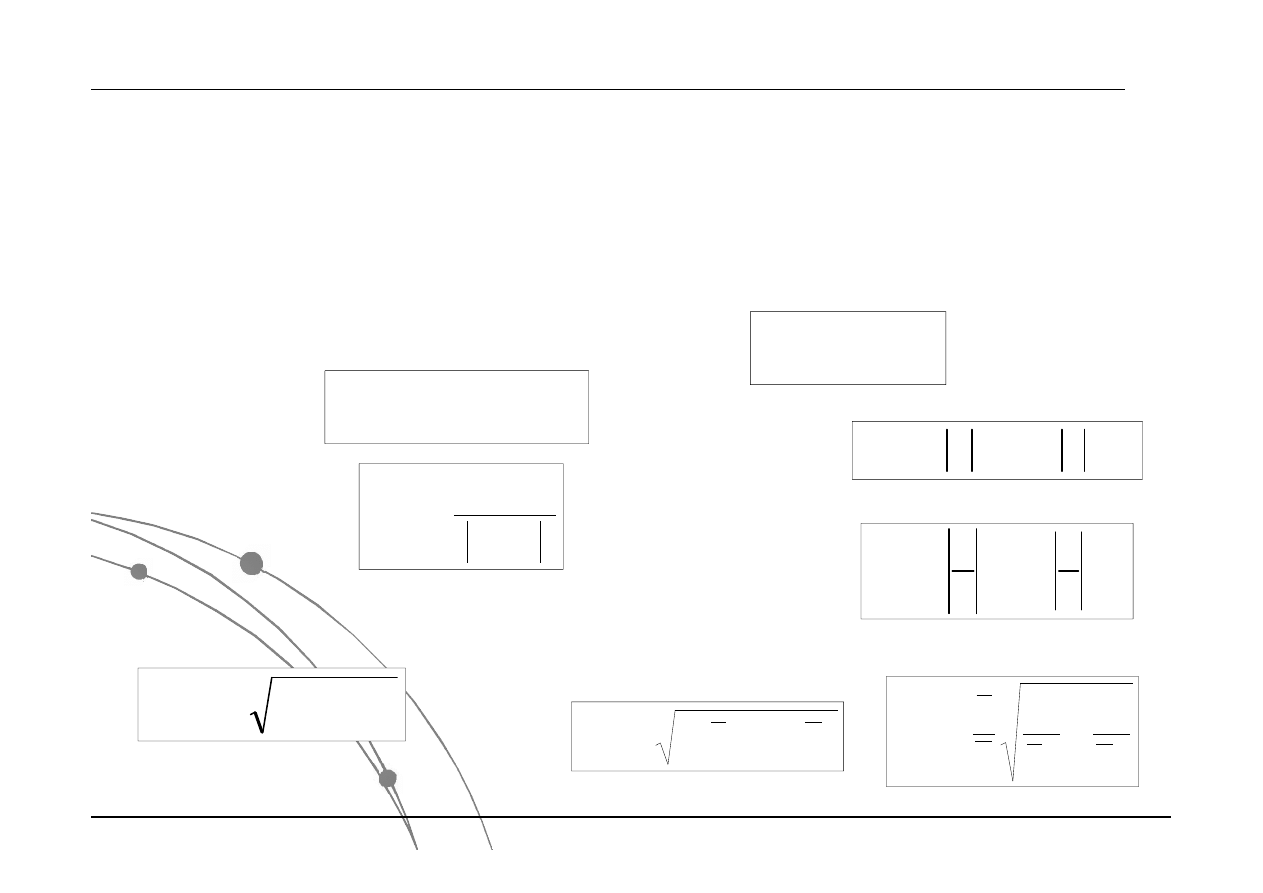
Chemia Fizyczna jako nauka eksperymentalna
opracowanie statystyczne wyników pomiarów
Kumulacja błędów
y
x
y
x
d
d
d
Błąd bezwzględny sumy lub
różnicy dwóch wielkości fizycznych
jest równy sumie błędów
bezwzględnych popełnionych przy
ich pomiarze:
Dodawanie i odejmowanie
x y
x
y
2
2
y
x
d
d
y
x
y
x
Błąd względny
Błąd odchylenia kwadratowego jest
sumowany z kwadratem:
Mnożenie i dzielenie
Błąd bezwzględny iloczynu lub ilorazu
wartości dwóch wielkości zmierzonych
bezpośrednio. Mnożąc przez liczbę
x
kx
kd
d
Mnożąc wartości prze siebie
y
x
y
x
d
x
d
y
d
Dzieląc wartości przez siebie
y
x
y
x
d
x
d
y
d
1
1
/
Błąd względny iloczynu lub ilorazu:
2
2
2
2
y
x
y
x
y
x
2
2
2
2
y
x
y
x
y
x
y
x
Wykład z Chemii Fizycznej str. 1.1 / 9
1.1. Wprowadzenie
Chemia Fizyczna jako nauka eksperymentalna
opracowanie statystyczne wyników pomiarów
Cyfry znaczące:
123,456
123,456
6
6
123,4500
123,4500
7
7
0,123
0,123
3
3
0,00123000
0,00123000
6
6
1,2∙10
1,2∙10
3
3
2
2
1,200∙10
1,200∙10
3
3
4
4
0,001234000
0,001234000
7
7
x
Notacja wielkości obarczonej błędem
np.: 1.7 0.2 m oznacza średnią wartość 1.7,
odchylenie standardowe 0.2, a precyzja wynosi 0.1
Błędy pomiarowe oblicza się z dokładnością
(liczba cyfr znaczących) wyznaczoną przez
urządzenie pomiarowe zaokrąglając w górę.
Wykład z Chemii Fizycznej str. 1.1 / 10
1.1. Wprowadzenie
Chemia Fizyczna jako nauka eksperymentalna
opracowanie statystyczne wyników pomiarów
Uwagi dotyczące notacji wyników:
Po wykonaniu ćwiczenia oraz dokonaniu niezbędnych obliczeń w
ćwiczeniu uzyskuje się wartości liczbową wyznaczanej wartości oraz
błędu. np.:
E = 123,45678923
∆E = 0,01376893
Czy można wynik przedstawić w postaci?
∆E = 123,45678923 ± 0,01376893
Odpowiedź: OCZYWIŚCIE NIE!!!!
Przyczyny złego podawania wyników:
- Brak jednostki
- Zbyt duża liczb znaczących w wartości błędu
(zapis błędu zbyt dokładny)
- Zbyt duża liczb znaczący w wyniku
(zapis wyniku zbyt dokładny w porównaniu do oszacowanego błędu
Wykład z Chemii Fizycznej str. 1.1 / 11
1.1. Wprowadzenie
Chemia Fizyczna jako nauka eksperymentalna
opracowanie statystyczne wyników pomiarów
Sposób korekty:
1.
1. Ustalenie jednostki obliczonej wielkości (układ SI)
Ustalenie jednostki obliczonej wielkości (układ SI)
E
E
= 123,45678923 [J]
= 123,45678923 [J]
∆
∆
E
E
= 0,01376893 [J]
= 0,01376893 [J]
zamiast
zamiast
∆
∆
E
E
= 0,01376893 [J]
= 0,01376893 [J]
∆
∆
E
E
= 0,014 [J]
= 0,014 [J]
E
E
= (123,457
= (123,457 ±
± 0,014) [J]
0,014) [J]
2.
2. Zapisanie poprawne błędu: dokł
Zapisanie poprawne błędu: dokładno
adnośści
cią
ą do jednej
do jednej
cyfry znacz
cyfry znaczą
ącej
cej,, a w szczególnych przypadkach do dwóch
a w szczególnych przypadkach do dwóch
cyfr znacz
cyfr znaczą
ących.
cych.
Przy zaokrąglaniu pojawia si
Przy zaokrąglaniu pojawia się
ę dylemat:
dylemat:
∆
∆
E
E
= 0,01 [J]
= 0,01 [J] czy
czy ∆
∆
E
E
= 0,02 [J]
= 0,02 [J]
B
Błę
łędy nale
dy należży zaokr
y zaokrą
ągla
glaćć „„w
w gór
górę
ę", lecz w przypadku, gdy
", lecz w przypadku, gdy
pierwsz
pierwszą
ą cyfr
cyfrą
ą znacz
znaczą
ąccą
ą b
błę
łędu jest jedynka lub dwójka
du jest jedynka lub dwójka
stosuje si
stosuje się
ę zapis z dwoma cyframi znacz
zapis z dwoma cyframi znaczą
ącymi.
cymi.
Uwaga:
Uwaga:
gdyby
gdyby ∆
∆
E
E
= 0,7376893 [J] to
= 0,7376893 [J] to ∆
∆
E
E
= 0,8 [J]
= 0,8 [J]
3.
3. Wynik powinien być zapisany z taką samą dokładnością z jaką zapisano błąd. W
Wynik powinien być zapisany z taką samą dokładnością z jaką zapisano błąd. W
tym wypadku nie chodzi o ilość cyfr znaczących, lecz o dokładność wyniku, (tzn.
tym wypadku nie chodzi o ilość cyfr znaczących, lecz o dokładność wyniku, (tzn.
konieczna jest jednakowa liczba miejsc po przecinku w wyniku oraz błędzie)
konieczna jest jednakowa liczba miejsc po przecinku w wyniku oraz błędzie)
E
E
= 9,45673 ∙ 10
= 9,45673 ∙ 10
4
4
[J]
[J]
źle
źle
E
E
= 1,2 ∙ 10
= 1,2 ∙ 10
8
8
±
± 1,6 ∙ 10
1,6 ∙ 10
7
7
[J] (różne wykładniki)
[J] (różne wykładniki)
poprawnie:
poprawnie:
E
E
= (12,1
= (12,1 ±
± 1,6) ∙ 10
1,6) ∙ 10
7
7
[J]
[J]
Wykład z Chemii Fizycznej str. 1.1 / 12
1.1. Wprowadzenie
Chemia Fizyczna jako nauka eksperymentalna
opracowanie statystyczne wyników pomiarów
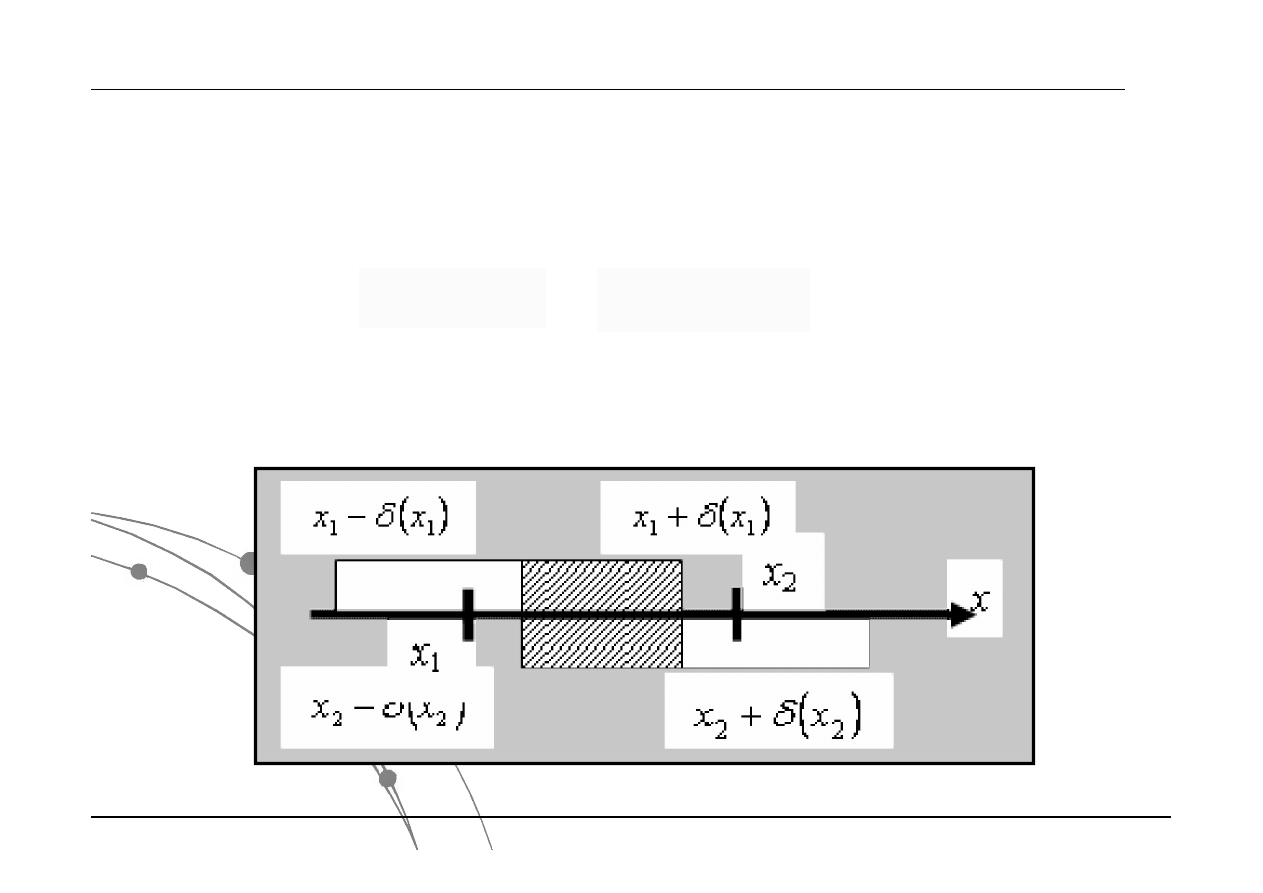
Porównywanie wyników pomiarów
daną wielkość fizyczną x wyznaczono dwoma metodami otrzymując wyniki
1
1
x
2
2
x
Wyniki obu pomiarów są zgodne, jeżeli przedziały błędów mają część wspólną
lub są, co najmniej styczne:
Wykład z Chemii Fizycznej str. 1.1 / 13
1.1. Wprowadzenie
Opracowanie statystyczne wyników
- błędy pomiarów pośrednich
W praktyce zazwyczaj wyznacza się wartość danej wielkości fizycznej poprzez pomiar
wartości innych określonych wielkości fizycznych, pomiędzy którymi istnieje znana
zależność funkcyjna. Jak w takich przypadkach obliczyć błąd wyniku końcowego na
podstawie pomiarów poszczególnych wielkości?
Problem ten można rozwiązać za pomocą rachunku różniczkowego.
)
,...,
(
1
n
x
x
f
x
n
x
n
x
dx
x
f
dx
x
f
dx
n
j
i
j
...
1
1
W celu obliczenia błędu
bezwzględnego funkcji zastępuje
się różniczki dx
1
, ..., dx
n
wartościami błędów
bezwzględnych (x
1
), ..., (x
n
)
)
(
...
)
(
)
(
1
1
n
x
n
x
x
x
f
x
x
f
x
n
j
i
j
Wyznaczenie błędu bezwzględnego funkcji metodą różniczki zupełnej
)
,...,
(
1
2
n
i
f
x
x
f
Odchylenie standardowe funkcji
Chemia Fizyczna jako nauka eksperymentalna
Wykład z Chemii Fizycznej str. 1.1 / 14
1.1. Wprowadzenie
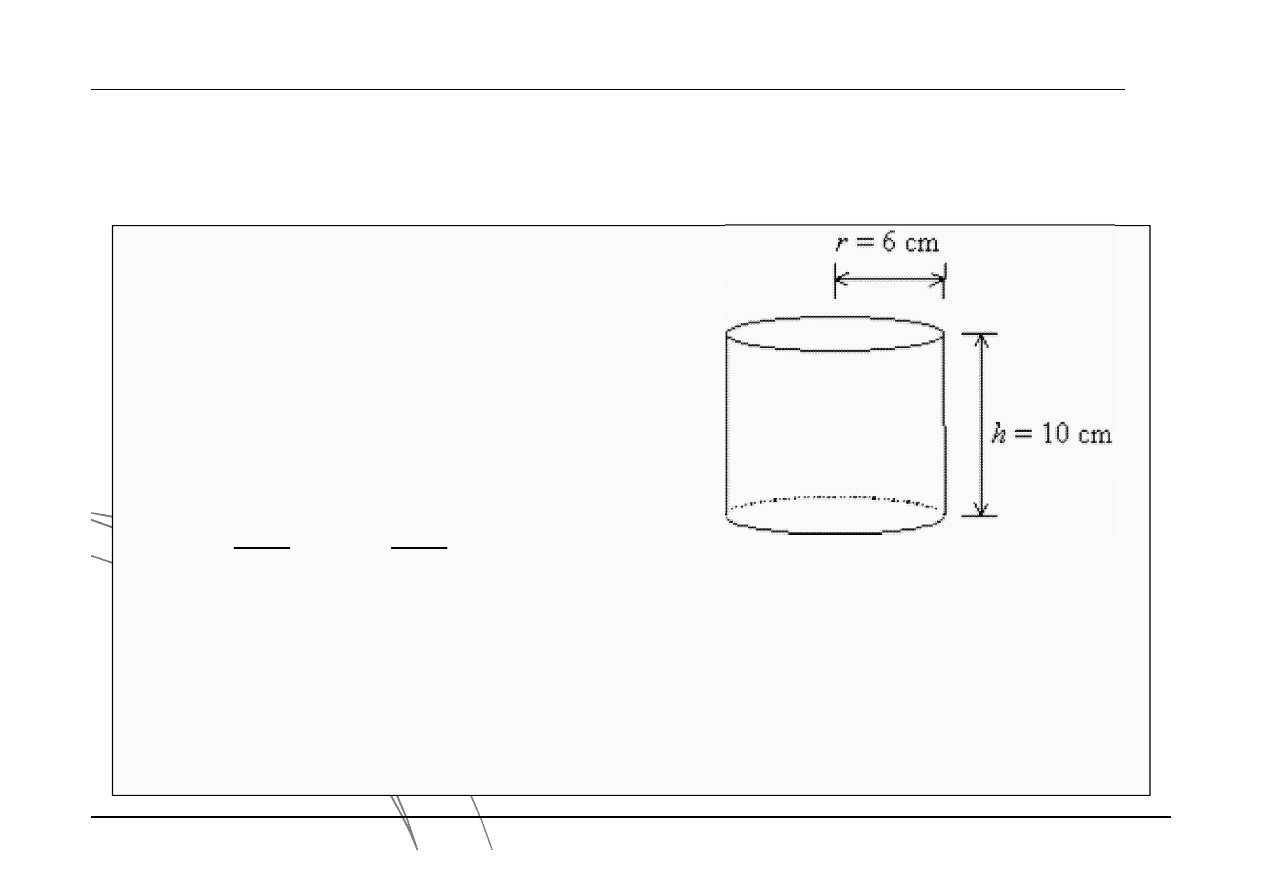
Chemia Fizyczna jako nauka eksperymentalna
Przykład:
wyznaczenie objętości cylindra mierząc wysokość oraz promień.
3
2
2
1131
6
10
,
cm
cm
cm
r
h
r
h
f
V
Błąd odczytu długości na liniale wynosi +0.1 cm
dh
r
dr
r
h
dh
h
V
dr
r
V
dV
r
h
2
2
3
3
3
2
49
11
38
1
,
0
6
1
,
0
6
2
10
cm
cm
cm
cm
cm
cm
cm
cm
Wykład z Chemii Fizycznej str. 1.1 / 15
1.1. Wprowadzenie
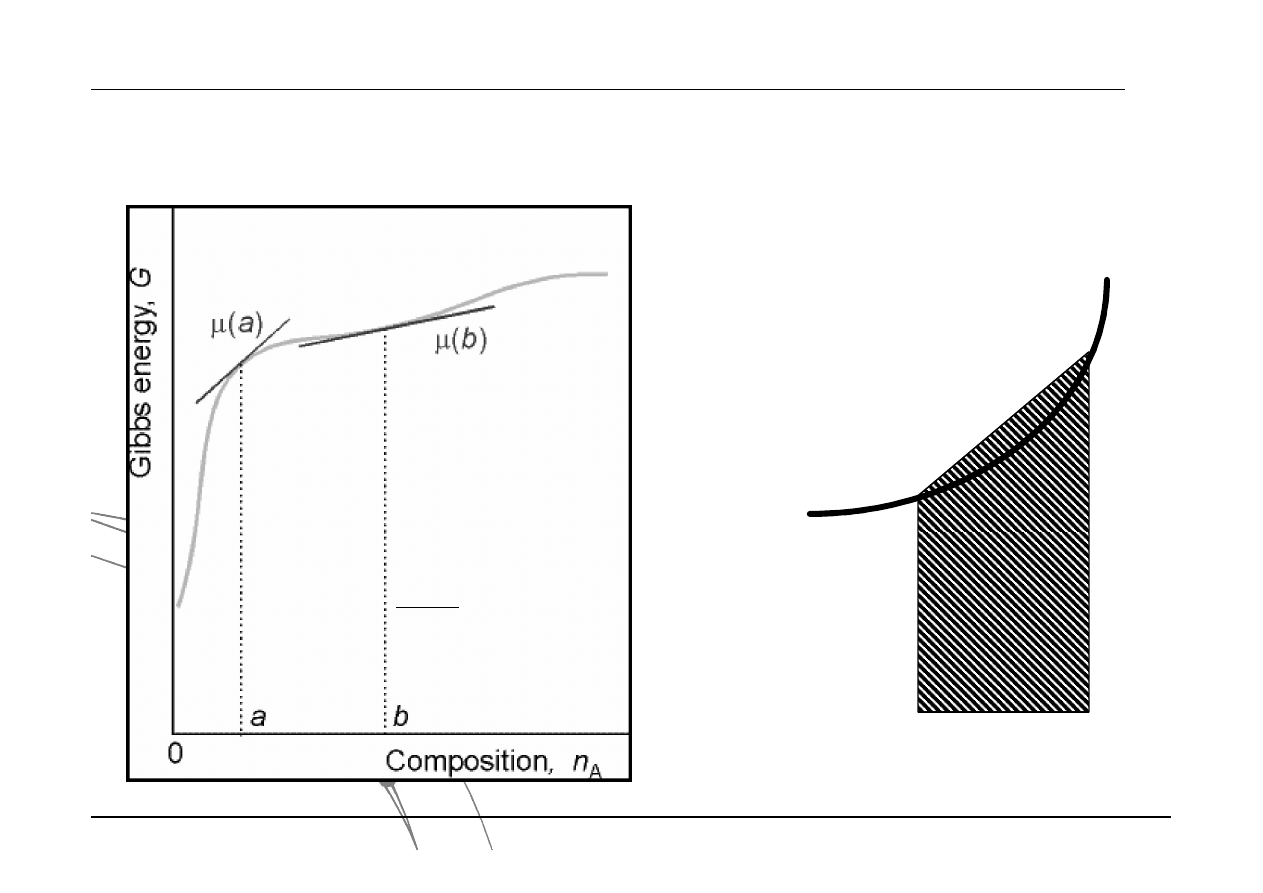
Uzupełnienie z matematyki
Graficzne metody obliczeniowe
Różniczkowanie graficzne
Interpretacja graficzna pierwszej pochodnej
Całkowanie graficzne
Interpretacja graficzna wartości
całki oznaczonej
y
1
y
2
x
2
- x
1
y(x)
Metoda trapezów
dn
n
G
d
T
p,
Wykład z Chemii Fizycznej str. 1.1 / 16
1.1. Wprowadzenie
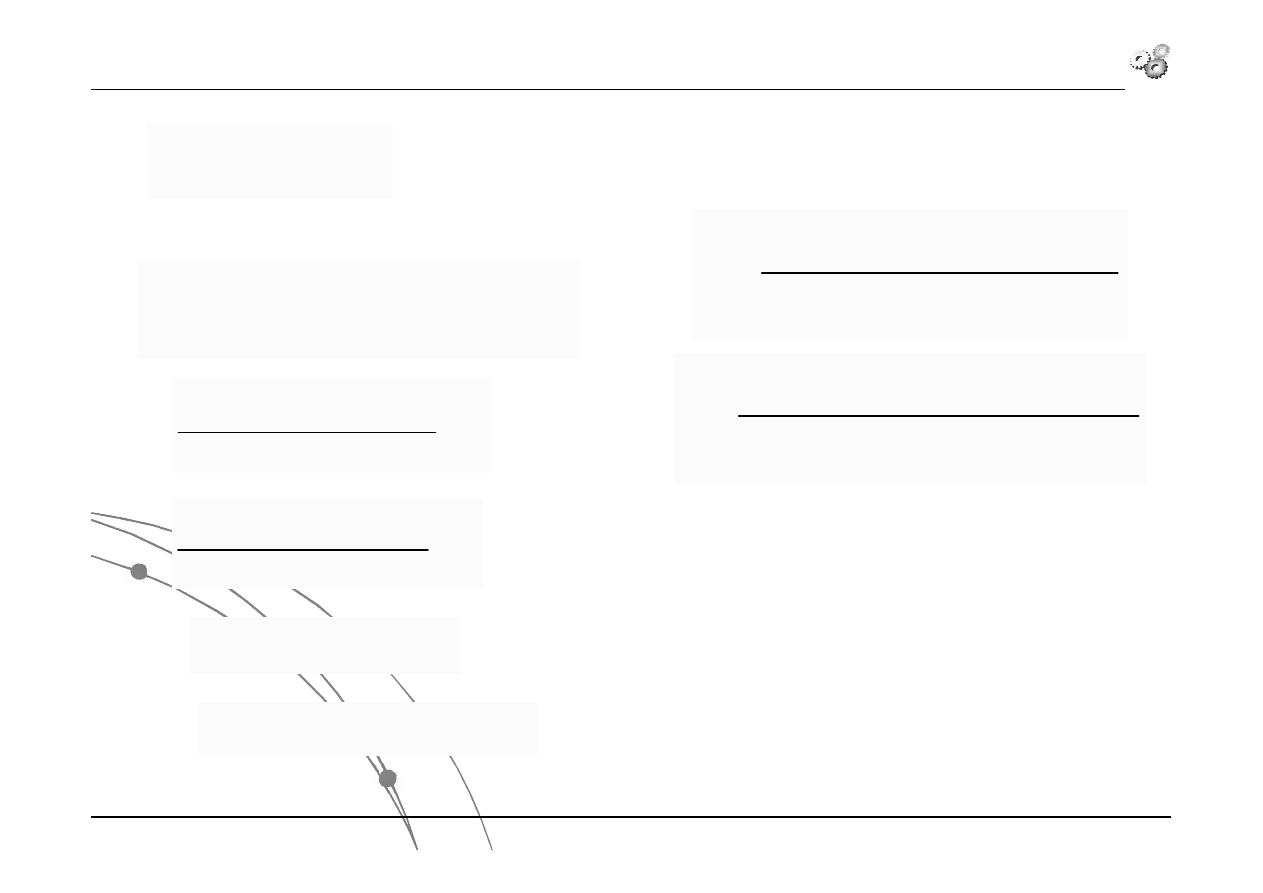
Różniczka zupełna
Uzupełnienie z matematyki
dy
y
F
dx
x
F
y
x
dF
x
y
)
,
(
warunkiem, aby wyrażenie różniczkowe było różniczką zupełną:
Wyrażenie różniczkowe:
x
y
F
y
x
F
2
2
y
x
x
y
y
F
x
x
F
y
lub alternatywnie
Wykład z Chemii Fizycznej str. 1.1 / 17
1.1. Wprowadzenie
TdP
PdT
dY
Przykład:
Czy poniższe wyrażenie jest różniczką zupełną?
1
T
y
P
P
x
F
Odpowiedź: NIE , gdyż
1
)
(
P
x
T
T
y
F
Uzupełnienie z matematyki
Wykład z Chemii Fizycznej str. 1.1 / 18
1.1. Wprowadzenie
Przykład:
Czy jest możliwe przekształcenie wyrażenia różniczkowego na
różniczkę zupełną?
TdP
PdT
dY
Odpowiedź: TAK, gdyż
dP
T
dT
T
P
dJ
1
2
2
2
1
)
/
(
T
P
T
P
x
F
T
y
2
1
)
/
1
(
T
T
T
y
F
P
x
Uzupełnienie z matematyki
Wykład z Chemii Fizycznej str. 1.1 / 19
1.1. Wprowadzenie

Anamorfoza liniowa
Ustalanie związku funkcyjnego dla wielkości zmierzonych
Uzupełnienie z matematyki
Wykład z Chemii Fizycznej str. 1.1 / 20
1.1. Wprowadzenie
2
2
)
(
.
i
i
i
i
i
x
x
n
y
x
y
x
n
a
2
2
2
.
.
i
i
i
i
i
i
i
x
x
n
x
y
x
x
y
b
Rozwiązaniem są równania
b
ax
y
Warunek minimalizacji:
min
)
(
2
b
ax
y
i
i
i
0
)
(
2
a
b
ax
y
i
i
0
)
(
2
b
b
ax
y
i
i
i
i
x
a
nb
y
2
i
i
i
i
x
a
x
b
y
x
Metoda najmniejszych kwadratów
Uzupełnienie z matematyki
Wykład z Chemii Fizycznej str. 1.1 / 21
1.1. Wprowadzenie
Wyszukiwarka
Podobne podstrony:
Metodyka Obiektowa pojęcia podstawowe
Pojęcia podstawowe, excel
Pojęcia podstawowe, Studia, Prawo, Prawo Kanoniczne
1 pojecia podstawoweid 8796
1 Kancelaria współczesna pojęcia podstawowe
Pojęcie, Podstawy ubezpieczeń, Podstawy ubezpieczeń
Pojęcia podstawowe w układach trójfazowych, POLITECHNIKA LUBELSKA w LUBLINIE_
Z chaosu, Ergonomia-pojecia podstawowe, 1-1
Pojęcia podstawowenowotwory
Pojęcia podstawowe 2
Pojęcia podstawowe
A4 1 Procesy cieplne Ruch ciepła – pojęcia podstawowe
03 Budowa polimerów, pojęcia podstawoweid 4327 ppt
więcej podobnych podstron